扩展功能
文章信息
- 朱明珍, 初红, 卢祖能
- ZHU Ming-Zhen, CHU Hong, LU Zu-Neng
- 腕管综合征患者口服及局部注射类固醇疗效的临床和神经超声评估研究
- Clinical effect and neurosonological evaluation of oral administration and local injection of steroid in patients with carpal tunnel syndrome
- 国际神经病学神经外科学杂志, 2016, 43(6): 491-496
- Journal of International Neurology and Neurosurgery, 2016, 43(6): 491-496
-
文章历史
收稿日期: 2016-09-07
修回日期: 2016-11-14
腕管综合征(CTS) 是临床最常见的周围神经压迫综合征[1],主要由于腕管内正中神经受压,从而导致疼痛,麻木甚至萎缩无力[2]。成人患病率估计在4%~5%之间,特别是40~60岁之间的更年期女性[3]。目前CTS诊断的金标准是肌电图检测,但若要全面了解损伤神经的病理及周围结构,则需要高频神经超声的检查[4],通过超声可观察正中神经的形状、神经内部血流变化及周围组织解剖结构[5],正中神经横截面积(CSA) 的测量是最重要和最常用检测参数[6]。CTS限制了患者的日常生活和活动的能力,通过治疗可改善症状,防止疾病进展及手功能的丧失[7]。CTS的非手术治疗方法包括中立位腕部夜间夹板固定[8],口服及腕管局部注射类固醇[9]。本研究通过临床评分及神经超声评估口服及局部注射类固醇的疗效。
1 对象与方法 1.1 研究对象 1.1.1 纳入标准纳入者符合以下①~⑥中任意一项加上⑦项:① 正中神经支配手、前臂、上臂的麻木疼痛;② 手部肿胀感或感觉异常;③ 夜间或清晨麻醒;④ 重复活动后加重,休息或甩手后减轻;冬季比夏季重;⑤ 握拳无力或鱼际肌萎缩;⑥ Phalen征或Tinel征阳性;⑦ 肌电图检查提示符合CTS表现[10]。
1.1.2 排除标准研究对象需排除① 严重多神经病、颈神经根病变、下臂丛损害和正中神经近端病变;② 腕部畸形或外伤;③ 使用激素禁忌证;④ 之前接受过药物或手术治疗的CTS患者;⑤ 糖尿病、类风湿关节炎、甲状腺功能减退、肌炎与肌病;⑥ 认知功能障碍影响症状描述和主观功能的评估[10]。
1.2 方法与步骤 1.2.1 电生理检测按美国电诊断协会(AAEM) 推荐的方法进行前瞻性研究,研究对象经知情同意后首先进行肌电图检查明确CTS诊断。应用丹麦Keypoint4型肌电图仪,检测者固定,室温28~30℃,保持手部皮温维持在32℃以上[11]。神经传导检测采用表面电极,分别在腕部刺激正中神经和尺神经。主要记录以下参数:① 拇短展肌和小指展肌处的末端运动潜伏期(DML);② 食指、环指、小指的感觉传导速度(SCV);③ 正中、尺神经感觉潜伏期差(△DSL)(环指记录)。正常参考值参照本肌电图室标准。异常判断标准[10, 12]:① 腕-拇短展肌DML>3.54 ms;② 腕-食指SCV < 45.1 m/s和腕-环指SCV < 43.5 m/s;③△DSL≥0.4 ms。根据电生理严重程度分别将患者分为轻、中、重、极重度4组。见表 1。
对CTS患者进行问卷调查式临床评分,采用总体症状评分(Global symptom score, GSS) 和波士顿CTS问卷评分(Bostom carpal tunnel syndrome questionnaire, BCTQ)。GSS包括5个问题,涉及疼痛、麻木、感觉异常、无力和夜间症状。GSS每一项为0分至10分,0分无症状,10分症状最严重[14]。BCTQ包括症状严重程度(SSS) 和功能状态(FSS)。SSS包括11个问题,主要了解夜间和日间疼痛或麻木的严重程度、频率和持续时间;FSS包括8个问题,主要了解日常活动困难程度,如书写、扣纽扣和干家务等。SSS和FSS每项分值为1分(最轻) 至5分(最重),最后分别计算得分[15]。在治疗前、治疗后1月进行临床评分,计算治疗前后GSS、SSS、FSS差值得到△GSS、△SSS、△FSS。
1.2.3 高频神经超声检测患者经电生理检测诊断为CST后,进行神经超声检测,期间相隔不超过一周。采用德国SIEMENS ACUSON X300型彩色超声检测仪VF 13-5探头,所有患者均由同一检测者检测。
被检测者取卧位,手掌向上平放于检测床[12]。① 横向扫描:移动探头在以下4个平面测量正中神经CSA,分别得到CSA (1、2、3、4)(图 1)。计算CSA1与CSA4之比(R-CSA);计算治疗前后CSA1、CSA2、CSA3、CSA4、R-CSA差值得到△CSA1、△CSA2、△CSA3、△CSA4、△R-CSA。② 纵向扫描:测量纵向扫描最细和最粗切面的直径分别得到D1、D2(图 2)。计算D2与D1之差D;计算治疗前后D值的差值得到△D。
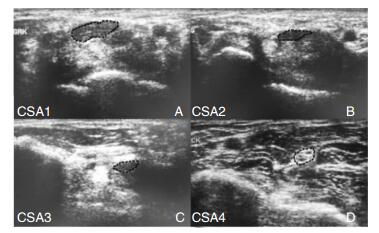
|
| 图 1 一例重度CTS患者正中神经高频超声横向扫描的图像所示正中神经各层面横截面积(CSA)。注:A:腕管入口(豌豆骨水平),CSA1=0.28 cm2;B:腕管中点(钩骨钩水平),CSA2=0.12 cm2;C:腕管出口(钩骨远侧缘水平),CSA3=0.09 cm2;D:前臂(远端旋前方肌水平),CSA4=0.07cm2;CSA1与CSA4比值=0.28/0.07=4。 |
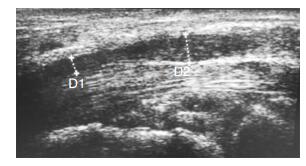
|
| 图 2 一例重度CTS患者正中神经高频超声纵向扫描的图像,CTS患者近端腕管正中神经卡压部位。注:D1:腕管处(钩骨钩水平) 正中神经内径(1.7 mm);D2:腕管入口处(豌豆骨水平) 正中神经内径(3.1 mm) |
在这项前瞻性、随机、平行处理的研究中,研究对象经书面知情同意后自愿入组。按入组序号随机分组,单号患者口服类固醇(口服组,22例),前10 d口服强的松片20 mg/d,后10 d口服10 mg/d;双号患者腕管局部注射组类固醇(注射组,20例),给予利多卡因1 ml (20 mg) 以及甲基强的松龙1 ml (40 mg)。
注射组首先对患者手腕清洁消毒,然后在超声引导下,由腕横纹近侧入针,针头对食指,与皮肤呈30°角,沿着掌长肌腱内侧进针(Ulnar-I),将药物注入腕管正中神经周围[10]。治疗前及治疗后1个月进行超声检测,了解腕部正中神经及周围组织变化情况。
1.3 统计学方法采用SPSS 20.0软件进行统计分析,计量资料采用均数±标准差(x±s) 表示。用Kolmogorov-Smirnov对计量资料作正态性检验。配对计量资料的比较用配对t检验;两组差值均数的比较采用独立样本t检验。P < 0.05认为差异有统计学意义。
2 结果 2.1 临床资料本实验室从2015年8月至2016年7月共收集入组病例42例,口服组22例,注射组20例;双手发病者口服组19例,注射组19例;右手发病者口服组3例,注射组1例,两组均无左手发病者。两组CTS患者在性别、年龄、身高、体重、是否停经、是否伴有疼痛、是否伴有萎缩、左手发病病程及右手发病病程上差异无统计学意义(P > 0.05)。见表 2。
| 项目 | 口服组 | 注射组 | t值 | P值 |
| 性别(女/男) | 19/3 | 19/1 | 0.190 | 0.663 |
| 年龄(岁) | 51.5±11.2 | 58.0±11.9 | 0.378 | 0.057 |
| 身高(cm) | 160.5±5.0 | 159.2±3.5 | 0.108 | 0.245 |
| 体重(Kg) | 59.9±6.2 | 60.9±9.5 | 0.023 | 0.668 |
| 是否停经(是/否) | 14/5 | 15/4 | 0.000 | 1.000 |
| 是否伴有疼痛(是/否) | 14/8 | 9/11 | 0.065 | 0.799 |
| 是否伴有萎缩(是/否) | 19/3 | 17/3 | 0.000 | 1.000 |
| 左手病程(月) | 10.8±25.6 | 33.1±61.3 | 0.024 | 0.126 |
| 右手病程(月) | 29.2±39.6 | 39.0±59.9 | 0.239 | 0.502 |
CTS患者治疗后GSS、SSS及FSS等临床评分,CSA1、CSA2、CSA3、D、R-CSA等超声检测参数均较治疗前减少,差异有统计学意义(P < 0.05)。见表 3、表 4。
| 参数 | 治疗前 | 治疗后 | t值 | P值 |
| GSS | 23.79±7.82 | 13.46±4.89 | 9.558 | 0.000 |
| SSS | 25.23±6.99 | 17.23±3.87 | 8.047 | 0.000 |
| FSS | 12.88±4.59 | 9.90±2.57 | 5.911 | 0.000 |
| 参数 | 治疗前 | 治疗后 | t值 | P值 |
| CSA1 | 15.76±4.65 | 14.71±4.97 | 8.274 | 0.000 |
| CSA2 | 10.66±2.31 | 10.36±2.09 | 2.607 | 0.013 |
| CSA3 | 8.44±1.34 | 8.23±1.27 | 2.110 | 0.041 |
| CSA4 | 6.65±0.76 | 6.54±0.76 | 0.138 | 0.262 |
| D | 0.66±0.36 | 0.44±0.28 | 13.096 | 0.000 |
| R-CSA | 2.37±0.65 | 2.24±0.67 | 5.996 | 0.000 |
注射组较口服组△CSA1、△R-CSA增加,差异有统计学意义(P < 0.05),且两者共同评估疗效更有意义。见表 5、表 6。
| 组别 | △GSS | △SSS | △FSS |
| 口服组 | 10.64±7.64 | 8.64±6.71 | 2.80±3.20 |
| 注射组 | 10.00±7.48 | 7.30±7.16 | 3.17±3.85 |
| t值 | 0.856 | 0.629 | 0.445 |
| P值 | 0.771 | 0.508 | 0.715 |
| 组别 | △CSA1 | △CSA2 | △CSA3 | △CSA4 | △D | △R-CSA |
| 口服组 | 0.32±1.77 | 0.12±1.10 | 0.02±0.91 | 0.15±0.48 | 1.06±0.70 | 0.01±0.28 |
| 注射组 | 1.82±1.37 | 0.49±1.17 | 0.38±1.14 | 0.08±0.42 | 1.13±0.54 | 0.26±0.27 |
| t值 | 0.399 | 0.358 | 0.116 | 0.212 | 0.096 | 0.812 |
| P值 | 0.000 | 0.154 | 0.121 | 0.494 | 0.644 | 0.000 |
在轻度及中度CTS患者中,注射组△CSA1、△R-CSA较口服组增加明显,差异有统计学意义(P < 0.05)。重度和极重度患者,两组各参数均无差异(P > 0.05)。见表 7、表 8、表 9、表 10。
| 组别 | △CSA1 | △CSA2 | △CSA3 | △CSA4 | △D | △R-CSA |
| 口服组 | 0.55±0.58 | -0.25±0.50 | 0.25±0.50 | 0.00±0.00 | 0.85±0.47 | 0.11±0.82 |
| 注射组 | 2.14±1.07 | 1.14±0.90 | 0.43±0.79 | 0.43±0.53 | 0.73±0.24 | 0.81±0.24 |
| t值 | -2.805 | -2.815 | -0.405 | -2.121 | 0.580 | -4.303 |
| P值 | 0.021 | 0.020 | 0.695 | 0.078 | 0.576 | 0.000 |
| 组别 | △CSA1 | △CSA2 | △CSA3 | △CSA4 | △D | △R-CSA |
| 口服组 | 0.45±1.30 | 0.23±0.69 | 0.23±0.61 | 0.32±0.48 | 0.88±0.65 | -0.03±0.23 |
| 注射组 | 2.50±1.32 | 0.38±0.96 | 0.44±1.21 | 0.63±0.44 | 1.06±0.61 | 0.39±0.33 |
| t值 | -4.765 | -0.555 | -0.703 | 1.702 | -0.873 | -4.543 |
| P值 | 0.000 | 0.582 | 0.486 | 0.098 | 0.388 | 0.000 |
| 组别 | △CSA1 | △CSA2 | △CSA3 | △CSA4 | △D | △R-CSA |
| 口服组 | -0.50±2.27 | -0.40±1.65 | -0.70±1.16 | -0.20±0.42 | 1.30±0.66 | 0.00±0.39 |
| 注射组 | 0.80±1.23 | 0.10±1.60 | 0.40±1.58 | -0.10±0.32 | 1.29±0.33 | 0.14±0.18 |
| t值 | 0.126 | 0.868 | 0.502 | 0.232 | 0.024 | 0.064 |
| P值 | 0.129 | 0.499 | 0.093 | 0.556 | 0.966 | 0.315 |
| 组别 | △CSA1 | △CSA2 | △CSA3 | △CSA4 | △D | △R-CSA |
| 口服组 | 1.20±2.77 | 1.00±1.22 | 0.40±1.14 | 0.20±0.45 | 1.56±0.93 | 0.11±0.36 |
| 注射组 | 1.33±1.03 | 0.67±1.03 | 0.17±0.41 | 0.00±0.00 | 1.50±0.61 | 0.19±0.17 |
| t值 | 0.050 | 0.816 | 0.048 | 0.016 | 0.188 | 0.160 |
| P值 | 0.923 | 0.635 | 0.682 | 0.374 | 0.901 | 0.668 |
CTS早期治疗可减少患者的患病率和致残率,轻度至中度的患者建议保守治疗,而严重的患者建议手术治疗[16]。全身或局部使用类固醇是常用的CTS的治疗方法,在于改善屈肌肌腱滑膜腱鞘炎[7]。有研究显示类固醇较安慰剂可以明显改善轻度至中度CTS患者近期症状,而远期症状则无明显改善,而类固醇的剂量及治疗的持续时间并不是治疗的关键因素[17]。超声引导下局部注射更加安全、准确,可减少手腕周围神经血管的损伤[18]。本研究采用Ulnar-I法,提高了治疗的安全性和效率[19, 20],证实超声评估CTS患者疗效有临床意义,并且轻、中度患者腕管局部注射类固醇,其短期疗效优于口服类固醇。
随着超声技术的进步,特别是高频探头的应用,超声检查的分辨率可精确到1 mm,可用于CTS的诊断。高频超声能够观察所检神经的神经束,神经外膜、束膜和神经周围的结构[21]。CTS最常见的超声表现为神经CSA增加、血流信号增强、神经内部回声被干扰和神经束的移动性降低[22]。CTS超声诊断最重要和最常用的参数是正中神经CSA,而R-CSA应用进一步提高诊断效用[23]。研究显示正中神经CSA1增粗>0.10 cm2[24],R-CSA>1.4[25]提示CTS诊断。研究发现在超声诊断CTS时,CSA1联合R-CSA应用要优于单独测量CSA1[6]。本研究发现在观察两组CTS患者疗效时联合△CSA1和△R-CSA同样可以提高评估效率。
总体症状评分(GSS)、症状严重程度(SSS) 和功能状态(FSS) 具有可重复性、有效性、内在一致性和对临床变化的敏感性。临床问卷调查尽管带有一定的主观成分,但以病人为中心,可半定量,结果仍具有相对可靠性[8],在CTS研究中被广泛应用。
综上所述,口服及腕管局部注射类固醇治疗在短期内对缓解CTS症状有效,临床评分和神经超声各参数治疗后均有所减少。轻度和中度CTS患者腕管局部注射较口服类固醇治疗效果更佳;重度和极重度患者两种治疗效果无明显差别,且治疗效果差,应进行手术治疗。超声检查是非侵入性的,减少患者痛苦,提高依从度,但不能提供神经功能信息;电生理检查可提供功能信息,但不能观察神经结构,结合临床、电生理和超声可更好地诊疗疾病,超声检查应在今后CTS诊疗中广泛应用。本研究的主要局限性在于病例数较少,随访时间相对较短,远期疗效未评估;未进行双盲对照试验设计,从而获得更好的剂量-效应关系,在今后的研究中我们将进一步关注。
| [1] | Kleopa KA. In the Clinic. Carpal Tunnel Syndrome. Ann Intern Med, 2015, 163(5): 1–15. DOI:10.7326/AITC201509010 |
| [2] | Thatte MR, Mansukhani KA. Compressive neuropathy in the upper limb. Indian J Plast Surg, 2011, 44(2): 283–297. DOI:10.4103/0970-0358.85350 |
| [3] | Chammas M, Boretto J, Burmann LM, et al. Carpal tunnel syndrome-Part Ⅰ (anatomy, physiology, etiology and diagnosis). Rev Bras Ortop, 2014, 49(5): 429–436. DOI:10.1016/j.rbo.2013.08.007 |
| [4] | 纪芳, 卢祖能. 高频超声在诊断腕管综合征中的应用. 中华超声影像学杂志, 2006, 15(8): 627–628. |
| [5] | LeBlanc KE, Cestia W. Carpal tunnel syndrome. Am Fam Physician, 2011, 83(8): 952–958. |
| [6] | Tai TW, Wu CY, Su FC, et al. Ultrasonography for diagnosing carpal tunnel syndrome:a meta-analysis of diagnostic test accuracy. Ultrasound Med Biol, 2012, 38(7): 1121–1128. DOI:10.1016/j.ultrasmedbio.2012.02.026 |
| [7] | Paola de Pablo, Katz JN. Pharmacotherapy of carpal tunnel syndrome. Expert Opin Pharmacother, 2003, 4(6): 903–909. DOI:10.1517/14656566.4.6.903 |
| [8] | 翁超, 初红, 彭彬, 等. 腕管综合征夜间夹板治疗的临床和电生理评估. 中华神经医学杂志, 2010, 9(11): 1132–1136. |
| [9] | Chammas M, Boretto J, Burmann LM, et al. Carpal tunnel syndrome-Part Ⅱ (treatment). Rev Bras Ortop, 2014, 49(5): 437–445. DOI:10.1016/j.rbo.2013.08.008 |
| [10] | 翁超, 彭彬, 戴敏, 等. 腕管综合征类固醇腕管局部注射的临床和电生理评估. 癫癎与神经电生理学杂志, 2010, 19(6): 337–341. |
| [11] | 王丽萍, 初红, 卢祖能. 足下垂的原因分析及其肌电图鉴别诊断价值. 国际神经病学神经外科学杂志, 2015, 42(6): 496–500. |
| [12] | 纪芳, 卢祖能, 刘小明, 等. 腕管综合征的电生理与超声定量检测. 中华神经科杂志, 2006, 39(3): 167–171. |
| [13] | LeBlanc KE, Cestia W. Carpal tunnel syndrome. Am Fam Physician, 2011, 83(8): 952–958. |
| [14] | Herskovitz S, Berger AR, Lipton RB. Low-dose, short-term oral prednisone in the treatment of carpal tunnel syndrome. Neurology, 1995, 45(10): 1923–1925. DOI:10.1212/WNL.45.10.1923 |
| [15] | Jiménez Del Barrio S, Bueno Gracia E, Hidalgo García C, et al. Conservative treatment in patients with mild to moderate carpal tunnel syndrome:A systematic review. Neurologia, 2016, S0213-4853(16): 30094–90099. |
| [16] | Levine DW, Simmons BP, Koris MJ, et al. A self-administered questionnaire for the assessment of severity of symptoms and functional status in carpal tunnel syndrome. J Bone Joint Surg Am, 1993, 75(11): 1585–1592. DOI:10.2106/00004623-199311000-00002 |
| [17] | Flondell M, Hofer M, Björk J, et al. Local steroid injection for moderately severe idiopathic carpal tunnel syndrome:protocol of a randomized double-blind placebo-controlled trial. BMC Musculoskelet Disord, 2010, 11: 1–7. DOI:10.1186/1471-2474-11-1 |
| [18] | Kim DH, Jang JE, Park BK. Anatomical Basis of Ulnar Approach in Carpal Tunnel Injection. Pain Physician, 2013, 16(3): E191–E198. |
| [19] | Chen PC, Chuang CH, Tu YK, et al. A Bayesian network meta-analysis:Comparing the clinical effectiveness of local corticosteroid injections using different treatment strategies for carpal tunnel syndrome. BMC Musculoskelet Disord, 2015, 16: 1–16. DOI:10.1186/s12891-015-0454-0 |
| [20] | Lee JY, Park Y, Park KD, et al. Effectiveness of ultrasound-guided carpal tunnel injection using in-plane ulnar approach:a prospective, randomized, single-blinded study. Medicine, 2014, 93(29): e350–e356. DOI:10.1097/MD.0000000000000350 |
| [21] | Padua L, Coraci D, Erra C, et al. Carpal tunnel syndrome:clinical features, diagnosis, and management. Lancet Neurol, 2016, 15(12): 1273–1284. DOI:10.1016/S1474-4422(16)30231-9 |
| [22] | A Kerasnoudis A, G Tsivgoulis G. Nerve Ultrasound in Peripheral Neuropathies:A Review. J Neuroimaging, 2015, 25: 528–538. DOI:10.1111/jon.2015.25.issue-4 |
| [23] | Klauser AS, Abd Ellah MM, Halpern EJ, et al. Sonographic cross-sectional area measurement in carpal tunnel syndrome patients:can delta and ratio calculations predict severity compared to nerve conduction studies?. Eur Radiol, 2015, 25(8): 2419–2427. DOI:10.1007/s00330-015-3649-8 |
| [24] | Karadaǒ YS, Karadaǒ O, Ciçekli E, et al. Severity of Carpal tunnel syndrome assessed with high frequency ultrasonography. Rheumatol Int, 2010, 30(6): 761–765. DOI:10.1007/s00296-009-1061-x |
| [25] | Kele H, Verheggen R, Bittermann HJ, et al. The potential value of ultrasonography in the evaluation of carpal tunnel syndrome. Neurology, 2003, 61(3): 389–391. DOI:10.1212/01.WNL.0000073101.04845.22 |
 2016, Vol. 43
2016, Vol. 43




