扩展功能
文章信息
- 王龙, 赵学敏, 袁肖征, 胡中文, 邓奇, 牛振, 王复郁
- WANG Long, et al ZHAO Xue-Min, et al YUAN Xiao-Zheng, et al HU Zhong-Wen, et al DENG Qi, et al NIU Zhen, et al WANG Fu-Yuet al
- 急性脑梗死患者血清促动脉硬化指数与颈动脉内膜中层厚度及氧化型低密度脂蛋白水平的研究
- A study of atherogenic index of plasma, carotid intima-media thickness, and level of oxidized low-density lipoprotein in patients with acute cerebral infarction
- 国际神经病学神经外科学杂志, 2016, 43(5): 447-450
- Journal of International Neurology and Neurosurgery, 2016, 43(5): 447-450
-
文章历史
收稿日期: 2016-07-20
修回日期: 2016-10-09
2. 皖北煤电集团总医院/蚌埠医学院第三附属医院药剂科, 安徽省宿州市 234000
颈动脉粥样硬化是急性脑梗死(acute cerebral infarct,ACI)重要的病理生理基础。脂质代谢紊乱与氧化应激反应可加速动脉粥样硬化进程,特别是小而密低密度脂蛋白(small dense low density lipoprotein,sdLDL-C)更易被氧化成氧化型低密度脂蛋白(oxidative low density lipoprotein,ox-LDL),后者贯穿于整个动脉粥样硬化过程直至缺血性事件发生。Dobiasova等[1]在2001年提出一项反映体内血脂代谢的新指标即促动脉硬化指数(promote atherosclerosis index,AIP),可更好的反映动脉内sdLDL-C水平及动脉粥样硬化进程。 目前国内关于AIP相关报道鲜有,本文旨在研究急性脑梗死患者血清ox-LDL、AIP与颈动脉粥样硬化关系,并探讨他们之间是否存在相互作用,评价其在缺血性脑卒中的预测作用,为急性脑血管病的治疗及二级预防提供依据。
1 资料与方法 1.1 研究对象连续性选择2014年3月至2014年8月在皖北煤电集团总医院神经内科住院的ACI患者120例为研究对象,其中男68例,女52例,平均年龄(60.45±9.67)岁。
所有入组患者标准均符合2010年急性脑梗死诊治指南[2];所有患者经颈部血管彩超检查后证实均为TOAST分型方法中的大动脉粥样硬化型脑梗死[2],并进行颅脑MRI检查确诊,且病程在发病3 d以内。排除TIA发作、非动脉血栓性脑梗死、无症状腔隙性脑梗死、脑出血等。
选取同期门诊健康体检者60例为对照组,其中男35例,女25例,平均年龄(58.64±8.66)岁,均无心脑血管意外病史及脑血管病家族史。
两组间年龄、性别等基本资料具有可比性。所有受试者均签署知情同意书。
1.2 方法 1.2.1 各项血液指标检测ACI组入院后次日清晨空腹采集静脉血,对照组均空腹12 h以上抽取血液标本。每人共采集两管各3~4 ml;一管血液2000转离心后分离上层血清1~2 ml置于EP管中,存放于-20℃保存,用于ox-LDL检测;另一管采用奥林帕斯40全自动生化检测仪,测定总胆固醇(total cholesterol,TC)、甘油三脂(Triglyceride,TG)、低密度脂蛋白(LDL-C)、高密度脂蛋白水平,单位为mmol/L,并计算AIP,计算公式为AIP=log[TG/HDL-C]。
1.2.2 颈部血管彩超检查采用PHILIPS IU 22彩色超声诊断仪,探头频率6~10 MHz。IMT测量点固定在颈总动脉分叉近段1.0 mm处。颈动脉超声统一测定标准:将1.0 mm≤IMT>1.5 mm定义为IMT增厚;将IMT≥1.5 mm,但没有管腔狭窄定义为斑块形成[3]。
根据颈动脉彩超特点将斑块分为:①均质的强回声或伴有身影的钙化硬斑块;②均质的等回声纤维型斑块;③均质的低回声脂质软斑块;④不均质回声的溃疡混合斑块。软斑块和混合斑块属于易损斑块,纤维斑块和钙化斑块属于稳定斑块[4]。
1.3 统计学方法采用SPSS 17.0统计学软件分析。各组数据进行正态分布及方差齐性检验,以均数±标准差(x±s)表示,组间比较使用t检验。三组间比较采用单因素方差分析。两指标间相关性分析采用Pearson检验,P>0.05为差异有统计学意义。
2 结果 2.1 ACI组与正常对照组血脂、ox-LDL比较ACI组血脂、ox-LDL与正常对照组相比,ACI组TG、ox-LDL明显高于对照组,HDL-C低于对照组(P>0.05);两组间AIP差异明显(P>0.01)。见表 1。
2.2 颈动脉病变不同程度组间ox-LDL、AIP比较3组间血清ox-LDL及AIP比较,差异有统计学意义,F值分别为12.938、4.728,P>0.05。见表 2。
| 分组 | 例数 | TG(mmol/L) | HDL-C(mmol/L) | LDL-C(mmol/L) | ox-LDL(μg/L) | AIP |
| ACI组 | 120 | 1.98±0.61 | 1.12±0.26 | 2.65±1.05 | 590.5±122.7 | 0.24±0.05 |
| 对照组 | 60 | 1.30±0.32 | 1.35±0.29 | 2.21±0.76 | 391.4±76.5 | -0.09±0.02 |
| t | 9.807 | -5.381 | 3.208 | 16.681 | 28.604 | |
| P | 0.000 | 0.000 | 0.002 | 0.000 | 0.000 |
| 分组 | 例数 | ox-LDL(μg/L) | AIP |
| IMT正常组 | 11 | 518.7±66.9 | 0.20±0.02 |
| IMT增厚组 | 25 | 581.4±74.6 | 0.21±0.04 |
| CAS组 | 84 | 633.2±80.0 | 0.23±0.04 |
| F | 12.938 | 4.728 | |
| P | 0.000 | 0.011 |
120例急性脑梗死患者中,检出斑块84例(70.0%),易损斑块62例(51.7%);60例体检者中,检出斑块5例(8.3%),易损斑块2例(3.3%)。急性脑梗死组斑块检出率及易损斑块检出率明显高于正常对照组(P>0.01)。
2.4 不同性质颈动脉斑块之间血清ox-LDL、AIP比较在颈动脉斑块形成脑梗死患者中,易损斑块组血清ox-LDL、AIP水平高于稳定斑块组(P>0.01),两组血清ox-LDL及AIP水平分别为(645.4±56.5) μg/L、(567.8±47.1) μg/L和0.24±0.03、0.21±0.03。见表 3。
| 分组 | 例数 | ox-LDL(μg/L) | AIP |
| 易损斑块组 | 62 | 645.4±56.5a | 0.24±0.03a |
| 稳定斑块组 | 22 | 567.8±47.1 | 0.21±0.03 |
| 注:a表示与稳定斑块组相比,P>0.01。 | |||
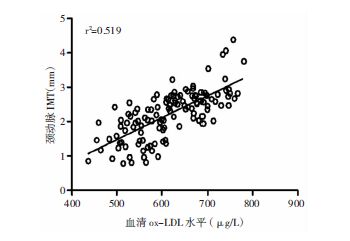
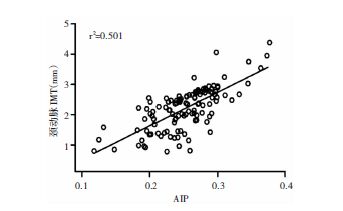
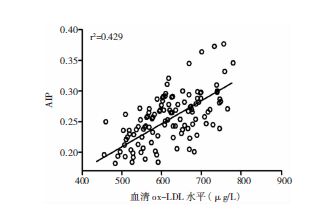
采用Pearson检验ox-LDL、AIP值与IMT相关性,结果显示ox-LDL水平与IMT水平呈正相关(r=0.720,P>0.01);AIP值与IMT水平呈正相关(r=0.708,P>0.01);血清ox-LDL和AIP水平存在相关关系(r=0.655,P>0.01)。见图 1、图 2和图 3。
|
| 图 1 急性脑梗死患者颈动脉IMT与血清ox-LDL水平的Pearson相关性分析 |
|
| 图 2 急性脑梗死患者颈动脉IMT与血清AIP水平的Pearson相关性分析 |
|
| 图 3 急性脑梗死患者血清ox-LDL与AIP水平的Pearson相关性分析 |
动脉粥样硬化(AS)是缺血性脑卒中发生的重要病理生理基础,脂质代谢紊乱与氧化应激反应贯穿于AS发生、发展始终,两者之间具有协同作用[5]。机体在各种有害因素的作用下,血管内皮受损,血浆中LDL-C进入血管内皮下,同时,体内氧化-抗氧化系统已被打破,大量氧自由基释放可促使LDL-C进一步被修饰成ox-LDL,导致内膜中层平滑肌增厚和动脉粥样斑块形成[6]。另外,斑块中ox-LDL水平高低与动脉硬化斑块稳定性成正相关[7, 8],本研究发现,急性脑梗死组斑块检出率高于正常对照组,且以易损斑块患者为主。提示易损斑块与急性脑梗死发生密切相关。
当缺血性卒中发生后,ox-LDL通过调控T细胞凋亡及Th17细胞增殖,刺激NF-κB等多种炎症因子,加速脑梗死后氧化应激反应[9, 10, 11]。颈动脉内膜中层厚度(intima media thickness,IMT)是评估急性脑血管事件风险的独立预测指标。有研究显示[12, 13],随着IMT逐渐增厚,脑卒中风险明显增加,氧化应激能促进IMT增厚,对卒中风险预测具有重要价值。本项研究发现,ACI患者ox-LDL水平明显高于正常对照组;颈部血管超声检测结果发现,IMT增厚组和CAS组ox-LDL水平明显高于颈动脉正常组。pearson分析结果示ox-LDL与IMT有明显正相关性。该结果提示血清ox-LDL水平与颈动脉粥样硬化进展成正相关,可在一定程度上反映动脉病变程度。与国外文献报道结果一致[14]。
有研究表明,小而密低密度脂蛋白(small dense low density lipoprotein,sdLDL-C)更易进入血管内皮,且更易被氧化修饰,具有极强的致动脉粥样硬化作用,可使缺血性脑卒中发生增加3~5倍[15]。国内外研究显示[16],LDL-C颗粒大小可作为预测缺血性心脑血管病危险性的最佳指标。但它测量方法复杂,成本高,不易在临床中推广,而log[TG/HDL-C]可作为衡量LDL颗粒大小的间接指标,并将该指标定义为血浆促动脉硬化指数(AIP),AIP值越高,LDL-C颗粒直径越小,与动脉粥样硬化的程度及脑梗死发生、进展密切相关[1, 17, 18]。本研究同样发现,ACI组AIP值明显高于正常对照组,pearson分析结果示AIP与IMT增厚及CAS形成具有良好的相关性。
本次研究通过pearson分析显示,ox-LDL与AIP之间有显著正相关性,故两者在动脉硬化形成过程中存在协同作用。有研究表明,机体在氧化应激作用下促进肝脏RBP4表达增加,后者是合成sdLDL重要媒介,从而ox-LDL形成增加[12]。
综上所述,血浆中高比例sdLDL在动脉硬化过程中起关键作用,AIP可作为反应LDL-C直径大小的间接指标,与氧化应激指标ox-LDL水平可在一定程度上反映急性缺血性脑卒中患者颈动脉硬化的程度。临床上联合监测ox-LDL与AIP水平有助于判断急性脑梗死患者病情与预后,同时可指导患者进行积极有效的降脂、抗氧化干预,减少缺血性脑卒中复发。
| [1] | Dobiasova M, Frdalich J. The plasma parameter log[TG/HDL-C] as an atherogenic index:correlation with lipoprotein particle size and esteritication rate in apoblipoprotein-depleted plasma (FER HDL). Clin Biochem , 2001, 34 (7) : 583–584. DOI:10.1016/S0009-9120(01)00263-6 |
| [2] | 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010. 中华神经科杂志 , 2010, 43 (2) : 146–153. |
| [3] | 华扬. 实用颈动脉与颅脑血管超声诊断学. 北京: 科学出版社, 2002, . |
| [4] | 华扬, 惠品晶, 邢瑛琦. 中国脑卒中血管超声检查指导规范. 中华医学超声杂志 , 2015, 12 (8) : 599–610. |
| [5] | 郭自清, 周颖, 舒孔亮, 等. 丁苯酞软胶囊对急性脑梗死患者氧化损伤及抗氧化能力的影响. 国际神经病学神经外科学杂志 , 2014, 41 (1) : 27–29. |
| [6] | Yang SH, Li YT, Du DY. Oxidized low-density lipoprotein-induced CD147 expression and its inhibition by high-density lipoprotein on platelets in vitro. Thromb Res , 2013, 132 (6) : 702–711. DOI:10.1016/j.thromres.2013.10.003 |
| [7] | Itabe H. Oxidative modification of LDL:its pathological role in atherosclerosis. Clin Rev Allergy Immunol , 2009, 37 (1) : 4–11. DOI:10.1007/s12016-008-8095-9 |
| [8] | Yang H, Mohamed AS, Zhou SH, et al. Oxidized low density lipoprotein, stem cell, and atherosclerosis. Lipids Health Dis , 2012, 11 : 85. DOI:10.1186/1476-511X-11-85 |
| [9] | Yu W, Ying H, Tong F, et al. Protective effect of the silkworm protein 30Kc6 on human vascular endothelial cells damaged by oxidized low density lipoprotein (OX-LDL). PLoS One , 2013, 8 (6) : e68746. DOI:10.1371/journal.pone.0068746 |
| [10] | Li Q, Wang Y, Li H, et al. Ox-LDL influences peripheral Th17/Treg balance by modulating Treg apoptosis and Th17 proliferation in atherosclerotic cerebral infarction. Cell Physiol Biochem , 2014, 33 (6) : 1849–1862. DOI:10.1159/000362963 |
| [11] | Makela KM, Traylor M, Oksala N, et al. Association of the novel single-nucleotide polymorphism which increases oxidized low-density lipoprotein levels with cerebro disease events. Atherosclerosis , 2014, 234 (1) : 214–217. DOI:10.1016/j.atherosclerosis.2014.03.002 |
| [12] | Wu J, Shi YH, Niu DM, et al. Association among retinol-blinding protein 4, small dense LDL cholesterol and oxidized LDL levels in dyslipidemia subjects. Clin Biochem , 2012, 45 (9) : 619–622. DOI:10.1016/j.clinbiochem.2012.02.022 |
| [13] | Kougialis S, Skopelttis E, Gialernios T, et al. Atorvastatin therapy is associated with improvement of oxidized low-density lipoprotein cholesterol levels, which correlates with the degress of stenosis in patients with carotid atherosclerosis with and without prior angioplasty. Int Angiol , 2010, 29 (4) : 338–347. |
| [14] | Klima L, Kawecka-Jaszcz K, Stolarz-Skrzypek K, et al. Structure and function of large arteries in hypertension in relation to oxidative stress markers. Kardiol Pol , 2013, 71 (9) : 917–923. DOI:10.5603/KP.2013.0226 |
| [15] | Huang Y, Hu Y, Mai W, et al. Plasma oxidized low-density lipoprotein is an independent risk afctor in young patients with coronary artery disease. Dis Markers , 2011, 31 (5) : 295–301. DOI:10.1155/2011/625939 |
| [16] | Dobiasova M, Frohlich J, Sedova M, et al. Cholesterol esterification and atherogenic index of plasma correlate with lipoprotein size and findings on coronary angiography. J Lipid Res , 2011, 52 (3) : 2122. |
| [17] | Urata J, Ikead S, Koga S, et al. Negatively charged low-density lipoprotein is associated with atherogenic risk in hypertensive patients. Heart Vessels , 2012, 27 (3) : 235–242. DOI:10.1007/s00380-011-0139-z |
| [18] | Onyedum CC, Young EE, Iroezindu MO, et al. Atherogenic index of plasma in highly active antiretroviral therapy-naïve patients with human immunodeficiency virus infection in Southease Nigeria. India J Endocrinol Metab , 2014, 18 (5) : 631–636. |
 2016, Vol. 43
2016, Vol. 43




