扩展功能
文章信息
- 胡忠波, 吴淑华, 张卫国, 郭科, 李建民
- HU Zhong-Bo, et al WU Shu-Hua, et al ZHANG Wei-Guo, et al GUO Ke, et al LI Jian-Minet al
- 干预癫痫大鼠自噬活性对小胶质细胞激活状态及肿瘤坏死因子-α分泌的影响及意义
- Effects of autophagy inhibition on microglia activation state and secretion of tumor necrosis factor-α in rats with epilepsy and their significance
- 国际神经病学神经外科学杂志, 2016, 43(5): 441-446
- Journal of International Neurology and Neurosurgery, 2016, 43(5): 441-446
-
文章历史
收稿日期: 2016-07-14
修回日期: 2016-10-11
2. 滨州医学院, 山东省滨州市 256603
癫痫(epilepsy)是一种慢性的、反复发作的神经元异常放电所致的暂时性中枢神经系统功能失常性疾病。我国癫痫发病率在5‰[1],其中40%为难治性癫痫[2]。癫痫的病因复杂,发病机制迄今未完全阐明。已有研究显示,癫痫发病过程中神经元的异常放电与免疫炎症密切相关[3, 4]。而新近研究表明,癫痫可激活脑内神经细胞自噬[5],而自噬可影响免疫细胞的活性,导致细胞因子释放的改变[6, 7]。小胶质细胞是中枢神经系统的巨噬细胞,是脑内炎症分子产生的主要来源。本研究采用戊四氮点燃大鼠癫痫模型,应用3-甲基嘌呤(3-methyladenine,3-MA)和雷帕霉素(rapamycin,RAPA)干预后观察各组海马区自噬及小胶质细胞的激活情况,研究癫痫状态下干预自噬对小胶质细胞活性、肿瘤坏死因子-α(tumor necrosis factor -α,TNF-α)释放以及癫痫状态的影响并分析其意义,为癫痫治疗提供新思路。
1 材料和方法 1.1 材料Wistar雄性成年大鼠30只,购自山东鲁抗制药有限公司实验动物中心,体重约160~180 g,饲养于恒温(20±2)℃、恒湿(50%~60%)、无特殊病原体条件下,饮用水和标准饲料均经灭菌后供其自由食用。戊四氮(pentylenetetrazole,PTZ)、3-MA和RAPA均购自美国Sigma公司。
1.2 方法 1.2.1 大鼠癫痫模型制作、分组及药物干预利用随机数字表法将大鼠分为正常对照组(6只)和癫痫组(24只)。癫痫组腹腔注射0.5% PTZ,40 mg/kg,每日一次,持续2周,直至造模成功;正常对照组每日注射40 mg/kg生理盐水。连续观察动物给药后2 h内的行为表现。痫性发作根据Racine评分标准[8]分为6级,即0级:无发作反应;Ⅰ级:口角和面部抽动;Ⅱ级:身体轴向抽搐;Ⅲ级:肌阵挛性抽搐和摆尾;Ⅳ级:阵挛性抽搐并跌倒;V级:反复发作的强直阵挛或致命性抽搐。凡至少连续3次Ⅲ级以上发作者被认为造模成功[9]。随后将造模成功者随机分为致痫对照组、3-MA组、RAPA组,每组各6只,每日8时此三组分别腹腔注射等剂量生理盐水、3-MA 2.5 mg/kg、RAPA 6 mg/kg。半小时后腹腔注射PTZ 20 mg/kg。正常对照组注射等剂量生理盐水。药物连续干预7 d。
1.2.2 行为学观察及脑电图检测观察记录各组大鼠给药后1 h内癫痫发作最高等级。观察完成后1 h内,浅麻醉大鼠并固定于脑立体定位仪上记录额叶皮质脑电图。采用皮下针形电极,植入点以顶部为中心,前囟前2.0 mm、矢状线两侧旁开2.0 mm,皮针缝合固定电极,以耳为参考电极[10]。滤波设置为2 Hz,灵敏度为500 μV,时间常数为0.2,纸速为1.25 mm/s。
1.2.3 组织取材及处理药物干预后4 h,各组大鼠采用10%水合氯醛(0.4 ml/100g)腹腔注射麻醉,待大鼠眨眼反射消失时,断头取脑,冰盘内将脑组织沿矢状缝对切成两半,取出右边脑组织海马并迅速放入-80℃冰箱中保存,用于后续蛋白提取;左侧海马区脑组织4%多聚甲醛固定,经脱水、透明、浸蜡后包埋,以备切片。
1.2.4 HE及Nissl染色大鼠脑组织连续切片,厚3 μm,行常规HE及Nissl染色,显微镜下观察海马CAl区神经元的形态及其分布,计数损伤及正常神经元,细胞形态正常、Nissl小体清晰视为正常神经元。按照分组,每只大鼠随机观察5张切片,每张切片观察5个400倍视野,计数并取其平均值。
1.2.5 免疫荧光染色大鼠脑组织连续切片,厚度4 μm,常规脱蜡、脱水、修复后血清封闭;30 min后去血清加一抗,4℃过夜;次日PBS漂洗后加入荧光二抗,室温孵育1 h;抗淬灭剂封片后在荧光显微镜下观察,拍片,统计各指标阳性细胞数。
1.2.6 Western blot检测冰上研磨海马组织,加入裂解液及蛋白酶抑制剂充分裂解细胞,离心后取上清。BCA法测定并计算蛋白浓度。所得蛋白加入5×蛋白上样缓冲液并热变性备用。各组分别取50 μg进行SDS-PAGE电泳,转膜并封闭,一抗及β-actin 4℃过夜,PBST洗去一抗后二抗孵育2 h,ECL曝光,分别分析吸光度值。
1.3 统计学处理计量资料采用均数±标准差(x±s)表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析。计数资料采用Fisher确切概率法。应用SPSS 20.0统计软件进行处理,P>0.05为差异具有统计学意义。
2 结果 2.1 戊四氮成功制作大鼠癫痫模型按照Racine分级标准,造模成功率为75%(24只大鼠中18只成功,4只死亡,2只未达到要求),造模成功后注意保暖,加强呼吸道及体液管理能有效降低死亡率。
2.2 行为学观察及脑电图检测通过对各组连续7 d的观察,模型组均出现痫样发作;致痫对照组、RAPA组均出现Ⅲ级以上痫样发作(P>0.05);3-MA组痫样发作程度较致痫对照组明显减轻(P>0.05)。见表 1。
| 组别 | 例数 | 无发作 (0级) |
轻度 (Ⅰ-Ⅱ级) |
重度 (Ⅲ-Ⅴ级) |
| 正常对照组 | 6 | 6a | - | - |
| 致痫对照组 | 6 | - | - | 6b |
| 3-MA组 | 6 | - | 3c | 3 |
| RAPA组 | 6 | - | - | 6 |
| 注: a表示正常对照组与各模型组比较,P>0.05;b表示致痫对照组与RAPA组比较,P>0.05;c表示3-MA组vs致痫对照组,P>0.05。 | ||||
正常对照组脑电图波形正常;致痫对照组及RAPA组脑电图均呈频发高幅的尖波、棘波;3-MA组脑电图呈频发低幅的小棘波、棘慢波。见图 1。
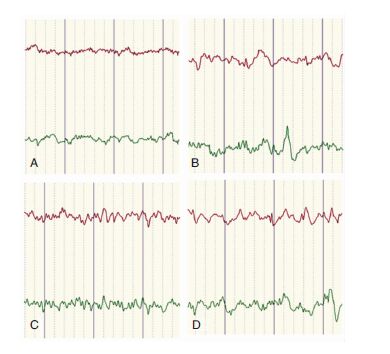
|
| 图 1 脑电图记录各组大鼠癫痫发作的强度。A:正常对照组;B:致痫对照组;C:3-MA组;D:RAPA组。 |
正常大鼠海马CA1区可见大量致密的锥体细胞,排列整齐、形态完整,尼氏小体丰富,细胞核呈圆形或椭圆形,染色质分布均匀。癫痫各组CA1区 神经细胞排列紊乱,部分细胞肿胀、结构不完整,尼氏小体减少,细胞核染色质浓缩、边集。见图 2。
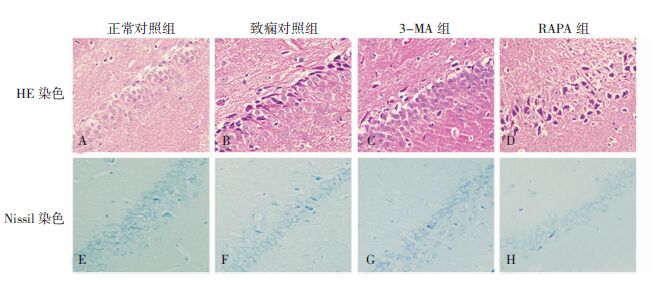
|
| 图 2 HE及Nissl染色图像(×400)示每组中CA1区神经元的损伤情况。A、E:正常对照组;B、F:致痫对照组;C、G:3-MA组;D、H:RAPA组。 |
神经元计数显示:与正常对照组相比,致痫对照组损伤神经元数明显增多(P>0.05);3-MA组较致痫对照组损伤神经元数明显减少(P>0.05);RAPA组较致痫对照组损伤神经元数进一步增多(P>0.05)。见图 3。
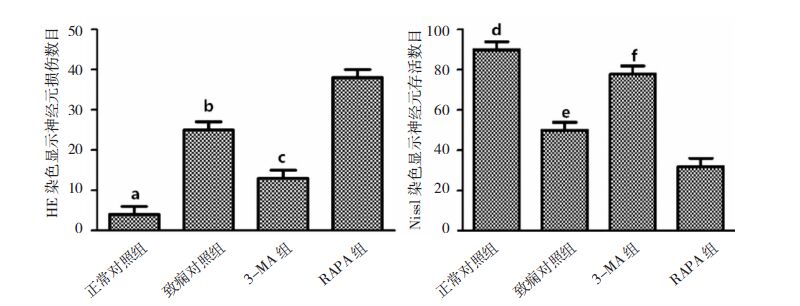
|
| 图 3 HE染色和Nissl染色分别显示的神经元损伤和存活数目。a、d:正常对照组与致痫对照组比较,P>0.05;b、e:致痫对照组与RAPA组比较,P>0.05;c、f:3-MA组与致痫对照组比较,P>0.05。 |
LC3、CD68及TNF-α免疫荧光染色结果显示,正常对照组LC3、CD68及TNF-α的表达水平较低。PTZ致痫后各模型组LC3、CD68及TNF-α的表达发生不同程度的改变,致痫对照组LC3、CD68及TNF-α的表达显著高于正常对照组(P>0.05);3-MA组LC3、CD68及TNF-α的表达显著低于致痫对照组(P>0.05);与致痫对照组相比,RAPA组LC3水平显著升高(P>0.05),CD68及TNF-α的表达无显著性差异(P>0.05)。见图 4。
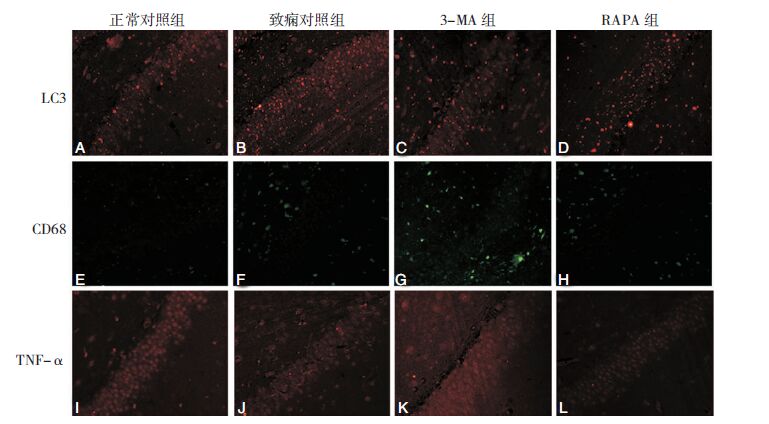
|
| 图 4 免疫荧光染色(×400)示各组CA1区LC3、CD68及TNF-α的表达情况。A-D:中带红色荧光的为LC3表达阳性细胞;E-H:带绿色荧光的为CD68表达阳性细胞;I-L:带红色荧光的为TNF-α表达阳性细胞。 |
Western blot检测各组海马区LC3、CD68及TNF-α的变化。应用Quantity One软件对各条带进行定量分析,得到其灰度值。统计分析显示,致痫对照组LC3、CD68、TNF-α的表达较正常对照组明显增加(P>0.05);3-MA组LC3、CD68、TNF-α的表达较致痫对照组明显降低(P>0.05);RAPA组较致痫对照组LC3表达显著增加(P>0.05),CD68和TNF-α的表达无显著变化(P>0.05)。见图 5。
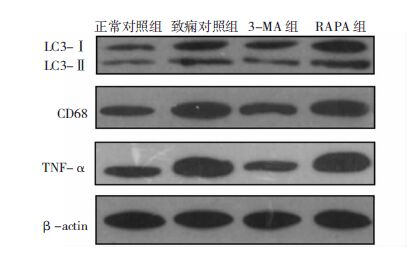
|
| 图 5 各组大鼠海马区LC3、CD68及TNF-α的变化。 |
自噬是广泛存在于真核细胞内一种溶酶体依赖性的降解途径。生理条件下,自噬处于低水平,可降解利用细胞内多余的及受损的蛋白质或细胞器[11]。当受到饥饿、低氧等细胞内外刺激时,自噬迅速被激活,通过降解胞质大分子和细胞器为细胞提供能量,对维持内环境稳定具有重要作用[12]。而过度激活的自噬可引起细胞变性,促进细胞自噬性死亡[13]。
近期研究发现在脑出血、脊髓外伤等病理条件下,神经元出现自噬现象,加速疾病进程[14, 15]。而自噬在某些疾病中发挥不同的作用,如创伤性脑损伤、蛛网膜下腔出血后,增强自噬能减轻神经元凋亡,可改善预后[16, 17]。然而自噬在癫痫中的作用目前尚未定论。本实验研究表明,PTZ诱导癫痫后自噬水平升高,同时神经元损伤数明显增多,表明癫痫可导致神经细胞自噬,并且与神经元损伤密切相关,此结果与本课题组前期研究相一致[18]。
免疫炎症参与癫痫的发病机制,该假说于1969年由Walker等[19]首先提出。研究显示中枢和外周产生的免疫炎症介质共同参与癫痫的进程[20]。过强的免疫炎症反应可降低癫痫发作阈值、增强神经兴奋性,进而引发癫痫[21]。小胶质细胞是中枢神经系统的巨噬细胞,其在活化后分泌大量炎性因子,对神经元造成伤害。CD68是小胶质细胞活化的标记物,利用CD68标记可反映小胶质细胞的活性。TNF-α是一种经典促炎因子,在正常脑组织中表达甚微,当各种中枢神经系统疾病(如脑缺血、癫痫等)发生时会快速上调,其由活化的小胶质细胞释放,可刺激星形细胞释放大量谷氨酸[22],胞外大量蓄积的谷氨酸引起谷氨酸能神经元细胞膜去极化,兴奋阈值降低,影响癫痫发生的敏感性。本实验结果显示,PTZ致痫后脑内LC3表达升高,CD68阳性细胞增多,同时TNF-α的表达伴随CD68阳性细胞增多而增加。结果提示癫痫状态下存在自噬激活,并导致小胶质细胞活化,使其分泌大量炎症因子,从而加重神经元损伤。
新近研究发现自噬能够影响巨噬细胞、小胶质细胞等免疫细胞对细胞因子的分泌。Wang等[6]在神经干细胞中研究发现,使用氯喹处理细胞,实验组细胞IL-1β的分泌减少,敲除自噬基因LC3后IL-1β的分泌显著降低。Li等[7]发现,利用棕榈酸诱导大鼠胰岛瘤细胞系自噬,并将含有自噬相关基因片段的质粒转染入细胞内,与对照组相比,其组织蛋白酶B、IL-10β等促炎因子表达均明显增加。
3-MA和雷帕霉素是目前常用的自噬干预剂,3-MA可特异性阻断Ⅲ型磷脂酰肌醇三磷酸激酶,抑制自噬体膜的形成,从而抑制自噬;雷帕霉素通过特异性结合mTOR,促进自噬发生。本实验研究表明,给予3-MA干预后,LC3、CD68及TNF-α的表达降低,同时大鼠癫痫发作等级降低,神经元存活情况较致痫对照组显著改善;而运用RAPA激活自噬后,虽然与致痫对照组相比痫样发作程度、小胶质细胞的活化程度和TNF-α的分泌无明显变化,但LC3水平升高,神经元损伤数增多。我们认为,抑制自噬可减弱小胶质细胞的活化程度,进而导致炎症因子的分泌减少,从而保护神经元,在一定程度上缓解癫痫发作;适度自噬可使小胶质细胞活性增加,发挥致炎作用,但过度激活的自噬则可导致细胞一定程度损伤,甚至自噬性细胞死亡,尽管CD68阳性小胶质细胞及TNF-α等致炎因子无明显变化,但由此而引发的神经元的自噬性死亡同样是导致痫样发作程度仍维持在较高级别的重要因素。
综上所述,癫痫过程中存在自噬现象和小胶质细胞的激活以及炎性因子TNF-α分泌增加,导致神经元损伤;而抑制自噬可调控小胶质细胞的活化,减少TNF-α的分泌,起保护神经元的作用,从而减弱癫痫发作状态。癫痫的发病机制异常复杂,癫痫状态下存在细胞、分子及其功能的多种免疫学改变,有关癫痫、自噬及免疫的关系尚有许多问题悬而未决。本实验在癫痫大鼠模型中运用自噬干预剂增强/减弱自噬,对影响小胶质细胞的活化程度及其促炎因子的分泌以及神经元损伤及癫痫发作情况进行了初步探讨,对于原发性癫痫的治疗和继发癫痫的研究和预防提供了新思路,但其分子机制还有待于进一步探讨。
| [1] | 常林, 王小珊. 中国癫痫流行病学调查研究进展. 国际神经病学神经外科学杂志 , 2013, 39 (2) : 161–164. |
| [2] | 史克珊. 重视和规范继发性癫痫的治疗. 中华神经外科杂志 , 2006, 22 (5) : 322–323. |
| [3] | Vezzani A, French J, Bartfai T, et al. The role of inflammation in epilepsy. Nat Rev Neurol , 2011, 7 (1) : 31–40. DOI:10.1038/nrneurol.2010.178 |
| [4] | Xu D, Miller SD, Koh S. Immune mechanisms in epileptogenesis. Front Cell Neurosci , 2013, 7 : 195. |
| [5] | Benz AP, Niquet J, Wasterlain CG, et al. Status epilepticus in the immature rodent brain alters the dynamics of autophagy. Curr Neurovasc Res , 2014, 11 (2) : 125–135. DOI:10.2174/1567202611666140305215009 |
| [6] | Wang LJ, Huang HY, Huang MP, et al. The microtubule-associated protein EB1 links AIM2 inflammasomes with autophagy-dependent secretion. J Biol Chem , 2014, 289 (42) : 29322–29333. DOI:10.1074/jbc.M114.559153 |
| [7] | Li S, Du L, Zhang L, et al. Cathepsin B contributes to autophagy-related 7(Atg7)-induced nod-like receptor 3(NLRP3)-dependent proinflammatory response and aggravates lipotoxicity in rat insulinoma cell line. J Biol Chem , 2013, 288 (42) : 30094–31004. DOI:10.1074/jbc.M113.494286 |
| [8] | Zhao RR, Xu XC, Xu F, et al. Metformin protects against seizures, learning and memory impairments and oxidative damage induced by pentylenetetrazole-induced kindling in mice. Biochem Biophys Res Commun , 2014, 448 (4) : 414–417. DOI:10.1016/j.bbrc.2014.04.130 |
| [9] | Chindo BA, Schroder H, Becker A. Methanol extract of Ficus platyphylla ameliorates seizure severity, cognitive deficit and neuronal cell loss in pentylenetetrazole-kindled mice. Phytomedicine , 2015, 22 (1) : 86–93. DOI:10.1016/j.phymed.2014.10.005 |
| [10] | Tejada S, Gonzalez JJ, Rial RV, et al. Electroencephalogram functional connectivity between rat hippocampus and cortex after pilocarpine treatment. Neuroscience , 2010, 165 (2) : 621–631. DOI:10.1016/j.neuroscience.2009.10.031 |
| [11] | Menzies FM, Fleming A, Rubinsztein DC. Compromised autophagy and neurodegenerative diseases. Nat Rev Neurosci , 2015, 16 (6) : 345–357. DOI:10.1038/nrn3961 |
| [12] | Kaur J, Debnath J. Autophagy at the crossroads of catabolism and anabolism. Nat Rev Mol Cell Biol , 2015, 16 (8) : 461–472. DOI:10.1038/nrm4024 |
| [13] | Lalaoui N, Lindqvist LM, Sandow JJ, et al. The molecular relationships between apoptosis, autophagy and necroptosis. Semin Cell Dev Biol , 2015, 39 : 63–69. DOI:10.1016/j.semcdb.2015.02.003 |
| [14] | He Y, Wan S, Hua Y, et al. Autophagy after experimental intracerebral hemorrhage. J Cereb Blood Flow Metab , 2008, 28 (5) : 897–905. DOI:10.1038/sj.jcbfm.9600578 |
| [15] | Chen HC, Fong TH, Lee AW, et al. Autophagy is activated in injured neurons and inhibited by methylprednisolone after experimental spinal cord injury. Spine (Phila Pa 1976) , 2012, 37 (6) : 470–475. DOI:10.1097/BRS.0b013e318221e859 |
| [16] | Erlich S, Alexandrovich A, Shohami E, et al. Rapamycin is a neuroprotective treatment for traumatic brain injury. Neurobiol Dis , 2007, 26 (1) : 86–93. DOI:10.1016/j.nbd.2006.12.003 |
| [17] | Wang Z, Shi X Y, Yin J, et al. Role of autophagy in early brain injury after experimental subarachnoid hemorrhage. J Mol Neurosci , 2012, 46 (1) : 192–202. DOI:10.1007/s12031-011-9575-6 |
| [18] | 郭翀, 吴淑华, 朱玉红, 等. 氯喹对癫痫大鼠海马区神经元自噬的影响. 神经解剖学杂志 , 2014, 30 (2) : 192–196. |
| [19] | Walker AI, Stevenson DE, Robinson J, et al. The toxicology and pharmacodynamics of dieldrin (HEOD):two-year oral exposures of rats and dog. Toxicol Appl Pharmacol , 1969, 15 (2) : 345–373. DOI:10.1016/0041-008X(69)90034-9 |
| [20] | Vezzani A, French J, Bartfai T, et al. The role of inflammation in epilepsy. Nat Rev Neurol , 2011, 7 (1) : 31–40. DOI:10.1038/nrneurol.2010.178 |
| [21] | Xu D, Miller SD, Koh S. Immune mechanisms in epileptogenesis. Front Cell Neurosci , 2013, 7 : 195. |
| [22] | Riazi K, Galic MA, Kuzmiski JB, et al. Microglia activation and TNF alpha production mediate altered CNS excitability following peripheral inflammation. Proc Natl Acad Sci U S A , 2008, 105 (44) : 17151–17156. DOI:10.1073/pnas.0806682105 |
 2016, Vol. 43
2016, Vol. 43




