扩展功能
文章信息
- 孙丽丽, 唐文雄, 刘蕾, 刘尊敬
- SUN Li-Li, et al TANG Wen-Xiong, et al LIU Lei, et al LIU Zun-Jinget al
- 以突聋为首发症状的脑梗死患者临床特点
- Clinical characteristics of cerebral infarction with a prodromal symptom of sudden sensorineural hearing loss
- 国际神经病学神经外科学杂志, 2016, 43(5): 427-431
- Journal of International Neurology and Neurosurgery, 2016, 43(5): 427-431
-
文章历史
收稿日期: 2016-07-05
修回日期: 2016-09-21
突发性耳聋(sudden deafness,SD)是神经内科及耳鼻喉科急症的常见表现,常见病因包括感染性、血管性、外伤性及自身免疫性疾病等[1],但大多数突聋病因不能明确。突聋是小脑前下动脉(anterior inferior cerebellar artery,AICA)脑梗死的主要症状之一,部分患者以突聋为首发症状,往往这类患者在病程初期可能被忽视而延误治疗。本文通过分析我院神经内科收治的2例以突聋为首发症状的脑梗死病例,并结合文献复习,总结此类病例的临床特点、影像学特征及预后情况,积累临床经验,避免治疗延误。
1 临床资料 1.1 病例1男性,48岁,主因“头晕伴听力下降10 h,四肢力弱6 h”于2014年12月就诊于我院并住院治疗,既往糖尿病史5年。患者于入院前10 h突然出现头晕,伴双耳听力下降,持续约半小时后听力好转,未就诊。6 h前骑自行车过程中突发四肢力弱,搀扶下可行走,伴大汗、呕吐,半小时后症状有所缓解,就诊于我院急诊。当时查体:血压165/100 mmHg,神志清楚,言语流利,右侧鼻唇沟略浅,右下肢肌力V-级,余神经系统查体未见明显异常。行头颅CT检查“未见明显异常”,考虑急性脑梗死,给予阿司匹林300 mg口服及改善微循环治疗。4 h后患者输液过程中症状突然再次加重,四肢力弱,右侧为重,并逐渐出现意识模糊,查体:嗜睡,重度构音障碍,双眼向右侧凝视,可见水平持续性眼震,右侧中枢性面瘫,粗测双耳听力均下降,气导>骨导,伸舌不能,右侧肢体肌力0级,左侧肢体肌力粗测III+级,双侧病理征阳性。NIHSS评分15分。经患者家属知情同意后,急诊予行全脑数字减影血管造影(digital subtract angiography,DSA)检查及动脉溶栓治疗。后收入病房进一步完善头颅MRI、高分辨磁共振成像(high-resolution MRI,HR-MRI)、颈动脉超声、经颅多普勒(transcranial Doppler,TCD)等检查。
1.2 病例2男性,56岁,主因“头晕伴听力下降、行走不稳9天”于2014年11月14日入院,既往高血压病3年、吸烟史20年。患者于入院前9 d晨起后出现头晕,伴视物旋转、呕吐,右耳耳鸣及听力下降,行走不稳向右侧偏斜,站立位时头晕明显加重,2 h后出现言语不清,症状持续不缓解。5 d前就诊于我院门诊,查体:BP150/85 mmHg,神志清楚,轻度构音障碍,双眼水平注视可见水平持续眼震,右耳听力下降,气导>骨导,右侧指鼻试验及跟膝胫运动欠稳准,右侧轮替运动差,余神经系统查体未见明显异常。收入病房进一步完善DSA、头颅MRI、HR-MRI、颈动脉超声、TCD、纯音测听等检查。
2 辅助检查、治疗及转归 2.1 病例1 2.1.1 DSA检查及动脉溶栓过程及结果常规双侧腹股沟区皮肤消毒、铺巾,在利多卡因局麻下行股动脉穿刺,成功后置入8F的动脉鞘,然后在泥鳅超滑导丝的引导下先后引入5F的PIG导管及H1导管,分别行主动脉弓、双侧椎基底动脉造影,造影提示基底动脉起始段闭塞(图 1B),周围可见侧枝循环代偿,给予rt-PA多次动脉推注后(共推注20 mg),患者症状较前明显好转,意识转清,右侧肢体肌力恢复至IV级。基底动脉造影仍遗留中度狭窄(图 1C),发病机制考虑基底动脉慢性闭塞并发急性血栓形成。
2.1.2 头颅MRI转入病房后,完善头颅MRI示:双侧桥脑、左侧小脑新鲜脑梗死(图 1A)。
2.1.3 基底动脉HR-MRI基底动脉HR-MRI示:基底动脉环形斑块致管腔重度狭窄(图 1D)。
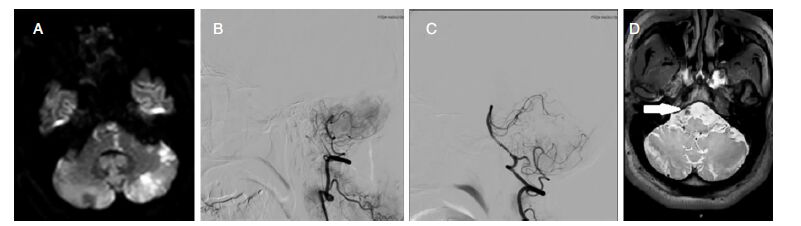
|
| 图 1 病例1影像学资料。A:头颅MRI(DWI序列)示双侧桥脑及左侧小脑新发梗死灶;B:脑动脉造影(动脉溶栓前)示基底动脉起始部闭塞;C:脑动脉造影(动脉溶栓后)示基底动脉部分再通,远端显影,起始部仍遗留中度狭窄;D:基底动脉高分辨磁共振(HR-MRI)示基底动脉环形斑块致管腔重度狭窄。 |
颈动脉超声示:左侧椎动脉走形变异。
2.1.5 TCDTCD示:左侧椎动脉血流速度明显减慢。
2.1.6 血液化验检查血液化验检查示:LDL-C 3.30 mmol/L、同型半胱氨酸12.35 μmol/L、空腹血糖6.21 mmol/L,ANA、ENA谱、ds-DNA、ANCA均未见明显异常。
2.1.7 治疗给予阿司匹林100 mg/d、波立维75 mg/d、阿托伐他汀40 mg/d等治疗。
2.1.8 转归出院时查体:神志清楚,轻度构音障碍,双耳听力较前好转,右侧肢体肌力IV级,左侧肢体肌力V级。
2.2 病例2 2.2.1 DSA检查结果患者DSA检查示:基底动脉中重度偏心性狭窄(图 2B),右小脑前下动脉闭塞。
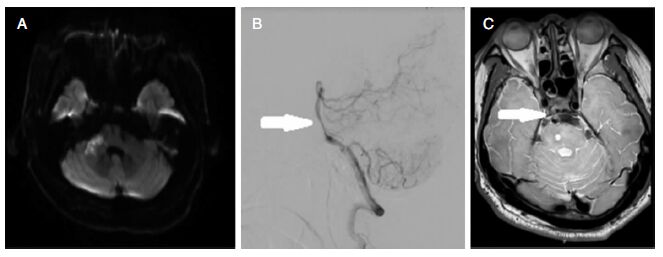
|
| 图 2 病例2影像学资料。A:头颅MRI(DWI序列)示右侧桥脑新发梗死灶;B:脑动脉造影(右椎动脉造影)示基底动脉近段中重度偏心性狭窄,右小脑前下动脉闭塞;C:基底动脉高分辨磁共振(HR-MRI)示基底动脉腹部斑块致基底动脉管腔狭窄。 |
头颅MRI示:右侧桥臂新发梗死灶(图 2A)。
2.2.3 基底动脉HR-MRI基底动脉HR-MRI示:基底动脉腹部斑块致基底动脉重度狭窄(图 2C)。
2.2.4 颈动脉超声颈动脉超声示:未见异常。
2.2.5 TCDTCD示:双侧椎动脉及基底动脉血流速度明显减慢,左侧大脑后动脉P1段血流速度增快。
2.2.6 双耳纯音测听双耳纯音测听示:右耳感音神经性耳聋,听力损失平均为65 dB。
2.2.7 血液化验检查血液化验检查示:LDL-C 1.74 mmol/L、同型半胱氨酸13.56 μmol/L、糖化血红蛋白5.1%,ANA、ENA谱、ds-DNA、ANCA均未见明显异常。
2.2.8 治疗入院后继续维持门诊治疗方案:阿司匹林100mg/d、波立维75mg/d、阿托伐他汀40mg/d等。
2.2.9 转归患者出院时症状部分好转,遗留构音障碍及右耳听力下降。
3 讨论突发性耳聋是指突然发生的(可在数分钟、数小时至3 d以内)、听力在3个或以上相连频率下降30分贝以上的感音神经性耳聋,大多数为单耳突聋,极少数为双耳受累。突聋的常见病因包括感染性、血管性、外伤性及自身免疫性疾病等,但仍有大部分为特发性突聋,病因不明确,可能与微血栓栓塞相关[2]。本文总结了2例以突聋为首发症状的脑梗死病例特点,目前国内对于该类病例研究少见。以突聋为首发症状的脑梗死患者病情可能快速进展,及早的诊治可以提高预后水平。
突聋作为小脑前下动脉梗死的主要症状之一是在2000年后才得到公认的,之前并未得到充分认识,目前关于AICA脑梗死病例中突聋的发生概率,不同文献报道结果不一,约为30%~100%[3],文献结果的差异性缘于单侧听力下降常常被忽视,而不进行及时的听力筛查则很难被发现,因而导致一部分AICA脑梗死的突聋症状被漏诊。在韩国的一项研究中,对12例AICA脑梗死常规进行听力检测,发现11例(92%)患者存在感音神经性耳聋[4]。AICA脑梗死出现突聋存在两种机制[5],其一是小脑前下动脉分支迷路动脉闭塞致内耳缺血,其二是脑桥前庭神经核、蜗神经核及其联络纤维梗死,即耳蜗性及蜗后性两类感音神经性耳聋,二者可通过脑干听觉诱发电位检测帮助鉴别[6]。耳蜗性神经性耳聋较蜗后性更多见,因为耳蜗部位供血动脉迷路动脉为终末支,缺乏侧枝循环,且内耳具有高能量需求,因此内耳容易发生缺血事件,相反,蜗后听神经侧枝循环相对更丰富,少见缺血事件发生。
AICA多从基底动脉下1/3部位发出,沿途供血脑桥被盖部、小脑中脚及小脑前下部、内耳等,AICA脑梗死主要症状包括突聋、眩晕、眼震、共济失调、交叉性感觉障碍、周围性面瘫、凝视麻痹、Horner征,临床表现与血管病变的部位及程度相关。AICA脑梗死最常见的发病机制是:AICA动脉本身动脉粥样硬化血栓形成,或基底动脉血栓延伸至AICA开口处。AICA脑梗死的症状表现取决于梗死灶的大小与部位,突聋可以发生在其它桥小脑症状之前[7],虽然突聋同时伴有其它桥小脑梗死症状是典型的AICA脑梗死表现,但是,也有文献报道突聋可以作为AICA脑梗死的唯一临床表现。尤其对于动脉粥样硬化危险因素多的高龄突聋患者,需高度警惕脑梗死的可能性。
以突聋为首发症状的AICA脑梗死患者如果能够得到及时的诊治,则能提高患者预后水平,但往往因早期症状轻且特异性差,难以与其它病因相鉴别,结合本文2例患者及文献回顾,我们试图总结以突聋为首发症状的脑梗死患者临床特点。首先该类患者常常具有一种或多种动脉粥样硬化危险因素;其次,从症状上来看,与病毒感染不同,内听动脉缺血很少出现单纯听力下降或前庭功能受损,往往二者同时出现;另外,以突聋为首发症状的AICA脑梗死患者大部分存在基底动脉狭窄。在韩国的一项82例AICA脑梗死病例研究中[8],对合并听前庭系统前驱症状的患者及无前驱症状患者的磁共振血管成像(magnetic resonance angiography,MRA)对比分析,发现前者基底动脉近AICA开口处狭窄更多见(62% vs. 13%)。相对于其他的桥小脑症状,基底动脉狭窄的AICA脑梗死患者更容易先出现听前庭系统前驱症状,因为当AICA脑血流速度下降后,内耳对于缺血敏感性高,因而容易出现损伤性症状,其它的桥小脑症状会在突聋之后出现。因此对于突聋的患者,要特别关注基底动脉是否狭窄,如果存在基底动脉狭窄的情况,即使在头颅核磁平扫未发现新鲜梗死灶的情况下,也仍需要警惕脑梗死的发生[9]。对于基底动脉狭窄的影像学诊断方法,脑动脉造影是金标准,在无创检查方法中,高分辨磁共振成像(high resolution magnetic resonance imaging,HR-MRI)对于基底动脉斑块的发现较MRA敏感性更高[10, 11]。言而总之,突聋患者具有以下临床特点时需要高度警惕脑梗死:突聋合并头晕等前庭功能受损症状、突聋合并基底动脉狭窄、突聋合并多种动脉粥样硬化危险因素的高龄患者。本文中所报道的2例患者,早期症状均表现为突聋合并头晕,脑动脉造影均显示基底动脉近段中重度狭窄。
本文中两例患者均行基底动脉HR-MRI评估基底动脉斑块,HR-MRI较MRA存在优势。特别是对于基底动脉轻度狭窄患者,应用HR-MRI诊断基底动脉狭窄的敏感性较MRA更高,在Kim等[10]的研究中,对219例患者的HR-MRI与MRA结果进行对比,其中有13例患者在HR-MRI上显示斑块甚至狭窄程度达到72%,却在MRA上未发现异常。在另一项对41例桥脑梗死患者的研究显示[12],61.5%的病例在HR-MRI上可发现斑块,而只有35%的病例在MRA上发现狭窄。其次,高分辨核磁共振成像可协助我们研究基底动脉斑块的分布部位、性质等特征,目前的HR-MRI研究显示,对于基底动脉穿支梗死的患者,基底动脉斑块分布于腹侧者更多见[13],本文中病例2患者基底动脉斑块分布于腹侧。基底动脉腹侧斑块更容易发生脑梗死事件,可能缘于基底动脉分支虽然是从两侧发出,但是更倾斜于腹侧部分。对于突聋患者,需尽快评估基底动脉,HR-MRI较MRA存在一定优势。
另外需要注意的是,在突聋性脑梗死患者中约1%为非AICA责任血管,大多数变异为小脑后下动脉供血[14],少部分患者内听动脉由基底动脉直接供血,特别是双侧突聋的患者需要注意非AICA脑梗死的可能性[15]。突聋的治疗主要包括:休息、短期激素治疗、抗栓、扩血管改善微循环、高压氧、抗病毒等方面,47%~63%的患者能够在2周内缓解[1]。影响突聋患者预后的因素主要包括[16, 17]:年龄、启动治疗时间、听力损伤程度、是否合并糖尿病或高血压病、是否存在眩晕症状等,治疗启动时间在发病7日后、合并眩晕症状的患者预后不佳。本文中2例突聋性脑梗死病例均给予了溶栓或抗栓、扩血管改善微循环等治疗,病例1启动治疗时间早,患者症状恢复好,病例2仍遗留听力下降。
本文总结2例以突聋为首发症状的脑梗死病例特点,探讨突聋发生的解剖学机制、该类病例的临床特点及影像学特点、预后影响因素分析,以帮助临床上早期及时正确做出诊断及给予治疗,提高患者预后水平。
| [1] | Lee HS, Lee YJ, Kang BS, et al. A clinical analysis of sudden sensorineural hearing loss cases. Korean J Audiol , 2014, 18 (2) : 69–75. DOI:10.7874/kja.2014.18.2.69 |
| [2] | Passamonti SM, Di Berardino F, Bucciarelli P, et al. Risk factors for idiopathic sudden sensorineural hearing loss and their association with clinical outcome. Thromb Res , 2015, 135 (3) : 508–512. DOI:10.1016/j.thromres.2015.01.001 |
| [3] | Amarenco P, Hauw JJ. Cerebellar infarction in the territory of the anterior and inferior cerebellar artery. Brain , 1990, 113 : 139–155. DOI:10.1093/brain/113.1.139 |
| [4] | Lee H, Sohn S, Jung DK, et al. Sudden deafness and anterior inferior cerebellar artery infarction. Stroke , 2002, 33 (12) : 2807–2812. DOI:10.1161/01.STR.0000038692.17290.24 |
| [5] | Martines F, Dispenza F, Gagliardo C, et al. Sudden sensorineural hearing loss as prodromal symptom of anterior inferior cerebellar artery infarction. ORL J Otorhinolaryngol Relat Spec , 2011, 73 (3) : 137–140. DOI:10.1159/000327523 |
| [6] | 李慧, 刘春岭. 前庭阵发症. 国际神经病学神经外科学杂志 , 2014, 41 (2) : 160–163. |
| [7] | Lee H. Audiovestibular loss in anterior inferior cerebellar artery territory infarction:a window to early detection?. J Neurol Sci , 2012, 313 (1-2) : 153–159. DOI:10.1016/j.jns.2011.08.039 |
| [8] | Lee H, Kim JS, Chung EJ, et al. I nfarction in the territory of anterior inferior cerebellar artery:spectrum of audiovestibular loss. Stroke , 2009, 40 (12) : 3745–3751. DOI:10.1161/STROKEAHA.109.564682 |
| [9] | 李隽静. 关于急性前庭综合征的床边检查. 国际神经病学神经外科学杂志 , 2013, 40 (5) : 478–481. |
| [10] | Kim YS, Lim SH, Oh KW, et al. The advantage of high-resolution MRI in evaluating basilar plaques:a comparison study with MRA. Atherosclerosis , 2012, 224 (2) : 411–416. DOI:10.1016/j.atherosclerosis.2012.07.037 |
| [11] | Lim SH, Choi H, Kim HT, et al. Basilar plaque on high-resolution MRI predicts progressive motor deficits after pontine infarction. Atherosclerosis , 2015, 240 (1) : 278–283. DOI:10.1016/j.atherosclerosis.2015.03.029 |
| [12] | Klein IF, Lavallee PC, Mazighi M, et al. Basilar artery atherosclerotic plaques in paramedian and lacunar pontine infarctions:a high-resolution MRI study. Stroke , 2010, 41 (7) : 1405–1409. DOI:10.1161/STROKEAHA.110.583534 |
| [13] | Huang B, Yang WQ, Liu XT, et al. Basilar artery atherosclerotic plaques distribution in symptomatic patients:a 3.0T high-resolution MRI study. Eur J Radiol , 2013, 82 (4) : e199–e203. DOI:10.1016/j.ejrad.2012.10.031 |
| [14] | Lee H. Sudden deafness related to posterior circulation infarction in the territory of the nonanterior inferior cerebellar artery:frequency, origin, and vascular topographical pattern. Eur Neurol , 2008, 59 (6) : 302–306. DOI:10.1159/000121421 |
| [15] | Tabuchi S. Auditory dysfunction in patients with cerebrovascular disease. Sci World J , 2014, 2014 : 261824. |
| [16] | Lin SW, Lin YS, Weng SF, et al. Risk of developing sudden sensorineural hearing loss in diabetic patients:a population-based cohort study. Otol Neurotol , 2012, 33 (9) : 1482–1488. DOI:10.1097/MAO.0b013e318271397a |
| [17] | Tiong TS. Prognostic indicators of management of sudden sensorineural hearing loss in an Asian hospital. Singapore Med J , 2007, 48 (1) : 45–49. |
 2016, Vol. 43
2016, Vol. 43




