扩展功能
文章信息
- 高力扬, 杨帆, 李锦宏, 龙霄翱, 陈兵
- GAO Li-Yang, et al YANG Fan, et al LI Jin-Hong, et al LONG Xiao-Ao, et al CHEN Binget al
- 抗失巢凋亡对胶质瘤细胞增殖和生存的影响
- Effects of anoikis resistance on glioma cell proliferation and survival
- 国际神经病学神经外科学杂志, 2016, 43(5): 391-395
- Journal of International Neurology and Neurosurgery, 2016, 43(5): 391-395
-
文章历史
收稿日期: 2016-08-21
修回日期: 2016-10-12
2. 广东医科大学附属医院神经外科, 广东 湛江 524001
2. Department of Neurosurgery, Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001
细胞增殖、分化及动态平衡由邻近细胞或周围环境所影响[1],而失巢凋亡(Anoikis)是一种特殊条件下的细胞程序性死亡,由细胞脱离细胞外基质或脱离其他细胞而诱发[2]。而在病理情况下,癌细胞可以逃逸失巢凋亡[3]。脑胶质瘤的抗失巢凋亡能力会促进胶质瘤细胞入侵邻近的脑实质(brain parenchyma),进而导致胶质瘤侵袭复发。人脑胶质瘤U87细胞被广泛用于胶质瘤研究,部分研究发现从U87细胞系中可以分离培养出胶质瘤干细胞,说明U87细胞中可能含有胶质瘤干细胞亚群。而肿瘤干细胞具备抗失巢凋亡的能力,并且与肿瘤侵袭和复发密切相关,因此,本研究拟选取U87细胞系探讨失巢条件下胶质瘤的生物学特征变化,以期为胶质瘤的临床治疗提供一定线索。
1 材料与方法 1.1 试剂OCT4抗体、poly-hema购自Sigma公司;CD133,Nanog抗体购自义翘神州公司;FITC荧光二抗购于中杉金桥公司;慢病毒、Polybrene购自吉玛基因公司;嘌呤霉素购自Hyclone公司;胰酶、胎牛血清、高糖培养液购自Gibco公司;总RNA提取试剂盒购自OMEGA公司;逆转录试剂盒购自Takara公司;细胞周期与细胞凋亡检测试剂盒购自碧云天公司。
1.2 U87胶质瘤细胞株的构建接种5×105个U87胶质瘤细胞于60 mm皿中,加培养基4 ml,当细胞融合率为40%~60%时用携带EGFP质粒的慢病毒进行感染。将100 μl的1×108 TU/ml的病毒加入细胞培养基,感染时添加5 μg/ml的Polybrene以提高感染效率。细胞孵育24 h后换液继续培养,并于72小时后观察荧光表达情况,加入1 μM嘌呤霉素筛选细胞,并扩大培养。
1.3 失巢凋亡耐受胶质瘤细胞U87细胞筛选贴壁培养U87细胞,取对数生长期细胞,0.25%胰酶消化后,弃去上清液,重悬浮细胞于10%胎牛血清的DMEM高糖培养液中。收集1×106个细胞悬浮于30 mg/ml浓度的poly-hema包被的60 mm细胞培养皿中。收集悬浮培养10天的细胞团,用胰酶消化后,重新贴壁培养。
1.4 平板细胞克隆形成试验取悬浮培养筛选后的U87胶质瘤细胞和未处理的U87胶质瘤细胞,贴壁培养两天后收集细胞,利用0.25%胰蛋白酶消化后吹打成单个细胞,离心后弃去上清液并重悬细胞于10%FBS 的高糖DMEM中。分别进行细胞计数,最终接种500个细胞于60 mm培养皿中,接种一周后加入甲醛固定并用结晶紫染液染色。将平皿叠加于网格上,统计克隆数并计算克隆形成率。
1.5 mRNA的提取及荧光定量PCR(RT-qPCR)分析取对数生长期细胞培养,待细胞90%融合后消化收集细胞。利用总RNA提取试剂盒提取mRNA,电泳法检测mRNA质量。利用逆转录试剂盒将mRNA逆转录为cDNA,然后根据检测试剂盒操作说明建立反应体系,进行实时荧光定量PCR检测,并用ROCHE LightCycler480 II荧光定量PCR仪检测。基因表达分析采用相对定量,通过管家基因RNA对目的基因表达水平的校准来衡量目的基因RNA的表达水平。
1.6 流式细胞仪检测细胞周期将对数期细胞接种后培养,利用无血清培养液同步化细胞2 h后,消化收集细胞,冷磷酸盐缓冲液(PBS,GIBCO)润洗后加入70%预冷的乙醇,4℃固定24 h后重新收集细胞,使用细胞周期与细胞凋亡检测试剂盒处理细胞,使用BD FACSCantoII流式细胞仪在激发波长488 nm处检测红色荧光,同时检测光散射情况。
1.7 统计学处理数据统计学处理采用SPSS 13.0统计软件,组间比较采用T检验,以α=0.05为检验水准。
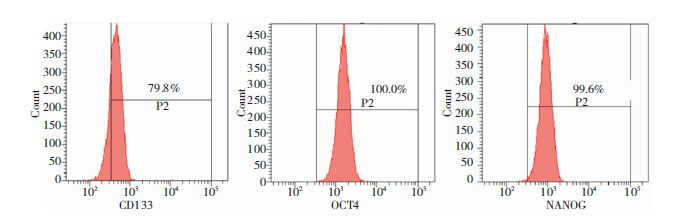
2 结果 2.1 U87胶质瘤细胞的特征鉴定流式细胞仪分析显示,脑胶质瘤U87细胞中三种干细胞相关标记物CD133表达约79%,NANOG表达约99%,而胚胎干细胞多能性相关转录因子OCT4的表达达到100%(图 1)。
|
| 图 1 部分干细胞特异性标记物在U87细胞中的表达。 |
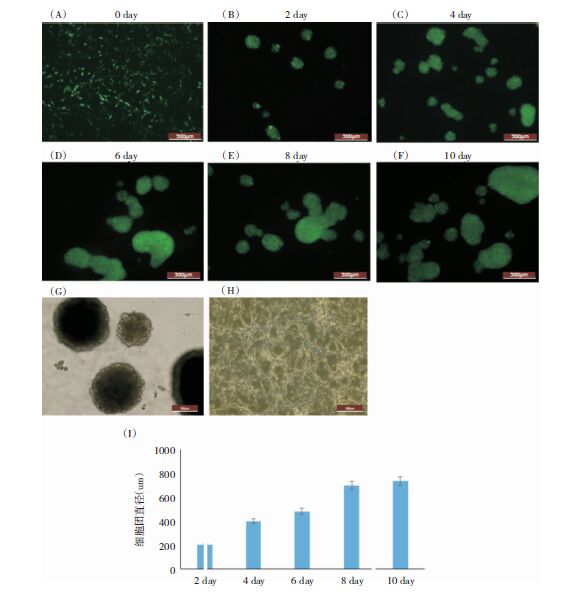
为了筛选抗失巢凋亡的U87细胞,本实验采取了悬浮培养法。U87细胞收集后悬浮于低吸附培养皿中。结果发现,部分细胞聚集成团状,并且连续培养10天后消化细胞,细胞可以继续贴壁生长。为了直观检测细胞团中细胞的存活情况,本实验构建了表达EGFP的U87细胞株。利用携带EGFP质粒的慢病毒感染U87细胞并筛选后,发现U87细胞有明显的EGFP表达(图 2A)。将稳定表达EGFP的U87细胞悬浮培养2天后,发现细胞可以聚集成大小不一的球形细胞团,随着培养时间的增加,部分细胞团连接成形状不规则的大细胞团(图 2)。
|
| 图 2 悬浮培养法筛选抗失巢凋亡U87细胞。(A)U87-EGFP细胞贴壁培养形态。(B-F)悬浮培养U87-EGFP 2天至10天过程中细胞团EGFP表达情况及细胞团形态的改变。(G)白光下第10天U87细胞团形态。(H)悬浮培养10天后,细胞团消化后重新贴壁培养的细胞形态(I)U87-EGFP细胞团直径变化。 |
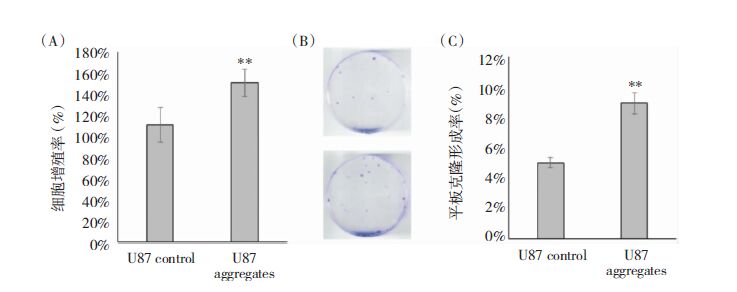
连续培养细胞团10天后消化为单个细胞,并贴壁培养。CCK-8细胞增殖实验发现,悬浮聚集筛选后的抗失巢凋亡U87细胞增值率明显高于对照组(图 3A),且平板克隆形成率显著增加(图 3B,3C)。
|
| 图 3 抗失巢凋亡细胞增殖及克隆形成能力变化。(A)培养48h后CCk-8检测细胞增殖率变化。(B)平板克隆实验。(C)抗失巢凋亡U87细胞克隆形成率变化。**0.001<P<0.05。 |
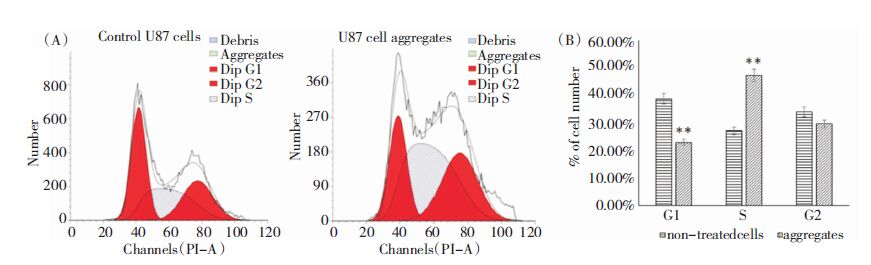
流式结果发现,经过悬浮聚集筛选后的抗失巢凋亡U87细胞,处于DNA合成前期(G1期)的细胞数显著降低,而处于DNA合成期(S期)的细胞百分比增加,而DNA合成后期(G2)期细胞无显著变化(图 4)。
|
| 图 4 抗失巢凋亡细胞周期变化。(A)FACS结果。(B) 不同细胞期细胞比例变化。**0.001<P<0.05。 |
mRNA表达的检测发现,与对照组相比,抗失巢凋亡组中CCND1,SOX1,OCT4显著增加,而c-Myc,MMP7,MMP14,PAX6,NESTIN,TUJ1,GFAP,SOX2,NANOG表达差异不显著(图 5)。
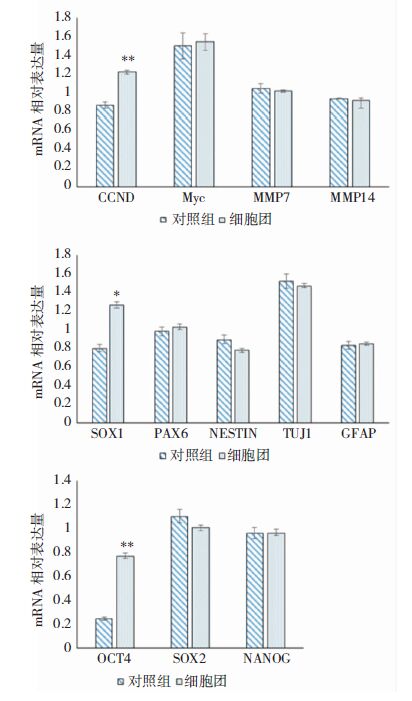
|
| 图 5 RT-qPCR分析基因相对表达情况。 |
以往研究发现U87细胞系中可以分离出具有自我更新和分化能力的胶质瘤干细胞亚群[4, 5]。本研究发现U87细胞中有较强的OCT4,CD133及NANOG等干性相关细胞因子的表达。说明本研究使用的U87脑胶质瘤细胞具有部分胶质瘤干细胞的特征。利用超低粘附培养皿阻止细胞贴壁的悬浮培养法是在肿瘤研究中构建失巢凋亡模型的常用方法[6],本研究采用poly-HEMA包被的方式阻碍脑U87细胞的贴壁生长,迫使细胞悬浮生长,从而减弱细胞与环境及细胞与细胞之间的接触,最终达到诱导细胞失巢凋亡的目的。实验结果发现悬浮培养的U87细胞并没有发生大规模失巢凋亡的现象,而是聚集形成的大小不一的细胞团,这些细胞团消化后可重新贴壁生长。为了直观的检测细胞团中细胞是否存活,本研究构建了可以表达绿色荧光蛋白的U87-EGFP细胞株。通过观察U87-EGFP细胞团,发现大多数失去粘附条件的U87-EGFP细胞通过形成细胞聚集的方式抵抗失巢凋亡。以上结果提示脑胶质瘤U87 细胞是具有抗失巢凋亡能力的细胞系。
经过悬浮聚集培养筛选后的U87胶质瘤细胞增殖速率显著提高而且单个细胞成克隆能力显著增强。说明细胞对群体依赖性减弱而对生存环境的适应性增强。细胞周期是细胞增殖的最终调控途径,实验发现,抗失巢凋亡的胶质瘤细胞中G0/G1期细胞占总细胞比例下降,而S期细胞所占比例上升,G2期细胞数量变化不显著。这些结果表明抗失巢凋亡细胞的分裂和DNA合成比对照组细胞加快,加速其由G0/G1期向S期转换,从而导致胶质瘤细胞增殖加快、细胞活性增强。为了探讨细胞周期改变的原因,我们分析了部分细胞周期相关基因。CCND1是编码细胞周期蛋白D1(Cycling D1)的基因,细胞周期调控中起到重要作用,细胞周期蛋白D1参与调控转录因子E2F的表达,而E2F是驱动细胞由G1期进入S期、促进细胞增殖的因素[7, 8]。以往研究发现过表达细胞信号蛋白D1会引起细胞G1/S期调控异常,从而使细胞发生不可以异常增殖[9]。本研究发现CCND1的表达显著上调,可能是抗失巢抑制胶质瘤细胞周期发生改变的原因之一。而与细胞生长调控、分化相关基因c-Myc,与细胞降解细胞外基质能力相关基因MMP7、MMP14则没有显著变化,说明悬浮聚集培养U87细胞不会促进侵袭、转移相关基因的表达。
基因分析进一步发现,神经分化相关的神经干细胞特异性标志物巢蛋白基因NESTIN、神经元特异性分化蛋白基因TuJ1、神经系统星形胶质细胞活化标志物神经胶质纤维酸性蛋白(GFAP)基因表达无明显变化。说明悬浮聚集培养对U87细胞分化相关基因表达无明显影响。SOX1主要表达于神经外胚层细胞,在胚胎神经发育早期发挥决定细胞分化和命运,并且在整个中枢神经系统发育中发挥调控作用[10]。实验结果显示抗失巢凋亡U87细胞中SOX1基因表达增加,可能与保持胶质瘤细胞未分化状态有关。进而对三种重要的干细胞干性相关转录因子OCT4,NANOG,SOX2的基因表达研究发现,OCT4编码基因POU5F1表达显著增加。近年来,OCT4被发现与胶质瘤恶性程度正性相关[11],OCT4基因表达的增加可能有助于维持抗失巢凋亡U87细胞的未分化状态,使其肿瘤干细胞特征更为显著。而且OCT4表达量的增加是促进CCDN1基因表达的因素之一[12]。综上所述,SOX1和OCT4等干细胞相关基因表达的增加,可能是促进抗失巢凋亡细胞自我更新的内在原因,直接导致抗失巢凋亡细胞具有更强的生存和自我扩增能力。
4 结论1研究发现U87胶质瘤细胞具有部分干细胞特征,U87细胞在失巢情况下没有发生大规模失巢凋亡,而是聚集成团生长,这些抗失巢凋亡细胞的增殖速率和生存能力显著增强。其中细胞周期调控的改变和细胞周期调控基因的表达上调,可能是促进增殖的内在原因。而细胞中SOX1、OCT4基因表达的上调,可能是细胞生存、扩张能力增强的条件。本研究证明抗失巢凋亡的胶质瘤细胞对生存环境依赖性较弱,具有更强的增殖和自我更新能力,这些细胞可能是胶质瘤在颅内侵袭复发的重要因素。
| [1] | Nelson CM, Bissell MJ. Of extracellular matrix, scaffolds, and signaling:tissue architecture regulates development, homeostasis, and cancer. Annu Rev Cell Dev Biol , 2006, 22 (1) : 287–309. DOI:10.1146/annurev.cellbio.22.010305.104315 |
| [2] | Frisch SM, Francis H. Disruption of epithelial cell-matrix interactions induces apoptosis. J Cell Biol , 1994, 124 (4) : 619–626. DOI:10.1083/jcb.124.4.619 |
| [3] | Desgrosellier JS, Cheresh DA. Integrins in cancer:biological implications and therapeutic opportunities. Nat Rev Cancer , 1994, 10 (10) : 9–22. |
| [4] | 苑召虎, 胡子有, 张兰兰, 等. 槲皮素对胶质瘤U87细胞侵袭、迁移、增殖及其细胞周期的影响. 南方医科大学学报 , 2013, 33 (2) : 29–33. |
| [5] | 刘于海, 牛朝诗, 李冬雪. 血清剥夺法分离u87细胞系中的胶质瘤干细胞. 中国组织工程研究与临床康复 , 2010, 14 (1) : 6–10. |
| [6] | Bao W, Qiu H, Yang T, et al. Upregulation of TrkB Promotes Epithelial-Mesenchymal Transition and Anoikis Resistance in Endometrial Carcinoma. Agoulnik IU, editor. PLoS One, Public Library of Science , 2013, 8 (7) : 670–692. |
| [7] | Zhou J, LI Lu, Fang LI, et al. Quercetin reduces cyclin D1 activity and induces G1 phase arrest in HepG2 cells. Oncol Lett , 2016, 12 (1) : 516–522. |
| [8] | Chen HZ, Tsai SY, Leone G. Emerging roles of E2Fs in cancer:an exit from cell cycle control. Nat Rev Cancer , 2009, 9 (11) : 785–797. DOI:10.1038/nrc2696 |
| [9] | Noel EE, Yeste-Velasco M, Mao X, et al. The association of CCND1 overexpression and cisplatin resistance in testicular germ Cell tumors and other cancers. Am J Pathol , 2010, 176 (6) : 2607–2615. DOI:10.2353/ajpath.2010.090780 |
| [10] | Pevny LH, Sockanathan S, Placzek M, et al. A role for SOX1 in neural determination. Development , 1998, 125 (10) : 1967–1978. |
| [11] | Bo W, Huang TJ, Zheng YY. The expression and significance of Sox2 and Oct4 in human glioma tissue. China Mod Medcine , 2015, 22 (9) : 18–21. |
 2016, Vol. 43
2016, Vol. 43



