扩展功能
文章信息
- 蔡优生, 叶钦勇
- 线粒体未折叠蛋白反应及其与神经系统疾病关系研究进展
- 国际神经病学神经外科学杂志, 2016, 43(4): 362-366
-
文章历史
收稿日期: 2016-04-05
修回日期: 2016-07-18
2. 福建医科大学附属协和医院神经内科/福建医科大学脑血管病研究所, 福建省 福州市 350001
线粒体是十分重要的细胞器,它的功能包括产生能量、合成生物分子和参与凋亡等。线粒体蛋白质量控制(PQC)是细胞维持正常状态的关键机制,决定着线粒体命运。PQC体系包括线粒体未折叠蛋白反应(mitochondrial unfolded protein response, mtUPR)、线粒体氧化应激反应、线粒体生物合成、线粒体动力学异常、线粒体DNA异常以及线粒体自噬等方面。早期发生的mtUPR是一种新兴的适应性应激反应,确保了线粒体蛋白质组最佳的质量和功能。mtUPR在维护线粒体健康中起重要作用,与其他PQC途径相互作用,共同维护线粒体正常结构和功能[1, 2]。越来越多证据表明,mtUPR可能直接或间接地参与了神经系统疾病的发生发展。
1 mtUPR的定义、激活及信号转导 1.1 mtUPR的定义mtUPR是指在各种应激条件下,线粒体基质积累大量未折叠、错误折叠以及无效蛋白质,导致核编码靶向线粒体伴侣蛋白,如热休克蛋白家族A成员9(heat shock protein family A Member 9, HSPA9)、热休克蛋白60(heat shock protein 60, HSP60)、热休克蛋白10(heat shock protein 10, HSP10)以及蛋白酶如酪蛋白线粒体基质缩氨酸酶蛋白水解亚基(caseinolytic mitochondrial matrix peptidase proteolytic subunit, CLPP)、YME1样ATP酶(YME1-like 1 ATPase, YME1L1)、线粒体Lon蛋白酶样蛋白(mitochondrial Lon protease-Like protein, LONP)等表达上调;其中伴侣蛋白帮助错误折叠蛋白恢复正常构象、新合成蛋白正确折叠,蛋白酶降解无用蛋白。这种由线粒体至核的逆行信号传导过程即为mtUPR[3, 4]。
1.2 mtUPR的激活许多因素可刺激mtUPR的激活,其模型已经分别在线虫、果蝇、哺乳动物细胞培养及小鼠建立。这些因素主要包括以下五个方面:①损害线粒体蛋白质:鸟氨酸氨甲酰转移酶(ornithine carbamoyl transferase, OTC)为线粒体基质蛋白,敲除OTC第33至144位氨基酸后发生突变(dOTC),可观察到线粒体应激反应[4]。百草枯通过诱导线粒体锰超氧化物歧化酶3(superoxide dismutase 3, SOD-3)基因表达,使线粒体基质内的活性氧(reactive oxygen species, ROS)堆积,从而损伤线粒体内蛋白质,这些氧化损伤蛋白质大量积累诱发mtUPR[5]。②干扰电子传递链(electron transfer chain, ETC):这会产生线粒体-核蛋白失衡,即通过下调或抑制单个或成组ETC部分,导致线粒体DNA(mtDNA)和核DNA(nDNA)编码的ETC亚基不匹配,未组装亚基与分子伴侣共同停留于线粒体基质中[6, 7]。在哺乳动物细胞敲除130 KD亮氨酸富集蛋白(130 KDa leucine-rich protein, LRP130)基因,导致ETC复合体IV缺失,其余亚基积累在线粒体基质中,触发mtUPR[8]。线虫RNA干扰(RNAi)核编码细胞色素C氧化酶(cytochrome C oxidase, CCO-1)[9],以及在编码复合物III基因isp-1或泛醌合成基因CLK-1的突变体株,使ETC亚基表达减少,mtUPR亦可观察到[10]。ETC抑制剂如抗霉素或鱼藤酮,通过产生ROS激活mtUPR[11]。③干扰线粒体输入和结构:药物三氧化二砷特异性干扰线粒体内膜转位酶23(translocase of inner mitochondrial membrane 23, TIM23)[12]及YME1L1介导的内膜转位酶(inner membrane preprotein translocase tim17a, TIM17a)降解,诱发mtUPR[13]。④干扰蛋白质量控制(PQC):体内和体外模型敲除HSPA9基因[14],既增加线粒体内未折叠蛋白质,又使ROS水平上升及线粒体膜电位(mitochondrial membrane potential, MMP)丢失,强烈激活mtUPR。这也在RNAi干扰hsp60、DnaJ同源亚家族C成员21 (DnaJ homolog subfamily C member 21, dnj-21)、痉挛性截瘫蛋白7 (spastic paraplegia 7 protein, spg-7)模型中观察到[5]。⑤干扰线粒体翻译:线粒体蛋白合成时,错误掺入精氨酸类似物刀豆氨酸,诱发异常翻译产物和不稳定mtDNA,导致线粒体呼吸链复合物丢失[15];干扰细菌和线粒体翻译的抑制剂,如强力霉素及氯霉素,下调线粒体核糖体蛋白表达[7]。以上均启动mtUPR。
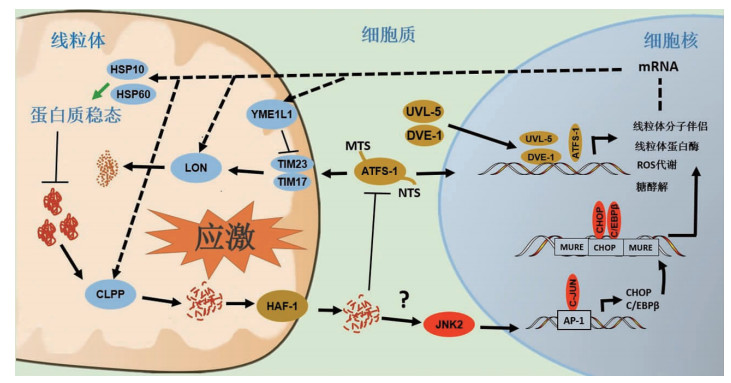
1.3 mtUPR的信号转导典型mtUPR在未折叠蛋白积累时引发。在线虫体内,CLPP剪切形成的多肽由转运蛋白1(haf ABC transporter 1, HAF-1)输出到线粒体外[16, 17],然后分散到细胞质。这些肽通过与应激转录因子1(activating transcription factor 1, ATFS-1)相互作用触发信号级联。ATFS-1有线粒体靶向序列(mitochondrial targeting sequence, MTS)和核靶向序列(nuclear targeting sequence, NTS),无应激时ATFS-1在MTS作用下进入线粒体基质内,由Lon蛋白酶降降解[12, 17];应激时ATFS-1进入受到抑制,在NTS引导下易位到细胞核内,与转录调节子泛素样蛋白5(ubiquitin-like protein 5, ubl-5)和同源结构域转录因子1(dve-1)复合体相结合,激活相关伴侣蛋白、蛋白酶基因表达,使线粒体蛋白质稳态恢复(图 1)。
但在哺乳动物mtUPR并不十分清楚。现有数据表明mtUPR在哺乳动物身上信号转导更加复杂,如何驱动线粒体-核间具体信号转导机制有待进一步确定。早期研究发现在d-OTC转染哺乳动物细胞,碳端Jun氨基末端激酶1(C-Jun N-terminal kinase 1, c-Jun)和碳端Jun氨基末端激酶2(C-Jun N-terminal kinase 2, JNK2)磷酸化后绑定到碱性亮氨酸拉链(basic-leucine zipper, b-zip)转录因子基因CCAAT/增强子结合蛋白同源蛋白(CCAAT/Enhancer-Binding Protein Homologous Protein, CHOP)和CCAAT/增强子结合蛋白β(CCAAT/enhancer-binding protein, C/EBPβ)启动子,使它们激活,从而启动细胞核中mtUPR基因表达(图 1)。mtUPR元件(mitochondrial unfolded protein response elements, MUREs)的诱导需要CHOP-C/EBPβ二聚化, 其靶基因的表达与二聚体的转录因子CHOP-C/EBPβ相互作用,MUREs结合到两侧靶向启动子位点[18](图 1)。CHOP可通过多种形式应激诱导,目前仍不清楚它如何与线粒体应激反应协调一致地活动。
图中橙色为在线虫上信号转导,红色为哺乳动物信号转导,蓝色的为二者共有信号转导途径。AP-1为Jun激活域绑定蛋白(Jun activation domain binding protein)。
2 mtUPR与神经系统疾病的关系mtUPR激活是早期发生的线粒体保护反应,在神经系统疾病中的保护作用体现在以下三个方面。首先,发生应激反应时,线粒体新蛋白合成和输入暂时阻断,线粒体基质中的转录受到抑制,膜蛋白酶选择性降解输入孔道[10, 13, 19]。其次,减少线粒体损伤。mtUPR可及时感知线粒体内蛋白稳态的破坏,及时纠正,防止损害继续扩大,避免了线粒体的自噬[2]。最后,mtUPR与衰老和寿命相关。长寿蛋白3(sirtuin 3, SIRT3)可通过转录因子叉头框蛋白A3(forkhead box protein A3, FOXA3)脱乙酰化调节mtUPR活性,促进自身在细胞核中积累,并允许表达抗氧化基因[20],但他的不足与年龄相关疾病(如神经系统疾病、代谢综合征、癌症等)发病率较高有关[21]。mtUPR可通过辅酶I(nicotinamide adenine dinucleotide, NAD+)或核糖体聚合酶(poly ADP-ribose polymerase, PARP)抑制剂诱导寿命的延长[19];并可在过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor gamma, coactivator 1 alpha, PGC-1α)过表达的情况下,增加线粒体生物合成,此时几个年龄相关衰老表型可以推迟[22]。这在神经系统疾病尤其明显,表明维持线粒体的健康可能具有治疗价值。
目前与mtUPR关系较密切的神经系统疾病主要有以下三种。
2.1 mtUPR与帕金森病已有众多的证据表明线粒体功能障碍在帕金森病(Parkinson’s disease, PD)的发生发展中有重要作用[23]。PD病人线粒体蛋白需要维持一个健康的线粒体池。目前发现家族性帕金森病(PD)的几个联合基因,如α-突触核蛋白(α-synuclein, a-Syn)、Parkin、PINK1、DJ-1和LRRK2等,均可影响线粒体功能,这为线粒体功能障碍与PD致病过程的联系提供了新证据。
目前,mtUPR在对PD的影响因素中未占据主要地位,可能与哺乳动物中mtUPR参与PD发生发展的机制尚未完全阐明有关。各种诱发mtUPR因素,如基因突变、ROS产生者百草枯、复合物I抑制剂鱼藤酮等,在引起线粒体功能障碍同时也诱发帕金森样症状[24]。在PD患者黑质(substantia nigra, SN)HSPA9基因表达水平降低,提示mtUPR的参与[25, 26]。此外,mtUPR分子伴侣HSP60通过PINK1/Parkin途径发挥作用。在PINK1损失的多巴胺能(dopaminergic, DA)神经元细胞培养,线粒体HSP60表达下调40%[27]。这可能是Parkin和PINK1与HSP60互动关闭mtUPR,此时线粒体被认为因过度受损不能恢复;如果mtUPR持续发生,HSP60可能引起线粒体自噬。上述情况暗示了在PD中相关mtUPR的保护作用,同时,也表明在哺乳动物身上找到类似于ATFS-1的同源物十分迫切。
2.2 mtUPR与遗传性痉挛性截瘫mtUPR对神经系统疾病的作用证据一个是来自于遗传性痉挛性截瘫(hereditary spastic paraplegia, HSP)。HSP是一种少见的神经退行性疾病,临床表现为双下肢进行性肌张力增高和无力、剪刀步态为特征,具有明显遗传异质性的综合征,常常伴有线粒体功能障碍。目前已知13个基因突变导致痉挛性截瘫,其中两个分别损害线粒体伴侣蛋白HSP60和蛋白酶痉挛性截瘫蛋白7(spastic paraplegia 7 protein, SPG7)[28]。它们编码基质AAA+蛋白酶亚基,这种蛋白酶降解错误折叠的蛋白质及调节线粒体核糖体聚合。线粒体基质蛋白HSP60介导三磷酸腺苷(ATP)依赖的各种蛋白质折叠,使其在分子质量控制机制中成为一个重要的扮演者。另一个研究中发现,HSP60基因突变引起的遗传性痉挛性截瘫患者,在疾病进展中线粒体蛋白质量控制蛋白酶LON和CLPP表达降低[29]。这提示未通过HSP60加工的错误折叠蛋白在线粒体基质中积累,表明此改变使线粒体蛋白折叠能力进一步恶化,对细胞功能造成致命性损害。
2.3 mtUPR与Friedreich共济失调mtUPR诱导的另一个神经系统疾病是Friedreich共济失调(Friedreich ataxia, FA),该病以青春期起病、腱反射消失及深感觉缺失为特征。FA由于编码共济蛋白基因第一个内含子突变,表达的含铁硫簇亚基的ETC复合物I、II和III组装及功能受损。在线虫FA模型,细胞内的热休克反应(heat shock response, HSP)和mtUPR都被激活,表明线粒体和细胞质未折叠蛋白的积累[30],可能是由于缺乏铁-硫辅因子导致折叠中间体的积累。此外,在FA模型中,CLPP表达随着时间的增加而增加[31]。在早期细胞培养,积累过多的错误折叠蛋白也会出现这种情况[4]。以上结果支持mtUPR在保护线粒体蛋白折叠环境中的重要性。在这种疾病背景下是否有可能进一步增加mtUPR,从而恢复线粒体蛋白质稳态仍有待进一步研究。
3 结语目前mtUPR的研究大多集中在线虫和酵母,接下来更多的重点应放在对哺乳动物理解上。在发育、健康、疾病和衰老方面,mtUPR的生理作用需要进一步明确。如何调节蛋白质稳态来建立线粒体最佳质量和功能,这应成为未来治疗的干预目标。在PD中,关于线粒体自噬调控和mtUPR最近的一些发现表明,促进线粒体的整体健康可以限制PD的疾病进展[24],说明这条途径可以帮助我们管理一些与衰老有关的疾病,如神经系统疾病、代谢性疾病和癌症等。
| [1] | Kaushik S, Cuervo AM. Proteostasis and aging. Nat Med , 2015, 21 (12) : 1406–1415. DOI:10.1038/nm.4001 |
| [2] | Andreux PA, Houtkooper RH, Auwerx J. Pharmacological approaches to restore mitochondrial function. Nat Rev Drug Discov , 2013, 12 (6) : 465–483. DOI:10.1038/nrd4023 |
| [3] | Jovaisaite V, Auwerx J. The mitochondrial unfolded protein response-synchronizing genomes. Curr Opin Cell Biol , 2015, 33 : 74–81. DOI:10.1016/j.ceb.2014.12.003 |
| [4] | Zhao Q, Wang J, Levichkin IV, et al. A mitochondrial specific stress response in mammalian cells. EMBO J , 2002, 21 (17) : 4411–4419. DOI:10.1093/emboj/cdf445 |
| [5] | Yoneda T, Benedetti C, Urano F, et al. Compartment-specific perturbation of protein handling activates genes encoding mitochondrial chaperones. J Cell Sci , 2004, 117 (18) : 4055–4066. DOI:10.1242/jcs.01275 |
| [6] | Owusu-Ansah E, Song W, Perrimon N. Muscle mitohormesis promotes longevity via systemic repression of insulin signaling. Cell , 2013, 155 (3) : 699–712. DOI:10.1016/j.cell.2013.09.021 |
| [7] | Houtkooper RH, Mouchiroud L, Ryu D, et al. Mitonuclear protein imbalance as a conserved longevity mechanism. Nature , 2013, 497 (7450) : 451–457. DOI:10.1038/nature12188 |
| [8] | K hler F, Müller-Rischart AK, Conradt B, et al. The loss of LRPPRC function induces the mitochondrial unfolded protein response. Aging (Albany NY) , 2015, 7 (9) : 701. |
| [9] | Wu Y, Williams EG, Dubuis S, et al. Multilayered genetic and omics dissection of mitochondrial activity in a mouse reference population. Cell , 2014, 158 (6) : 1415–1430. DOI:10.1016/j.cell.2014.07.039 |
| [10] | Baker BM, Nargund AM, Sun T, et al. Protective coupling of mitochondrial function and protein synthesis via the eIF2α kinase GCN-2. PLoS Genet , 2012, 8 (6) : e1002760. DOI:10.1371/journal.pgen.1002760 |
| [11] | Runkel ED, Liu S, Baumeister R, et al. Surveillance-Activated Defenses Block the ROS-Induced Mitochondrial Unfolded Protein Response. PLoS Genet , 2013, 9 (3) : e1003346. DOI:10.1371/journal.pgen.1003346 |
| [12] | Nargund AM, Pellegrino MW, Fiorese CJ, et al. Mitochondrial import efficiency of ATFS-1 regulates mitochondrial UPR activation. Science , 2012, 337 (6094) : 587–590. DOI:10.1126/science.1223560 |
| [13] | Rainbolt TK, Atanassova N, Genereux JC, et al. Stress-regulated translational attenuation adapts mitochondrial protein import through Tim17A degradation. Cell Metab , 2013, 18 (6) : 908–919. DOI:10.1016/j.cmet.2013.11.006 |
| [14] | Burbulla LF, Fitzgerald JC, Stegen K, et al. Mitochondrial proteolytic stress induced by loss of mortalin function is rescued by Parkin and PINK1. Cell Death Dis , 2014, 5 : e1180. DOI:10.1038/cddis.2014.103 |
| [15] | Konovalova S, Hilander T, Loayza-Puch F, et al. Exposure to arginine analog canavanine induces aberrant mitochondrial translation products, mitoribosome stalling, and instability of the mitochondrial proteome. Int J Biochem Cell Biol , 2015, 65 : 268–274. DOI:10.1016/j.biocel.2015.06.018 |
| [16] | Haynes CM, Petrova K, Benedetti C, et al. ClpP mediates activation of a mitochondrial unfolded protein response in C. elegans. Dev Cell , 2007, 13 (4) : 467–480. DOI:10.1016/j.devcel.2007.07.016 |
| [17] | Haynes CM, Yang Y, Blais SP, et al. The matrix peptide exporter HAF-1 signals a mitochondrial UPR by activating the transcription factor ZC376. 7 in C. elegans. Mol Cell , 2010, 37 (4) : 529–540. DOI:10.1016/j.molcel.2010.01.015 |
| [18] | Aldridge JE, Horibe T, Hoogenraad NJ. Discovery of genes activated by the mitochondrial unfolded protein response (mtUPR) and cognate promoter elements. PloS one , 2007, 2 (9) : e874. DOI:10.1371/journal.pone.0000874 |
| [19] | Rath E, Berger E, Messlik A, et al. Induction of dsRNA-activated protein kinase links mitochondrial unfolded protein response to the pathogenesis of intestinal inflammation. Gut , 2012, 61 (9) : 1269–1278. DOI:10.1136/gutjnl-2011-300767 |
| [20] | Papa L, Germain D. SirT3 regulates the mitochondrial unfolded protein response. Mol Cell Biol , 2014, 34 (4) : 699–710. DOI:10.1128/MCB.01337-13 |
| [21] | McDonnell E, Peterson BS, Bomze HM, et al. SIRT3 regulates progression and development of diseases of aging. Trends Endocrinol Metab , 2015, 26 (9) : 486–492. DOI:10.1016/j.tem.2015.06.001 |
| [22] | Dillon LM, Williams SL, Hida A, et al. Increased mitochondrial biogenesis in muscle improves aging phenotypes in the mtDNA mutator mouse. Hum Mol Genet , 2012, 21 (10) : 2288–2297. DOI:10.1093/hmg/dds049 |
| [23] | 冯娅, 吴云成. 线粒体功能异常在帕金森病发病机制中的研究进展. 国际神经病学神经外科学杂志 , 2014, 41 (4) : 349–352. |
| [24] | Pellegrino MW, Haynes CM. Mitophagy and the mitochondrial unfolded protein response in neurodegeneration and bacterial infection. BMC Biol , 2015, 13 (1) : 1. DOI:10.1186/s12915-014-0111-3 |
| [25] | De Mena L, Coto E, Sánchez-Ferrero E, et al. Mutational screening of the mortalin gene (HSPA9) in Parkinson's disease. J Neural Transm (Vienna) , 2009, 116 (10) : 1289–1293. DOI:10.1007/s00702-009-0273-2 |
| [26] | Jin J, Hulette C, Wang Y, et al. Proteomic identification of a stress protein, mortalin/mthsp70/GRP75 relevance to Parkinson disease. Mol Cell Proteomics , 2006, 5 (7) : 1193–1204. DOI:10.1074/mcp.M500382-MCP200 |
| [27] | Kim KH, Song K, Yoon SH, et al. Rescue of PINK1 protein null-specific mitochondrial complex IV deficits by ginsenoside Re activation of nitric oxide signaling. J Biol Chem , 2012, 287 (53) : 44109–44120. DOI:10.1074/jbc.M112.408146 |
| [28] | Hansen JJ, Dürr A, Cournu-Rebeix I, et al. Hereditary spastic paraplegia SPG13 is associated with a mutation in the gene encoding the mitochondrial chaperonin Hsp60. Am J Hum Genet , 2002, 70 (5) : 1328–1332. DOI:10.1086/339935 |
| [29] | Hansen J, Corydon TJ, Palmfeldt J, et al. Decreased expression of the mitochondrial matrix proteases Lon and ClpP in cells from a patient with hereditary spastic paraplegia (SPG13). Neuroscience , 2008, 153 (2) : 474–482. DOI:10.1016/j.neuroscience.2008.01.070 |
| [30] | Ventura N, Rea SL, Schiavi A, et al. p53/CEP-1 increases or decreases lifespan, depending on level of mitochondrial bioenergetic stress. Aging cell , 2009, 8 (4) : 380–393. DOI:10.1111/ace.2009.8.issue-4 |
| [31] | Guillon B, Bulteau AL, Wattenhofer-Donzé M, et al. Frataxin deficiency causes upregulation of mitochondrial Lon and ClpP proteases and severe loss of mitochondrial Fe-S proteins. FEBS J , 2009, 276 (4) : 1036–1047. DOI:10.1111/j.1742-4658.2008.06847.x |
 2016, Vol. 43
2016, Vol. 43