扩展功能
文章信息
- 李岩, 王荣祺, 付静, 邢炜
- LI Yan, et al Wang Rong-qi, et al FU Jing, et al Xing Weiet al
- 难治性癫痫相关脑血管畸形15例临床病理分析
- Clinicopathologic features of patients with intractable epilepsy associated with cerebrovascular malformation: an analysis of 15 cases
- 国际神经病学神经外科学杂志, 2016, 43(4): 328-332
- Journal of International Neurology and Neurosurgery, 2016, 43(4): 328-332
-
文章历史
收稿日期: 2016-01-21
修回日期: 2016-08-10
我国癫痫发病率为0.68%~0.7%, 其中有20%~30%的患者因对抗癫痫药物耐药或其它原因,癫痫发作难以控制而成为难治性癫痫,最终需行外科手术治疗[1]。引起癫痫的一种颅内病变为脑血管畸形,此种疾病目前治疗方式争议较大,并且部分患者在手术切除畸形血管后仍然存在临床癫痫发作,不能改善生活质量。本文回顾15例因难治性癫痫接受功能神经外科手术的脑血管畸形患者的临床、影像及病理资料,探讨脑血管畸形致难治性癫痫患者脑切除标本的临床病理学特点及分型,为进一步明确认识脑血管畸形与难治性癫痫的关系,并为脑血管畸形患者术前评估和术后疗效的判断提供一定的理论依据。
1 资料和方法 1.1 一般资料收集2009年~2015年在北京市海淀医院功能神经科接受癫痫神经外科手术治疗的15例脑血管畸形患者的临床病理学资料,包括年龄、性别、病史、病程、发作形式、手术方式、手术部位、影像学资料、随访资料等,进行回顾性分析。
1.2 标本制作方法手术切除的脑组织标本按规范的癫痫标本处理程序进行处理[2, 3],脑组织块垂直皮层切成3~5 mm厚,每间隔一块取材,如大体见异常者全部取材;海马组织行冠状面取材;经10%福尔马林液固定,常规石蜡包埋,4 μm厚切片,常规HE染色。
1.3 病理学分型方法局灶性皮质发育不良(focal cortical dysplasia, FCD)按照2011年国际抗癫痫联盟(ILAE)[4]对FCD的分型标准进行诊断及分型。
1.4 随访方法术后随访0.5~8年。术后癫痫缓解率根据Engel分级标准进行评估:Ⅰ级为癫痫发作消失;Ⅱ级为癫痫发作极少或几乎消失;Ⅲ级为癫痫发作频率减少90%以上;Ⅳ级为癫痫发作频率减少50%~90%;Ⅴ级为癫痫发作频率减少小于50%。
2 结果 2.1 临床资料15例患者均表现为难治性癫痫,其中包括8例海绵状血管瘤,7例SWS综合征。男性8例,女性7例,发病年龄1月龄~29岁,既往以高热、脑炎起病者3例,其余均为无明显诱因出现癫痫发作。病程2~24年。手术年龄2~31岁。癫痫发作形式以复杂部分性发作为主,并多数继发全面性强直-阵挛发作,其余少见的发作形式有单纯部分性发作和失神发作等。不同病例间发作频率差别较大。所有病例术后获随访,随访结果及具体临床资料见表 1。
| 海绵状血管瘤 | SWS综合征 | |
| 病例数 | 8 | 7 |
| 男/女 | 4/4 | 4/3 |
| 发病年龄 | 1~29(平均12.1)岁 | 1~12(平均7.9)月龄 |
| 病程(年) | 2~24(平均11.2) | 1.5~19(平均7.2) |
| 手术年龄 | 7~31(平均21)岁 | 2~20(平均7.8)岁 |
| 诱因 | 1例为高热后癫痫 | 1例为高热后癫痫,1例为脑炎后癫痫 |
| 7例无明显诱因 | 5例无明显诱因 | |
| 癫痫发作频率 | 2次/月到10余次/天不等 | 1~2次/月到10~20次/天不等 |
| 手术方式 | 病灶及致痫灶切除手术 | 病灶及致痫灶切除手术 |
| 1例同时行胼胝体前段切开术 | 1例行功能性大脑半球切除术 | |
| 随访时间(年) | 0.5~7(平均2.7) | 1~8(平均4.1) |
| 随访评估 | EngelⅠ级8例 | EngelⅠ级3例,Ⅱ级2例,Ⅲ级1例,Ⅳ级1例 |
8例海绵状血管瘤患者MRI显示病灶部位囊性占位,SWS综合征患者中6例CT显示脑萎缩,软脑膜表面混杂密度影,增强后明显脑回状强化,局部颅骨增厚;5例病变局限于一侧大脑半球,1例累及全脑;5例伴钙化;另1例显示双侧顶枕叶蛛网膜下腔增宽。MRI 6例表现为T2W1及Flair片状高信号影,MRI增强扫描表现为特征性的脑回样强化;1例仅见局部区域异常信号影。
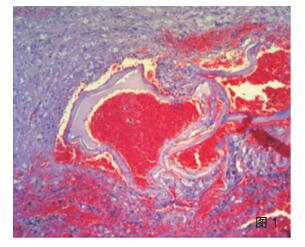
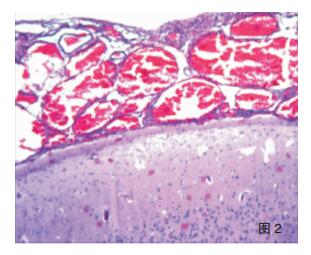
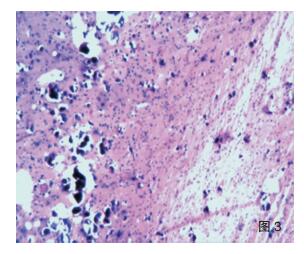
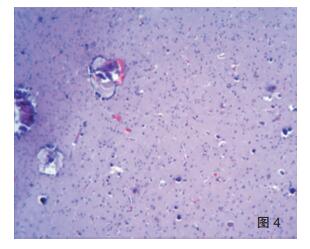
2.3 病理学特点及分型海绵状血管瘤手术标本大体可见脑组织中暗红色区域,镜下可见多个薄壁扩张的血管腔形成血管瘤(图 1);周围脑皮质可见皮质发育不良,诊断为海绵状血管瘤伴FCDⅢc型。SWS综合征患者手术标本大体见送检脑组织表面脑膜呈暗红色,可见迂曲扩张的小血管网伴淤血;切面灰质、白质分界不清,皮质灰红、质韧,有砂砾感。镜检软脑膜增厚,蛛网膜下腔可见大量扩张的、大小不一的血管腔,形成海绵状血管瘤改变(图 2),管腔内淤血;下方皮层内可见大量钙化灶,可在灰质中呈条带状分布(图 3),也可在小血管壁及其周围灰质弥漫分布(图 4),白质内亦见钙化灶,其中1例异位灰质团内也可见显著钙化。病变部位皮层萎缩,灰质变薄,神经元减少,胶质细胞增生,部分皮层神经元排列紊乱,出现切线皮质异常,并可见未成熟神经元和肥大的锥体细胞,局部灰质出现放射状皮质异常,灰质内小神经元垂直排列成微柱状结构,1例可见小脑回畸形。不同病例脑膜血管瘤的范围及皮层内钙化的程度不一。病理诊断形态学均表现为软脑膜血管瘤病及皮层内多发钙化,局灶性皮质发育不良;结合临床、影像学特征及组织学形态符合SWS综合征合并FCDⅢc。
|
| 图 1 脑内海绵状血管瘤(HE ×40); |
|
| 图 2 SWS的软脑膜血管瘤(HE ×40); |
|
| 图 3 SWS的灰质内条带状钙化(HE ×40); |
|
| 图 4 SWS的小血管壁钙化及FCD(HE ×40) |
脑血管畸形包括动静脉畸形、软脑膜血管畸形、海绵状血管瘤、脑膜血管瘤病及SWS综合征的软脑膜血管瘤病等。本组病例中引起难治性癫痫的仅出现海绵状血管瘤8例及SWS综合征7例。
脑海绵状血管瘤(cavernous angioma,CA)是一种特殊类型的脑血管畸形,病灶由海绵状血管腔隙组成,无粗大的供血动脉和引流静脉,血管壁由胶原纤维组成,并衬有扁平内皮细胞,血管间极少有脑实质组织[5]。此疾病为常染色体显性遗传,散发较为少见。大多数遗传性颅内海绵状血管瘤均可检测到基因变异。Seker等[6]认为,颅内海绵状血管瘤基因1、2、3(即CCM1、CCM2、CCM3)的变异与该病的发生密切相关。CA占颅内血管畸形的5%~10%,分为脑内型和脑外型两种,以脑内型多见,病灶部位较深,易于发展为难治性癫痫,并且手术难度较大。其中幕上海绵状血管瘤最常见的临床症状是癫痫发作,约40%~70%的患者会导致临床上难以控制症状的癫痫,虽然目前海绵状血管瘤伴癫痫的最佳治疗方案并不明确, 但很多医疗中心采用手术治疗的方法并取得了良好效果[7]。有时仅切除病灶仍难以缓解癫痫症状,还需要定位致痫灶并切除才能有效控制癫痫。本组病例中收集到8例海绵状血管瘤患者,均以癫痫起病,发病年龄1~29岁,病程2~24年,反复发作,口服药物难以控制,MRI均发现血管瘤。其中5例为首次接受手术,行病灶及致痫灶切除。术后随访0.5~7年,均达到EngelⅠ级。切除脑标本中可见同时伴发局灶性脑皮质发育不良(FCD),归为FCDⅢC型。还有3例患者在接受第一次手术切除病灶后未能有效控制癫痫,分别在术后1年、2年、6年再发癫痫,遂行致痫灶切除,镜下见残留病灶、胶质瘢痕和FCDⅢC,1例患者同时伴发海马硬化,诊为双重病理(dual pathology)[8];术后随访1年、3年、2年均EngelⅠ级。所以瘤周皮质构筑异常脑组织的切除对癫痫的控制至关重要,也提示伴难治性癫痫的CA患者海马也很可能成为重要的致痫灶。有研究提示传统手术仅切除肿瘤灶,预期达到63.6%的长期癫痫无发作率,而癫痫外科预期能达到100%的长期癫痫无发作率[7],对血管瘤旁皮质构筑异常脑组织位置及范围的准确术前评估是影响预后的重要原因。有学者认为脑海绵状血管瘤引起癫痫发作的主要原因是颅内出血释放的含铁血黄素沉积;瘤周脑组织供血、供氧异常;胶质的增生等[9, 10]。本组中首次手术和再次手术的病例,都出现畸形血管旁的FCD。FCD与难治性癫痫的关系非常密切,是导致难治性癫痫最常见病因之一[11]。结合本组病例,海绵状血管瘤伴难治性癫痫患者脑组织中局部血供异常导致的皮质发育不良是癫痫发作的主要原因。
SWS是一种少见的神经皮肤综合征,主要包括颜面部葡萄酒色血管瘤和软脑膜血管瘤病及眼脉络膜血管瘤[12]。临床表现中对患者影响最大的是癫痫发作,90%患者在婴幼儿期发作癫痫,经过长时期的口服抗癫痫药物治疗效果差,易出现耐药,多发展为难治性癫痫。Roach[13]在1992年将SWS分为3个类型:Ⅰ型(经典型),包括面部及软脑膜血管瘤病变;Ⅱ型(不全型),有颜面血管瘤、青光眼,但不存在软脑膜的病变;Ⅲ型(非经典型),只有软脑膜血管瘤病。因为同时具有三个部位的病变,Ⅰ型患者会存在癫痫、肢体偏瘫、先天性青光眼等临床表现。本组病例中6例为经典型(Ⅰ型),均出现癫痫、脑萎缩及青光眼,其中2例还同时伴智力发育减退,1例出现一侧肢体肌力减低;1例是非经典型(Ⅲ型),仅有癫痫发作。结合临床表现、影像改变及镜下特征(软脑膜血管瘤病及皮层内钙化),作出SWS的诊断是不困难的。但此种疾病较为少见,仍需与以下病变鉴别:(1)动静脉畸形:动静脉畸形的病变血管多位于大脑中动脉分布区,包括有静脉血管、小的动脉血管(管壁内可见弹力层),有时也可见扩张的薄壁血管,畸形血管间可见正常的脑组织。SWS患者颅内的病变位于蛛网膜下的软脑膜,常见大量扩张的缺乏平滑肌的薄壁血管形成海绵状血管瘤,也可见管壁较厚的静脉血管形成静脉性血管瘤;除了血管瘤的形成,通常伴有皮层钙化,钙化可以形成条带状,也可以在脑组织内弥漫分布,并累及大多数的脉管壁。(2)局灶性皮质发育不良(FCD)伴有明显扩张血管时: FCD患者临床长期癫痫发作,脑组织慢性缺血、缺氧,有时会出现皮层内小钙化灶。如果同时在蛛网膜下腔存在血管扩张淤血,有可能会误诊为SWS。但SWS患者常常伴随较有特征的临床表现及影像学改变,病理镜下软脑膜血管(薄壁血管及静脉型血管)异常增生形成血管瘤,范围广泛以致形成血管瘤病,血管壁增厚、钙化,血管腔淤血、有血栓形成,脑皮层内广泛的毛细血管壁增厚、纤维化及玻璃样变、钙化,脑组织内也有显著钙化灶形成。大脑皮层及血管壁较为广泛的钙化被认为是SWS特征性改变。本组7例病例脑组织标本均有钙化,以灰质为主,常常深入白质,钙化灶弥漫分布,异位灰质团中的钙化灶密度显著大于周围白质。在本组病例中还观察到脑实质内绝大多数小血管壁出现管壁全周的钙化。
SWS病因未明,可能为神经系统遗传性疾病,为胚胎发育4~8周时原始血管发育异常所致,脉管丛的退化失败引起所支配区域的血管病变,发育异常的程度与血管病变的分布范围及程度可能相关[14]。本组收集到的病例中有1病例(9岁男孩,1岁发病,双侧大脑病变,以左额、顶、颞为重,手术切除左额、顶、颞叶,术后随访2年,有两次发作),家族中其姐患有同种疾病;该病例大脑病损范围在本组病例中是最大的,病变几乎累及全脑。颅内病变程度是否与遗传学相关,并且在不同的SWS患者中遗传因素所起的作用是否也各不相同,尚需进一步研究。SWS患者癫痫发病时年龄较小,大部分在1岁以内,20岁以后发病者少见,容易进展为难治性癫痫。癫痫持续状态是本病致死的主要原因[15]。本组病例发病年龄均在1岁内。病程均较长,平均7年,属于难治性癫痫,手术范围为多脑叶或一侧半球,范围较广。癫痫发病年龄与SWS软脑膜血管瘤病的程度有关系,半球软脑膜血管瘤比局限的血管瘤更易进展为癫痫[16]。本组病例的发病与病损的关系与此观点一致。近年来对手术时间选择存在较大争议。有观点认为软脑膜血管瘤病及与SWS相关的FCD区域的完全切除可以使癫痫完全控制,年龄幼小时手术能给发育中的大脑更大的可塑性,有利于改善患儿生活质量[17-19]。本组病例手术年龄10岁以下5例,11岁1例,20岁1例;相对于手术预后来看手术年龄2岁者(此例患者近期MRI显示颅内异常血管团增多,不除外病变继续进展,可以认为手术未能完全切除病变血管瘤故手术效果较差)和11岁者术后疗效较差,其余病例预后均为良好;其中20岁1例患者为SWSⅢ型;在本组病例分析中可以认为SWSⅠ型患儿幼儿期接受血管瘤病病灶及致痫灶切除术后,手术效果良好,尽早手术有利于大脑功能的重建;SWSⅢ型患者青年期接受手术依然能达到良好的手术效果。
本组病例中脑海绵状血管瘤8例患者接受癫痫外科手术后随访效果良好,7例SWS患者中5例术后效果良好。所以,在这两种脑血管畸形患者出现难以控制的癫痫发作时,接受病灶和致痫灶完全切除的手术能有效控制临床症状,改善生活质量。
| [1] | 孙基栋, 王丹丹, 梁晖, 等. 难治性癫痫172例临床病例分析. 中华神经外科杂志 , 2010, 26 (6) : 494–496. |
| [2] | 朴月善, 陈莉, 付永娟, 等. 癫痫相关局灶性皮质发育不良的临床病理学研究. 中华病理学杂志 , 2007, 36 (3) : 150–154. |
| [3] | 卢德宏, 陈莉, 朴月善. 重视难治性癫痫的神经病理学研究. 中华病理学杂志 , 2007, 36 (3) : 147–149. |
| [4] | Blǔmcke I, Thom M, Aronica E, et al. The clinicopathologic spectrum of focal cortical dysplasias a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission. Epilepsia , 2011, 52 (1) : 158–174. DOI:10.1111/epi.2011.52.issue-1 |
| [5] | Batra S, Lin D, Recions PF, et al. Cavernous malformations natural history, diagnosis and treatment. Nat Rev Neurol , 2009, 5 (12) : 659–670. DOI:10.1038/nrneurol.2009.177 |
| [6] | Seker A, Pricola KL, Guclu B, et al. CCM2 expression parallelsthat of CCM1. Stroke , 2006, 37 (2) : 518–523. DOI:10.1161/01.STR.0000198835.49387.25 |
| [7] | 郑宇新.伴癫痫的颞叶海绵状血管瘤的手术治疗.杭州:浙江大学, 2015. |
| [8] | Blǔmcke I, Mǔhlebner A. Neuropathological work-up of focal cortical dysplasias using the new ILAE consensus classification system-practical guideline article invited by the Euro-CNS Research Committee. Clin Neuropathol , 2011, 30 (4) : 164–177. |
| [9] | 王振忠, 诸葛启钏, 叶盛, 等. 幕上与癫痫有关的海绵状血管瘤的显微外科治疗. 中华神经外科杂志 , 2008, 24 (8) : 593–596. |
| [10] | 王夫来, 王秋寒, 金澎. 以癫痫为首发症状的颅内海绵状血管瘤显微外科治疗(附30例临床分析). 立体定向和功能性神经外科杂志 , 2014, 27 (4) : 208–211. |
| [11] | Barkovich AJ, Guerrini R, Kuzniecky RI, et al. A developmental and genetic classification for malformation of cortical development:update 2012. Brain , 2012, 135 (5) : 1348–1368. DOI:10.1093/brain/aws019 |
| [12] | Dorairaj S, Ritch R. Encep halotrigeminal angiomatosis(Sturge-Weber syndrome, Kl ippel-Trenaunay-Weber syndrome):a review. Asia Pac J Ophthalmol , 2012, 1 (4) : 226–234. DOI:10.1097/APO.0b013e31826080a9 |
| [13] | Roach ES. Neurocutaneous syndromes. Pediatr Clin North Am , 1992, 39 (4) : 591–620. DOI:10.1016/S0031-3955(16)38367-5 |
| [14] | Maiuri F, Gangemi M, Iaconetta G, et al. Sturge-Weber disease without facial nevus. J Neurosurg Sci , 1989, 33 (2) : 215–218. |
| [15] | 周琴, 郑家伟. Sturge-Weber综合征研究进展. 中国口腔颌面外科杂志 , 2008, 6 (3) : 221–226. |
| [16] | Fogarasi A, Loddenkemper T, Mellado C, et al. Sturge-Weber syndrome:clinical and radiological correlates in 86 patients. Ideggyogy Sz , 2013, 66 (1-2) : 53–57. |
| [17] | Wiebe S, Berg AT. Big epilepsy surgery for little people:what's the full story on hemispherectomy. Neurology , 2013, 80 (3) : 232–233. DOI:10.1212/WNL.0b013e31827dec32 |
| [18] | Sugano H, Nakanishi H, Nakajima M. Posterior quadrant disconnection surgery for Sturge-Weber syndrome. Epilepsia , 2014, 55 (5) : 683–689. DOI:10.1111/epi.2014.55.issue-5 |
| [19] | Wang DD, Blümcke I, Coras R, et al. Sturge-Weber Syndrome Is Associated with Cortical Dysplasia ILAE Type IIIc and Excessive Hypertrophic Pyramidal Neurons in Brain Resections for Intractable Epilepsy. Brain Pathol , 2015, 25 (3) : 248–255. DOI:10.1111/bpa.2015.25.issue-3 |
 2016, Vol. 43
2016, Vol. 43


