扩展功能
文章信息
- 王荣美, 李玲
- 急性颅脑损伤动物模型的研究进展
- 国际神经病学神经外科学杂志, 2016, 43(3): 258-263
-
文章历史
收稿日期: 2016-02-28
修回日期: 2016-06-14
急性颅脑损伤(acute brain injury,ABI)因其发病率高、致死致残率高、医护费用高等特点,近几十年已成为全球关注的严重的公共卫生问题之一[1-3]。因此,深入认识和了解ABI的发病机制,提高颅脑损伤的研究水平,对社会和医学具有重要意义。
根据致伤因素和致伤方式可将ABI分为直接暴力和间接暴力两种形式。直接暴力包括加速性损伤、减速性损伤和挤压性损伤。间接暴力包括挥鞭样损伤、颅脊联合损伤及创伤性窒息。另外,爆炸冲击波致颅脑损伤是特殊的损伤形式。动物模型的建立是ABI研究的基础。几十年来,广大学者探索出多种ABI动物模型,但是关于挤压性损伤和颅脊联合伤的动物模型鲜有报道。本文主要针对常见的加速性损伤、减速性损伤、挥鞭样损伤、创伤性窒息及爆炸伤的动物模型的致伤机制和制备方法进行简要综述。
1 加速性脑损伤相对静止的头颅突然被运动的物体打击,致使头部由静止状态转变为快速朝着外力作用的方向运动所造成的脑损伤,称为加速性脑损伤(acceleration injury)。在这种受力的方式下,暴力可以使着力点处的头皮、颅骨和脑组织产生损伤,而暴力作用的对侧,脑组织因惯性作用冲撞在颅腔的内壁上,引起对冲性损伤。
关于加速性脑损伤模型的报道较为常见,主要包括以下几种动物模型。
1.1 落体打击模型落体打击模型(weight-drop models) 是一种传统的造模方法,通过垂直下落的重物打击到暴露的颅骨或者硬脑膜上形成闭合性脑损伤,多用于复制脑震荡模型和局灶性脑损伤模型。
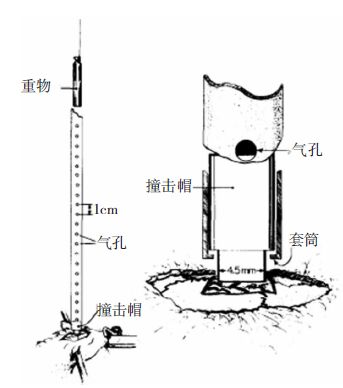
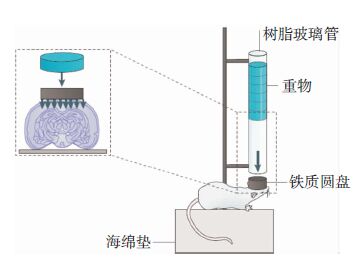
1981年Feeney等构建了大鼠脑皮质挫伤模型(图 1)[4]。具体方法:实验大鼠麻醉后切开头皮,暴露颅骨,在右顶部磨开一直径0.5 cm的圆形骨窗,保持硬脑膜完整。实验时,将动物呈俯卧状固定在平台上,通过调节撞击锤的重量和下落的高度来复制不同程度的脑皮质挫伤模型。击锤重量分别为20 g、40 g,按照击锤重量乘以下落高度得到的值划分不同程度损伤组。伤后24h观察发现,轻度或中度损伤(200或600g/cm)局部脑膜血管充血明显,多无明显脑裂伤,重度损伤(1000g/cm)出现脑局灶性挫裂伤,皮质下区空洞,脑体积增大的现象。1994年,Marmarou等[5]用落体打击法制作了大鼠弥漫性ABI模型(图 2[1])。与Feeney的方法相比,改进之处:一是将大鼠俯卧于弹性海绵垫上,确保外力作用的瞬时性。二是在颅顶骨表面固定一枚金属圆盘(直径1cm,厚0.3cm),保证了外力作用的弥漫性。这两方面改进使得该模型不仅能模仿脑皮质的损伤,还能够更好地模仿脑外伤中发生的撞击和震荡。
|
| 图 1 Feeney落体打击模型装置。重物导管下落到底部,产生的压力经过导管底部的圆柱形撞击帽打击到实验动物的硬脑膜上,形成局灶性脑损伤。 |
|
| 图 2 Marmarou落体打击模型装置。实验动物底部放置海绵或者泡沫,以增加重力的缓冲作用。头部固定金属圆盘,重物下落时打击到金属圆盘上,可以增强外力作用的弥散性。 |
总之,落体打击模型操作简单,易于控制,可制备分级脑损伤;实验可重复性好;成本低。但动物脑损伤死亡率较高,稳定性差。
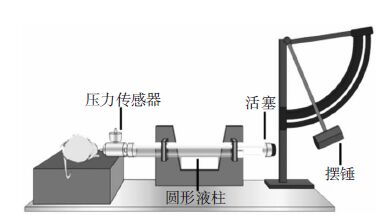
1.2 液压冲击损伤模型液压冲击模型(fluid percussion injury,FPI)以其有效性、可靠性及临床相关性,现已经成为ABI最广泛的实用动物模型(图 3[6])。根据颅骨钻孔的位置不同,FPI模型可分为正中液压模型(middle fluid percussion injury,MFPI,骨窗位于前卤和人字缝中间)和侧方液压模型(lateral fluid percussion injury,LFPI,骨窗位于矢状缝一侧)。前者可以模拟局灶性损伤和脑挫裂伤,后者则兼具局灶性损伤和弥漫性损伤的特点[7]。1987年Dixon等[8]首次制作了大鼠正中液压模型。模型装置由圆形液柱、打击架、示波器及压力传感器构成。实验以1.5~2.0atm峰值冲击压力,平均时程23ms,对大鼠颅脑造成损伤。LFPI主要用于啮齿动物[9, 10]。实验对象以大鼠为主,也有人用于其它动物。Stuart等[11]以小型猪为研究对象,分别给予0.4atm和1.0atm压力制作轻度脑损伤模型和重度脑损伤模型,发现伤后24h内前者脑血流量呈焦点变化,而后者变化较为分散。
|
| 图 3 液体冲击损伤模型装置图。通过摆锤打击圆形液柱的传感活塞,将液体压力传递于脑组织,造成脑组织的短暂位移变形,调节摆锤下降的高度来调节脉冲压力的强度,进而调节损伤的严重程度。 |
简言之,该模型优点:致伤力准确、重复性好,适用于多种动物模型。缺点:损伤参数不稳定,打击强度不精确,死亡率较高。
1.3 控制性脑皮质撞击模型控制性脑皮质撞击模型(controlled cordical impact models,CCI)被称为精确的模型[12],近几年在临床研究中较为常见。控制性脑皮质撞击仪(图 4[13])是精密的仪器,打击强度精确、稳定、可靠。模型可调控的参数包括撞击停留时间、打击速度及打击深度三项。有研究报道,美国研究者[14]以12只小型猪为实验对象,以打击深度1.1cm,打击速度350cm/sec,停留时间400msec为造模参数,复制局灶性脑损伤模型。伤后10h发现肉眼可见皮质挫伤的现象。总体来说,与其它ABI模型比较,该模型的优点在于改善了机械因素,能够有效控制气动装置的参数,因此,造模的稳定性及可控性较好。存在的问题是设备昂贵,实验精度要求较高。

|
| 图 4 控制性皮质撞击模型装置图。将实验动物固定在框架中,采用气动冲击装置驱动的打击器,冲击暴露的完整的硬脑膜下的脑皮质造成损伤。通过控制打击器的打击速率、打击深度和停留时间调节损伤的严重程度。 |
减速性脑损伤(deceleration injury)是指运动着的头颅突然碰撞在外物上,迫使其瞬间由动态转为静态后造成的颅脑损伤。在颅骨停止运动的瞬间,脑因惯性作用仍继续向前运动,着力点处脑表面与颅骨内板相冲撞造成冲击点伤;对冲部位的脑底面与颅前窝和颅中窝底凹凸不平的骨嵴相摩擦,脑表面与骨突起部分冲撞,产生对冲性脑损伤。
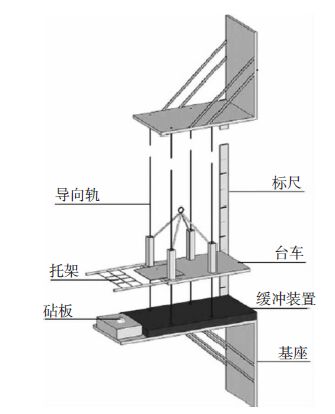
国内外研究中关于颅脑减速伤实验研究的文献报道明显少于颅脑加速伤。一方面由于颅脑减速伤的危害未引起广泛注意,另一方面因为颅脑减速伤实验方法困难、操作难于实施。2011年,有研究者[15]利用如图(图 5)所示装置制备家兔减速性脑损伤模型。装置根据势能与动能转化原理来获得初速度,实验动物的初速度由坠落高度来进行控制。实验时,家兔以仰卧姿态被固定在台车上,用支架托起头部,使兔颅顶部对准砧板,将台车分别从标尺处的250cm、350cm和700cm 位置坠落,对家兔大脑进行致伤。伤后CT影像均可见颅骨骨折、脑挫裂伤和颅内积气等现象。
|
| 图 5 减速性损伤模型装置图。实验动物以仰卧姿态固定在台车上,用支架托起头部,对准砧板,将台车分别从高处位置坠落,形成颅脑致伤。 |
脑挥鞭样损伤(whiplash injury)是指行车或运动中外力突然从身后冲撞躯体,在躯体骤然前冲和停止的过程中,由于惯性的关系头部先向后过伸、继而又向前过屈,使头部有如挥鞭样运动造成的损伤。
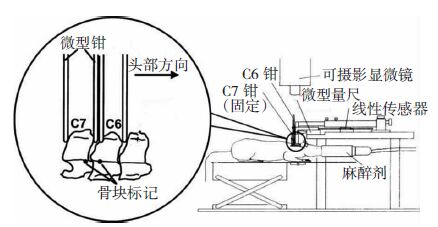
动物模型早期以猴、黑猩猩等灵长类动物为主,近年来以大鼠等小动物为主。模型装置[16]主要由显微镜、传感器、微型钳、骨块标志构成(图 6)。实验前暴露动物颈部C6/C7关节面,使其位于显微镜正下方。固定C7骨块,由传感器牵拉C6骨块,间隔一定时间后自动恢复原来位置。显微镜上的高速摄像机记录整个过程,并记录骨孔标记的位置以计算移动间距。Julia等[17]以雄性大鼠制备了这一模型,实验参数为速度1.5cm/s,位移0.017±0.001cm,间隔10s,发现挥鞭样损伤的机制与局部神经损伤、细胞因子等有关。
|
| 图 6 脑挥鞭样损伤模型装置。通过微型钳牵拉C6骨块产生头颈屈伸运动,制备挥鞭样损伤。由线性传感器和骨块标记记录C6骨块位移。 |
此模型模拟了临床上脊髓损伤的致伤条件和受伤机制,实现了水平方向上的脊髓牵拉损伤。模型制作的关键是控制牵拉比率的精确性。
4 创伤性窒息创伤性窒息(traumatic asphyxia,TA),又叫胸部挤压伤综合征,是一种由强力挤压胸部或上腹部引起的特有损伤,往往发生于地震、交通事故、人群挤压等。引起脑损伤的因素主要在于两方面:一是强大的压力通过血液循环传递至脑内血管,致脑微血管破裂;二是胸部挤压后造成窒息,引起缺氧,致使脑功能障碍、脑室出血[18, 19]。
据报道,创伤性窒息模型装置多应用电子化设备(图 7[20])。刘洁等[21]用大鼠制备创伤性窒息模型。将麻醉的大鼠呈仰卧状放置在设备平台上,经口气管插管,多导生理监护仪监护,调节挤压滑块压力和升降杆,将实验动物8倍体重的重量压在大鼠的胸部,呼吸先停止,继而血压降为0,心电图成一直线,5分钟后去除重压复苏。伤后检测发现大鼠血-脑脊液屏障破坏,海马CA1区神经元发生了缺血性改变。

|
| 图 7 创伤性窒息模型装置图。实验动物置于基底平台,通过调节电子键盘控制挤压滑块压力对动物造成胸部挤压。 |
这一模型操作简单,量化清晰,实用性强,评价较好。不足之处是设备成本高,环境模拟水平有待提高。
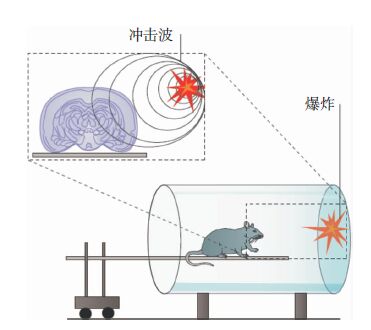
5 爆炸伤模型颅脑爆炸伤(blast injury)在战时常集中发生。其急性期病理现象主要表现在三个方面:投射物直接造成的原发伤、脑挫裂伤和脑震荡[22]。颅脑爆炸伤模型对研究现代战争中各种爆炸性武器爆炸后产生的弹片和碎片所致脑损伤具有重要价值(图 8[1])。
|
| 图 8 爆炸伤模型装置。由爆炸引起的冲击波导致实验动物头部受到创伤,通过调节爆炸源强度、距离来改变冲击波大小,从而控制损伤的严重程度。 |
据报道,Nihal等[23]以约克郡小型猪为研究对象,通过引燃爆震管分别模拟空地、车厢、建筑物环境下的爆炸场景。三种场景下分别给予冲击波压力:空地35kPa、车厢37kPa,建筑物65kPa,成功制备了轻型爆炸伤模型。该模型致伤因素单纯,可模拟不同程度的颅脑爆炸伤损伤。但是大多数可用的爆炸伤模型侧重于组织的破坏而非功能缺损。因此,进一步设计相关标准的爆炸伤ABI模型是阐明爆炸致脑损伤机制的重点。
6 结论在现实生活中ABI的发生多有不可预见性,因此创伤性脑损伤模型的基本要求是具有较好的标准化、可调控性、可操作性与可重复性。标准化包括不同动物颅脑损伤的标准,动物颅脑损伤分类的划分标准、以及打击方法的标准化;可调控性是指可根据实际需要调整损伤强度,制作出不同损伤程度的脑损伤模型;可操作性与可重复性是指对脑损伤模型制作的各关键步骤客观化、定量化,使其可信度高、可实施性强,能反映客观问题且损伤机制与临床实际相接近[24, 25]。当前,多种ABI动物模型广泛应用,但是由于动物和人体之间,生理上的差异、短期实验的局限性及评价体系不完善等方面的原因,动物模型仍然不能完全复制人类ABI。因此,需要进一步结合临床,开发相关的创新模型,对已建立的模型进行改进和功能测试,从而为进一步深入研究ABI的发病机制,提高ABI的研究水平奠定重要的基础。
| [1] | Mauro O, Ilaria AC, Sangeeta M, et al. Optimizing sedation in patients with acute brain injury. Intensive Care Med Exp , 2016, 20 (128) : 1–11. |
| [2] | Gao J, Zheng Z. Development of prognostic models for patients with traumatic brain injury:a systematic review. Int J Clin Exp Med , 2015, 8 (11) : 19881–19885. |
| [3] | 邱健, 邝芳. 低温治疗脑损伤引起的生理病理变化研究进展. 国际神经病学神经外科学杂志 , 2015, 42 (5) : 446–449. |
| [4] | Feeney D, Boyeson M, Linn R, et al. Responses to cortical injury:I. Methodology and local effects of contusions in the rat. Brain Res , 1981, 211 (1) : 67–77. DOI:10.1016/0006-8993(81)90067-6 |
| [5] | Marmarou A, Foda M, Vanden B, et al. A new model of diffuse brain injury in rats. Part I:Pathophysiology and biomechanics. J Neurosurg , 1994, 80 (2) : 291–300. DOI:10.3171/jns.1994.80.2.0291 |
| [6] | Osier N, Carlson S, DeSana A, et al. Chronic Histopathological and Behavioral Outcomes of Experimental Traumatic Brain Injury in Adult Male Animals. J Neurotrauma , 2015, 32 (23) : 1861–1882. DOI:10.1089/neu.2014.3680 |
| [7] | Smith C, Xiong G, Elkind J, et al. Brain Injury Impairs Working Memory and Prefrontal Circuit Function. Front Neurol , 2015, 6 : 1–11. |
| [8] | Dixon C, Lyeth B, Povlishock J, et al. A fluid percussion model of experimental brain injury in the rat. J Neurosurg , 1987, 67 (1) : 110–119. DOI:10.3171/jns.1987.67.1.0110 |
| [9] | Lu H, Kobilo T, Robertson C, et al. Transcranial magnetic stimulation facilitates neurorehabilitation after pediatric traumatic brain injury. Sci Rep , 2015, 5 : 1–11. |
| [10] | Palmer C, Metheny H, Elkind J, et al. Diminished amygdala activation and behavioral threat response following traumatic brain injury. Exp Neurol , 2016, 277 : 215–226. DOI:10.1016/j.expneurol.2016.01.004 |
| [11] | Friess S, Ichord R, Owens K, et al. Neurobehavioral functional deficits following closed head injury in the neonatal pig. Exp Neurol , 2007, 204 (1) : 234–243. DOI:10.1016/j.expneurol.2006.10.010 |
| [12] | Armstead W, Riley J, Cines D, et al. Combination therapy with glucagon and a novel plasminogen activator inhibitor-1-derived peptide enhances protection against impaired cerebrovasodilation during hypotension after traumatic brain injury through inhibition of ERK and JNK MAPK. Neurol Res , 2012, 34 (6) : 530–537. DOI:10.1179/1743132812Y.0000000039 |
| [13] | Osier N, Korpon J, Dixon C. Frontiers in Neuroengineering, Controlled Cortical Impact Model. In:Kobeissy FH, eds. Brain Neurotrauma:Molecular, Neuropsychological, and Rehabilitation Aspects. Boca Raton:Taylor & Francis , 2015 . |
| [14] | Hawryluk GW, Phan N, Ferguson AR, et al. Brain tissue oxygen tension and its response to physiological manipulations:influence of distance from injury site in a swine model of traumatic brain injury. J Neurosurg , 2016 : 1–12. |
| [15] | Chen R, Zhang SX, Zhao H, et al. Noncontrast and perfusion CT provides accurate assessment of head deceleration injury. Turk Neurosurgery , 2011, 21 (2) : 127–134. |
| [16] | Kathryn E, John H, David S, et al. A novel rodent neck pain model of facet-mediated behavioral hypersensitivity:implications for persistent pain and whiplash injury. J Neurosci Methods , 2004, 137 : 151–159. DOI:10.1016/j.jneumeth.2004.02.021 |
| [17] | Nadine M, Kristen J, Beth A. Impaired performance on the angle board test is induced in a model of painful whiplash injury but Is only transient in a model of cervical radiculopathy. J Orthopaedical Res , 2011, 29 : 562–566. DOI:10.1002/jor.v29.4 |
| [18] | Bajwa N, Halavi S, Hamer M, et al. Mild Concussion, but Not Moderate Traumatic Brain Injury, Is Associated with Long-Term Depression-Like Phenotype in Mice. PLoS One , 2016, 11 (1) : 1–19. |
| [19] | Jose A, Jorge A, Jaqueline A, et al. Periodic acceleration (pGz) CPR in a swine model of asphyxia induced cardiac arrest Short-term hemodynamic comparisons. Resuscitation , 2008, 77 (1) : 132–138. DOI:10.1016/j.resuscitation.2007.10.018 |
| [20] | Song J, Ding H, Fan HJ, et al. Canine model of crush syndrome established by a digital crush injury device platform. Int J Clin Exp Pathol , 2015, 8 (6) : 6117–6125. |
| [21] | Liu J, Wang Y, Zhuang Q, et al. Protective effects of cyclosporine A and hypothermia on neuronal mitochondria in a rat asphyxial cardiac arrest model. Am J of Emerg Med , 2016, 34 (6) : 1080–1085. DOI:10.1016/j.ajem.2016.02.066 |
| [22] | Przekwas A, Somayaji M, Gupta R. Synaptic Mechanisms of Blast-Induced Brain Injury. Front Neuro , 2016, 7 : 1–11. |
| [23] | Reiner A, Heldt S, Presley C, et al. Motor, visual and emotional deficits in mice after closed-head mild traumatic brain injury are alleviated by the novel CB2 inverse agonist SMM-189. Int J Mol Sci , 2015, 16 (1) : 1–12. |
| [24] | Morries LD, Cassano P, Henderson TA. Treatments for traumatic brain injury with emphasis on transcranial near-infrared laser phototherapy. Neuropsychiatr Dis Treat , 2015, 11 : 2159–2175. |
| [25] | Peng W, Sun J, Sheng C, et al. Systematic review and meta-analysis of efficacy of mesenchymal stem cells on locomotor recovery in animal models of traumatic brain injury. Stem Cell Res Ther , 2015, 6 : 1–15. DOI:10.1186/scrt535 |
 2016, Vol. 43
2016, Vol. 43



