扩展功能
文章信息
- 孙红军, 荔志云
- SUN Hong-jun, LI Zhi-yun
- 不同无血清培养方式提取SHG44人脑胶质瘤干细胞的比较研究
- Comparison of different culture methods for SHG44 human brain glioma stem cells with serum-free medium
- 国际神经病学神经外科学杂志, 2016, 43(3): 193-197
- Journal of International Neurology and Neurosurgery, 2016, 43(3): 193-197
-
文章历史
收稿日期: 2016-01-04
修回日期: 2016-06-12
胶质瘤干细胞具有自我更新、无限增殖、致瘤的能力,可分化为神经元、星形胶质细胞、少突胶质细胞及小胶质细胞,具有天然耐药、抗拒放化疗的特性。目前恶性胶质瘤患者的标准治疗方案包括最大程度手术切除联合放疗及烷化剂辅助化疗,但效果仍不佳[1]。其中胶质瘤细胞耐化疗是治疗失败的关键,且胶质瘤干细胞可表达多种ABC转运蛋白,特别是BCRP及Pgp,可将抗肿瘤药物等泵出细胞外,逃逸抗肿瘤药物的损伤[2],这可能是胶质瘤存在内在耐药性及易复发的重要原因。因此胶质瘤干细胞耐药机制及新型靶向抗癌剂的研究成为胶质瘤研究的重要内容。目前针对胶质瘤干细胞的筛选方法较多,主要包括流式细胞仪分选法、免疫磁珠法、无血清纯化法等,但由于流式细胞仪分选法及免疫磁珠法对仪器性能、操作要求高,筛选量少,且筛选出的干细胞在较短时间内分化。因此,寻求更可靠、更有效、更方便的分离培养方法成为了肿瘤干细胞研究的主要课题之一。目前应用最广泛的肿瘤干细胞技术是干细胞无血清富集法[3],但不同的无血清载体在提取胶质瘤干细胞时,其胶质瘤干细胞球呈现出不同变化。我们通过实验摸索和总结,建立了一套有效且简易胶质瘤干细胞分离技术,可高效扩增胶质瘤干细胞,对进一步研究脑肿瘤的发生和发展有重要意义。
1 材料与方法 1.1 材料人脑胶质瘤SHG44细胞系来自ATCC(美国组织培养保藏中心),由上海生物细胞所提供;胎牛血清(Hyclone公司);胰蛋白酶(Sigma公司);DMEM培养基(Gibco公司);DMEM/F12(1∶1)培养基(Gibco公司);B27 添加剂、重组人表皮生长因子(EGF)、重组人碱性成纤维生长因子(bFGF)均购自Invitrogen公司;小鼠抗人Nestin抗体(Abcam公司);兔抗人CD133抗体(Abnova公司);兔抗人Bcl-2抗体(Abcam公司);FITC标记的山羊抗兔二抗(Abcam公司);PE标记的兔抗小鼠二抗(Abcam公司);免疫染色封闭液(碧云天生物科技研究所);抗荧光淬灭封片液(碧云天生物科技研究所);60 mm细胞培养皿(康宁公司);25 cm2细胞培养瓶(Corning公司);悬浮细胞培养板6孔(Cyagen公司)。
1.2 方法 1.2.1 无血清DMEM/F12(1∶1)培养基配制DMEM/F12(1∶1)培养基100 mL,Human FGF-basic终浓度为20 μg/L,Human EGF终浓度为20 μg/L,B27 Supplement(50×)2 mL,双抗溶液100 μL,于4℃保存。
1.2.2 人脑胶质瘤SHG44细胞在含血清培养基中常规培养人脑胶质瘤SHG44细胞以105个/mL接种于含10%胎牛血清高糖型DMEM培养基中。于37℃、5%CO2、100%湿度培养箱中培养,每2~3 d换液一次。待细胞长满培养皿底约80%时传代。
1.2.3 采用不同无血清载体悬浮培养人脑胶质瘤SHG44干细胞将培养在含10%胎牛血清的高糖型DMEM培养基中的对数生长期的SHG44胶质瘤细胞,弃去培养液,0.25%胰蛋白酶2 mL置于100 mm培养皿中消化约1 min,用无血清神经干细胞培养基DMEM/F12(内含2%B27、EGF 20 μg/L、bFGF 20 μg/L)培养终止消化,将其移至15 mL离心管中,反复吹打成单细胞悬液。1500 rpm 离心8 min。弃去上清液,加入5 mL无血清神经干细胞培养液洗涤沉淀,1500 rpm 离心5 min。弃去上清液,无血清神经干细胞培养液再次悬浮沉淀,形成1 × 104 个细胞/ml 的悬浮细胞液。取其1 mL接种于悬浮细胞六孔板,加入1 mL无血清培养基,每天添加400 μL培养基;取其3 mL接种于60 cm2培养皿中,加入3 mL无血清培养基,每天添加1.2 mL培养基;取其2.6 mL接种于25 cm2细胞培养瓶。倒置显微镜下动态观察细胞生长及胶质瘤干细胞球形成情况,每种载体选用3个不同的细胞标本,每个标本随机选取任意5个视野,计数克隆球数量并拍照(×100),做定量分析。
1.2.4 免疫荧光染色鉴定胶质瘤干细胞球取活力良好的胶质瘤干细胞球,接种于经多聚赖氨酸包被的玻片上,37℃晾干,PBS 漂洗3×5 min,室温4%多聚甲醛固定15 min,弃去多聚甲醛,PBS漂洗3×5 min,0.5%TritonX-100 37℃透膜10 min;加免疫染色封闭液,室温孵育30 min;滴加稀释好的一抗:CD133 (1∶200),Nestin (1∶200),Bcl-2(1∶100)放入湿盒4℃孵育过夜。弃去一抗孵育液,PBS漂洗3×5 min,加1∶100稀释的PE标记的兔抗小鼠二抗及1∶1000稀释的FITC标记的山羊抗兔二抗,37℃孵育40 min;PBS漂洗3×5 min;4’,6 二脒基-2-苯吲哚盐酸(4 ’,6-diamidino-2-phenylindole,DAPI) 封片,荧光显微镜下观察并拍照。
1.3 统计分析使用SPSS 19.0软件进行统计分析,胶质瘤干细胞球的直径d、数目用均数 标准差(x±s)表示,采用方差分析比较并生成柱形图,设置P<0.05为有统计学意义。
2 结果 2.1 人脑胶质瘤SHG44干细胞在不同无血清载体中的悬浮培养将含血清培养基条件下培养的生长良好的SHG44细胞接种到无血清的神经干细胞培养基中,培养皿和培养瓶:1 d后部分细胞开始贴壁生长,3 d后开始有少量细胞克隆球形成,且球体逐渐增大,至7 d左右克隆球体积基本停滞,此即为胶质瘤干细胞(图 1A1,B1);悬浮细胞六孔板:细胞呈悬浮状生长,第3天开始细胞克隆球形成,并逐渐增大,至7天左右,克隆球生长基本停滞(图 1C1)。收集不同载体内的悬浮克隆球,离心后弃去培养液,加入胰酶消化约5 min,加无血清培养基终止消化、重悬并吹打至单个细胞,1500 rpm 离心8 min,弃去上清液;加入无血清液悬浮洗涤细胞,1500 rpm 离心5 min,弃去上清液;无血清干细胞培养液再次悬浮细胞后分别接种于培养皿、培养瓶和悬浮细胞培养板中,培养皿和培养瓶:1 d后细胞呈不规则分化状生长,3 d后细胞克隆球开始形成,至7天左右细胞克隆球呈分散、较小、不规则形生长(图 1A2,B2);悬浮细胞六孔板:细胞呈类圆形,第3天细胞球开始形成,至7天左右细胞克隆球呈较大规则球形生长细胞呈悬浮状生长,克隆球生长基本停滞(图 1C2)。同样方法经第3次纯化:对于培养皿和培养瓶,第三次比第一、二次有更少的胶质瘤干细胞球却呈更规则球形生长,更多呈分化状生长(图 1A3,B3);对于悬浮细胞培养板,第三次比第一、二次纯化的干细胞球呈更大更规则球形生长(图 1C3)。不同无血清培养基载体来源的胶质瘤干细胞球,生长情况有差别。第二次纯化开始,随纯化次数增加悬浮培养板培养纯化的胶质瘤干细胞球较培养皿和培养瓶纯化的胶质瘤干细胞球大且数目多(图 2);对于悬浮培养板,随着纯化次数增加,胶质瘤干细胞球更大、数目更多(图 2),且呈更规则球形。
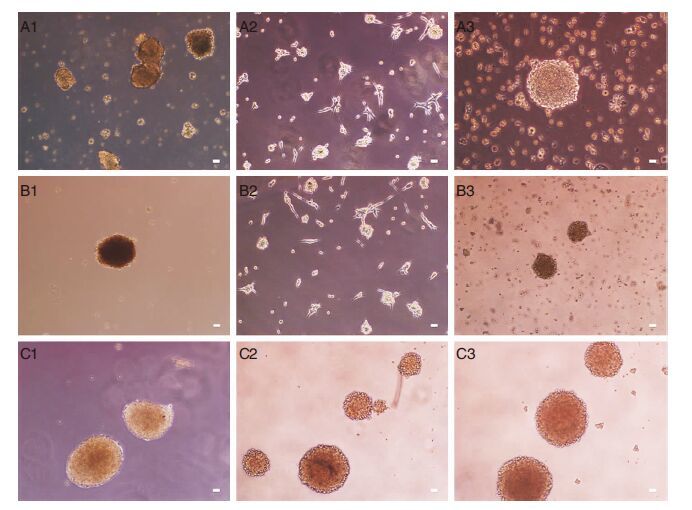
|
| 图 1 不同无血清培养方式中胶质瘤干细胞球(倒置显微镜下,×100)。A1、A2、A3分别为培养瓶第1次、第2次及第3次提取纯化的胶质瘤干细胞;B1、B2、B3分别为培养皿第1次、第2次及第3次提取纯化的胶质瘤干细胞;C1、C2、C3分别为Cyagen悬浮细胞培养板第1次、第2次及第3次提取纯化的胶质瘤干细胞.比例尺:10 mm=50 μm |
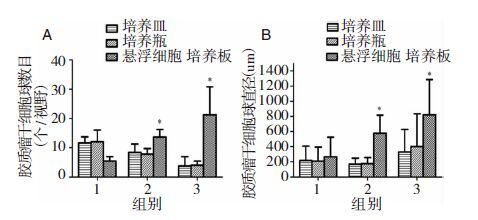
|
| 图 2 不同无血清培养方式中胶质瘤干细胞球的数目及直径。1.第1次纯化;2.第2次纯化;3.第3次纯化。 |
免疫荧光染色后,荧光显微镜下观察胶质瘤干细胞球的干细胞标记物CD133、Nestin表达呈阳性(图 3),且癌基因Bcl-2表达呈阳性(图 4),其中FITC标记二抗呈绿色,PE标记二抗呈红色,DAPI染核呈蓝色。证实胶质瘤球细胞表达CD133、Nestin和Bcl-2,具有胶质瘤干细胞特点。
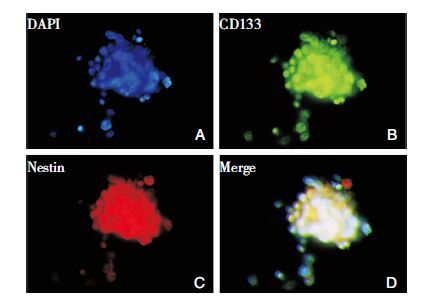
|
| 图 3 胶质瘤干细胞球表达特异标记物 Nestin、CD133 (× 200)。A:DAPI染核呈蓝色;B: 胶质瘤干细胞球Nestin呈阳性表(红色);C:胶质瘤干细胞球CD133呈阳性表达(绿色);D:融合后的胶质瘤干细胞球。 |
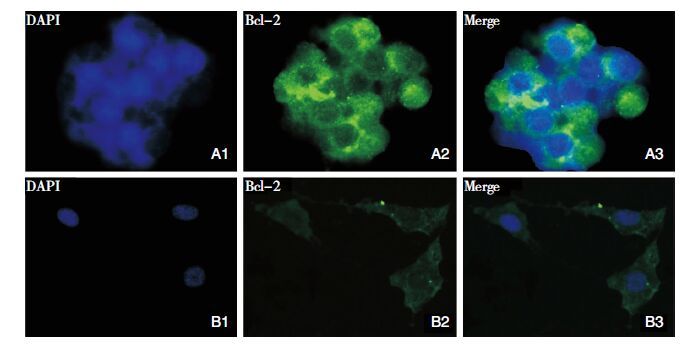
|
| 图 4 SHG44胶质瘤细胞及其干细胞Bcl-2的表达情况。A1、A2、A3(IHC,×400):A1.SHG44胶质瘤干细胞细胞核,呈类圆形;A2.SHG44胶质瘤干细胞膜、胞内Bcl-2呈弥漫性分布;A3为A1和A2的合成图;B1、B2、B3(IHC,×400):B1.SHG44胶质瘤细胞核,呈类椭圆形;B2.SHG44胶质瘤细胞膜、胞内Bcl-2呈个别散在分布;B3为B1和B2的合成图。 |
胶质瘤是成人最常见的原发性脑肿瘤[4],约占全部颅内肿瘤的45%~55%[5],其中胶质母细胞瘤(Glioblastoma,GBM),约占原发性脑肿瘤的16%[6],中位生存期为9~12个月[7]。目前GBM标准治疗方案是最大程度手术切除联合放疗及烷化剂辅助化疗。然而GBM 5年存活率仍低于10%[8],总体中位生存期为14.6个月[8]。究其原因主要是胶质瘤细胞的分子异质性大,导致耐化疗和抗拒放疗,并且胶质瘤干细胞是胶质瘤耐药、抗拒放疗、复发的根源。胶质瘤病理级别越高,其胶质瘤干细胞含量越高。对于同一级别胶质瘤组织中胶质瘤干细胞数量和增殖存在差异,可能是由于肿瘤异质性所致。因此,胶质瘤干细胞的鉴定可为胶质瘤的监测和诊断提供重要标志物。而且,针对它进行适当的药物及生物免疫治疗,可能具有决定性的意义。
基于胶质瘤干细胞的研究现状,本实验首先通过含10%胎牛血清的高糖型DMEM培养基培养SHG44胶质瘤细胞至对数生长期,继而以培养皿、培养瓶及六孔悬浮细胞培养板为载体,用无血清培养基进行培养获得胶质瘤干细胞球,这些神经球失去了胶质瘤细胞贴壁生长的特点,呈球形悬浮状生长,不同载体中胶质瘤干细胞球的形状、大小无明显差别,但培养皿和培养瓶培养的胶质瘤干细胞球呈暗绿色,悬浮细胞培养板培养的胶质瘤干细胞球呈透明状;经第2、3次纯化后,培养皿和培养瓶中胶质瘤干细胞球呈分散、较小、不规则形生长;悬浮细胞六孔板中细胞呈较大规则球形、悬浮状生长。以上现象可能是由于普通培养皿和培养瓶适用于培养贴壁细胞、具有诱导胶质瘤干细胞分化的作用,Cyagen悬浮细胞培养板适用于悬浮细胞,尤其是肿瘤干细胞的培养,且肿瘤干细胞能连续传代,不断自我更新和增殖但不分化;CD133联合Nestin标记进行免疫荧光鉴定,呈阳性表达,证实此类神经球具有干细胞的特性;另外,Bcl-2癌基因呈阳性表达,说明此类神经球具有癌细胞特征。
综上所述,本研究证明Cyagen 6孔悬浮细胞培养板是培养胶质瘤干细胞较理想的载体,能简易、高效地扩增胶质瘤干细胞,为下一步研究奠定了基础,对进一步研究脑肿瘤的发生、发展及药物筛选有很重要的意义。
| [1] | Clarke J, Penas C, Pastori C, et al. Epigenetic pathways and glioblastoma treatment. Epigenetics , 2013, 8 (8) : 785–795. DOI:10.4161/epi.25440 |
| [2] | Li XT, Ju RJ, Li XY, et al. Multifunctional targeting daunorubicin plus quinacrine liposomes, modified by wheat germ agglutinin and tamoxifen, for treating brain glioma and glioma stem cells. Oncotarget , 2014, 5 (15) : 6497–6511. DOI:10.18632/oncotarget |
| [3] | Duan JJ, Qiu W, Xu SL, et al. Strategies for isolating and enriching cancer stem cells:well begun is half done. Stem Cells Dev , 2013, 22 (16) : 2221–2239. DOI:10.1089/scd.2012.0613 |
| [4] | 孙红军, 荔志云, 谢守嫔, 等. 胶质瘤基于组学方法的分子标记物的研究进展. 国际神经病学神经外科学杂志 , 2014, 41 (05) : 443–447. |
| [5] | Ostrom QT, Bauchet L, Davis FG, et al. The epidemiology of glioma in adults:a "state of the science" review. Neuro Oncol , 2014, 16 (7) : 896–913. DOI:10.1093/neuonc/nou087 |
| [6] | Sturm D, Bender S, Jones DT, et al. Paediatric and adult glioblastoma:multiform (epi) genomic culprits emerge. Nat Rev Cancer , 2014, 14 (2) : 92–107. DOI:10.1038/nrc3655 |
| [7] | Stupp R, Mason WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med , 2005, 352 (10) : 987–996. DOI:10.1056/NEJMoa043330 |
| [8] | Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study:5-year analysis of the EORTC-NCIC trial. Lancet Oncol , 2009, 10 (5) : 459–466. DOI:10.1016/S1470-2045(09)70025-7 |
 2016, Vol. 43
2016, Vol. 43




