扩展功能
文章信息
- 郭彦杰, 董素艳, 赵文娟, 吴云成
- GUO Yan-Jie, DONG Su-Yan, ZHAO Wen-Juan, WU Yun-Cheng
- 白藜芦醇通过SIRT1/AMPK信号通路减轻MPTP诱导的小鼠多巴胺能神经元丢失
- Neuroprotective effect of resveratrol against MPTP-induced dopaminergic neuronal loss via the SIRT1/AMPK signaling pathway in mice
- 国际神经病学神经外科学杂志, 2016, 43(2): 97-102
- Journal of International Neurology and Neurosurgery, 2016, 43(2): 97-102
-
文章历史
收稿日期: 2015-12-28
修回日期: 2016-03-14
2. 上海交通大学药学院, 上海市 200240
帕金森病(Parkinson’s disease,PD)是仅次于阿尔茨海默病的第二大神经变性疾病,其主要病理学特征是黑质区多巴胺能神经元变性缺失和路易小体形成[1]。迄今为止,PD的发病机制尚未完全阐明,临床常用的多巴胺制剂仅能缓解运动症状,尚无真正意义上的延缓疾病进展的神经保护药物[2, 3]。我们的前期细胞研究结果证实,沉默信息调节蛋白1(silent information regulation 2 homolog 1,SIRT1)激动剂白藜芦醇(resveratrol,RV)[4]能够抑制鱼藤酮诱导的多巴胺能神经元线粒体损伤和细胞凋亡,其机制可能是RV通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)、引起细胞内NAD+水平增高、激活去乙酰化酶SIRT1而发挥神经保护作用[5]。但目前国内外尚无实验证实RV是否通过SIRT1/AMPK信号通路对PD动物模型发挥保护作用,且有研究报道SIRT1与AMPK之间存在相互调控作用[6-8]。因此,本研究拟通过建立MPTP亚急性PD小鼠模型[9],用RV灌胃进行干预,检测酪氨酸羟化酶(tyrosine hydroxylase,TH)及凋亡相关蛋白Caspase 3、Cleaved caspase 3的表达变化,观察RV对MPTP小鼠多巴胺能神经元是否有保护作用;同时腹腔注射SIRT1特异性抑制剂EX527,检测SIRT1、AMPK及p-AMPK蛋白表达变化,观察SIRT1激动剂RV及SIRT1特异性抑制剂EX527对SIRT1、AMPK及p-AMPK表达的影响,在动物水平探索RV神经保护作用的可能机制,并进一步探讨SIRT1与AMPK的上下游调控关系。
1 材料与方法 1.1 试剂白藜芦醇、MPTP、TH抗体购自Sigma公司;SIRT1抗体购自Millipore公司;SIRT1特异性抑制剂EX527购自Tocris公司;AMPK、p-AMPK、Caspase 3抗体购自CST公司;Alexa Fluor 594荧光二抗购自Invitrogen公司;GAPDH、β-actin抗体购自Protein Tech公司。
1.2 动物分组及给药雄性C57BL/6小鼠(10~12周,25~30 g)购至中国科学院上海实验动物中心(slac公司)。实验前置于上海交通大学实验动物中心适应环境1周后,随机分为4组,每组12只:CON组[1% DMSO/30% PEG-400/1% Tween 80(i.p.);0.5% CMC(i.g.);NS(i.p.)];MPTP组[1% DMSO/30% PEG-400/1% Tween 80(i.p.);0.5% CMC(i.g.);MPTP 30 mg/kg(i.p.)];RV+MPTP组[1% DMSO/30% PEG-400/1% Tween 80(i.p.);RV 100 mg/kg(i.g.);MPTP 30 mg/kg(i.p.)];EX527+RV+MPTP组[EX527 10 mg/kg(i.p.);RV 100 mg/kg(i.g.);MPTP 30 mg/kg(i.p.)]。
RV及EX527连续给药33 d,在给药第8天至第12天,连续腹腔注射MPTP 5 d,且MPTP给药在RV和EX527给药后2 h进行。MPTP是常用的制备PD动物模型的毒性药物。本研究采用亚急性造模方式,即MPTP按30 mg/kg连续腹腔注射5 d[9]。RV的给药剂量及给药途径结合既往文献报道及我们的预实验结果选择100 mg/kg灌胃给药[10, 11]。SIRT1抑制剂EX527给药剂量及给药途径根据既往文献报道采用10 mg/kg腹腔注射[12-14]。
1.3 心脏灌流及取材最后一次给药结束后,每组取4只小鼠经腹腔注射10%水合氯醛进行麻醉,打开胸腔,暴露心脏,将针头刺入左心室,同时剪破右心耳,经左心室快速灌注0.01M PBS 50 ml,随后灌注4%多聚甲醛(paraformaldehyde,PFA)50 ml进行固定。灌注结束后,小心取出脑组织,置于4% PFA中继续固定24 h,然后依次浸于20%和30%(0.1M PB配制)的蔗糖溶液中脱水,至脑组织下沉至瓶底。脑组织经OCT包埋后在冰冻切片机上进行冠状切片,脑片厚度为20 μm。脑片储存于脑片防冻液中,-20℃保存进行免疫荧光检测。每组剩余8只小鼠经颈椎脱臼处死、断头取脑,冰上迅速分离纹状体和黑质,保存于液氮进行western blot检测相关蛋白表达。
1.4 免疫荧光检测黑质区TH阳性神经元参照小鼠脑图谱每一个标本取3片相同部位脑片,采用免疫荧光检测黑质区TH阳性神经元。主要流程如下:洗去脑片防冻液→冰冻切片抗原修复液室温修复5 min→洗去抗原修复液→10%山羊血清封闭1 h→一抗孵育:加TH抗体,4℃过夜→洗去多余一抗→二抗孵育(避光):加荧光二抗Alexa Fluor 594,室温1 h→洗去多余二抗(避光)→抗荧光淬灭剂封片→避光晾干→使用奥林巴斯BX51荧光显微镜观察、拍摄。
1.5 Western blot检测纹状体区TH、SIRT1、AMPK、p-AMPK、Caspase 3、Cleaved caspase 3蛋白的表达取各组小鼠纹状体组织,称重,按照适当比例分别加入包含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液(50 mM Tris,pH 7.4,150 mM NaCl,1% TritonX-100,1% sodium deoxycholate,0.1% SDS),冰上组织匀浆器破碎30 s,置于冰上摇床裂解30 min,4℃、16000 rpm条件下离心30 min,收集上清液。BCA法测定蛋白浓度。各标本取40 μg,上样,使用SDS-PAGE凝胶电泳分离蛋白,电泳结束后将蛋白转印到PVDF膜上,完成转膜后使用5% BSA液室温封闭1 h,分别加入不同一抗TH(1: 2000)、SIRT1(1: 1000)、AMPK(1: 1000)、p-AMPK(1: 1000)、Caspase 3(1: 1000)、β-actin(1: 2000)、GAPDH(1: 1000)4℃孵育过夜。次日TBST清洗,再分别加入辣根过氧化物酶标记的抗兔或抗小鼠二抗(1: 5000)室温孵育1 h,ECL显色照相,结果用Image-J软件分析图像。
1.6 统计学处理Western blot实验结果至少重复三次。所有数据均用均数±标准差(x±s)表示。各组数据之间比较采用单因素方差分析(one-way ANOVA)。P<0.05被认为具有显著性差异。
2 结果 2.1 小鼠黑质区TH阳性神经元免疫荧光检测结果TH是脑内多巴胺合成的限速酶,也是脑内多巴胺能神经元的标志蛋白。免疫荧光检测小鼠黑质区TH阳性神经元结果显示,与CON组相比,MPTP组小鼠黑质区TH阳性神经元明显减少。给予RV后,小鼠黑质区TH阳性神经元较MPTP组明显增多。给予特异性SIRT1抑制剂EX527后,TH阳性神经元较RV+MPTP组明显下降。见图 1。
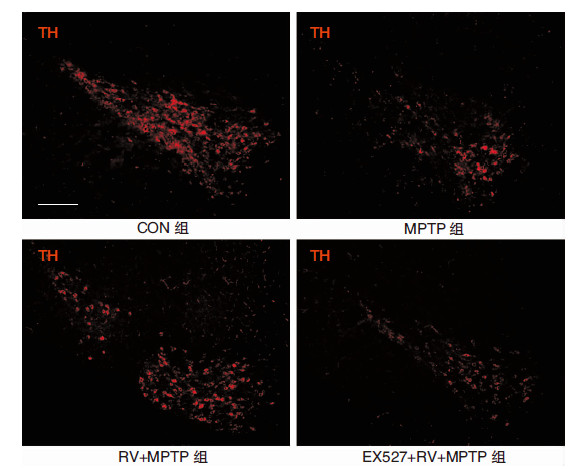
|
| 图 1 免疫荧光示小鼠黑质区TH阳性神经元。注:图中标尺为200 μm。 |
与黑质区免疫荧光结果类似,与CON组相比,MPTP组小鼠纹状体组织中TH蛋白显著下降(P<0.001)。给予RV后,TH蛋白较MPTP组显著升高(P<0.01)。给予特异性SIRT1抑制剂EX527后,TH蛋白较RV+MPTP组显著下降(P<0.001)。对各组小鼠纹状体区SIRT1蛋白表达进行检测,结果与各组中TH蛋白表达变化一致。见图 2。
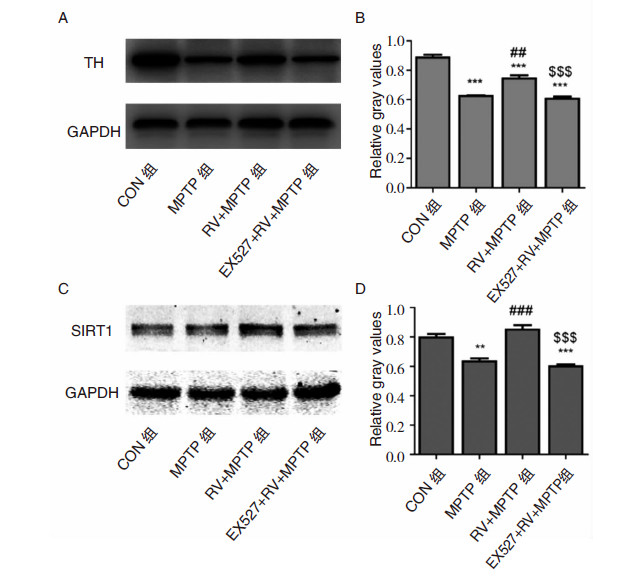
|
| 图 2 小鼠纹状体组织中TH、SIRT1 蛋白的表达。A:小鼠纹状体组织中TH蛋白Western blot 图谱。B:TH与GAPDH灰度比统计图。C:小鼠纹状体组织中SIRT1蛋白Western blot 图谱。D:SIRT1与GAPDH灰度比统计图。*P<0.05、**P<0.01、***P<0.001,均为与CON组比较;#P<0.05、##P<0.01、###P<0.001,均为与MPTP组比较;$P<0.05、$$P<0.01、$$$P<0.001,均为与RV+MPTP 组比较。 |
与CON组相比,MPTP组小鼠纹状体组织中SIRT1蛋白表达显著减少(P<0.01)的同时,p-AMPK蛋白水平显著下降(P<0.05)。给予RV后,SIRT1蛋白表达显著增多(P<0.001)的同时,p-AMPK蛋白水平较MPTP组亦显著升高(P<0.01)。给予特异性SIRT1抑制剂EX527后,SIRT1蛋白表达较RV+MPTP组显著减少(P<0.001),与此同时,p-AMPK蛋白水平也较RV+MPTP组显著下降(P<0.01)。AMPK蛋白表达在各组之间无显著差异。这提示激活或抑制SIRT1影响AMPK磷酸化水平。见图 3。
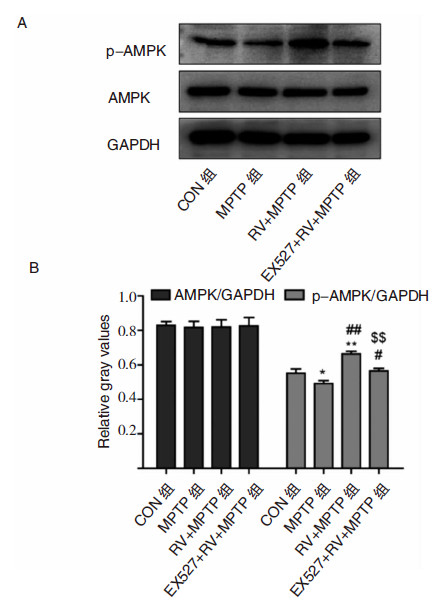
|
| 图 3 小鼠纹状体组织中AMPK、p-AMPK 蛋白的表达。A:小鼠纹状体组织中AMPK、p-AMPK蛋白Western blot 图谱。B:AMPK、p-AMPK与GAPDH灰度比统计图。*P<0.05、**P<0.01、***P<0.001,均为与CON组比较;#P<0.05、##P<0.01、###P<0.001,均为与MPTP组比较;$P<0.05、$$P<0.01、$$$P<0.001,均为与RV+MPTP 组比较。 |
与CON组相比,MPTP组小鼠纹状体组织中Cleaved caspase 3蛋白水平显著升高(P<0.001)。与MPTP组相比,RV+MPTP组Cleaved caspase 3蛋白水平显著下降(P<0.01)。给予特异性SIRT1抑制剂EX527后,与RV+MPTP组相比,Cleaved caspase 3蛋白水平显著升高(P<0.01)。与MPTP组相比,EX527+RV+MPTP组Cleaved caspase 3蛋白水平无显著差异。Caspase 3蛋白表达在各组之间无显著差异。见图 4。
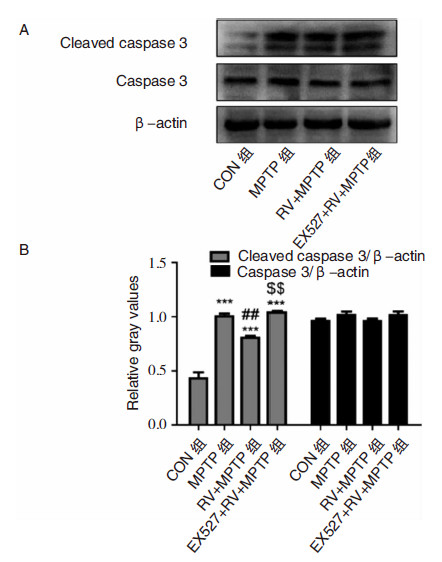
|
| 图 4 小鼠纹状体组织中Caspase 3、Cleaved caspase 3蛋白的表达。A:小鼠纹状体组织中Caspase 3、Cleaved caspase 3蛋白Western blot图谱。B:Caspase 3、Cleaved caspase 3与β-actin灰度比统计图。*P<0.05、**P<0.01、***P<0.001, 均为与CON组比较;#P<0.05、##P<0.01、###P<0.001,均为与MPTP组比较;$P<0.05、$$P<0.01、$$$P<0.001,均为与RV+MPTP 组比较。 |
PD是中老年人中常见的神经变性疾病[15, 16]。迄今为止,PD的发病机制尚未完全阐明,临床常用的多巴胺制剂仅能缓解运动症状,研究基于分子信号机制的延缓或改变PD病程进展的神经保护治疗具有重要的临床意义和科学前景[17]。本研究结果证实,RV对MPTP帕金森病小鼠多巴胺能神经元具有保护作用,且该保护作用与激活SIRT1/AMPK信号通路有关。
AMPK是能量代谢的关键调节因子,因其活性受AMP/ATP比值调控,被称作细胞的“代谢传感蛋白”或“能量监测器”,AMPK通过调节自噬和蛋白降解等稳态机制来控制体内的代谢平衡,维持细胞能量供求平衡[5]。在热量限制的情况下,NAD+依赖的去乙酰化酶SIRT1水平升高,进而延长生物体的衰老过程,因此,SIRT1与细胞的能量代谢同样存在着密切的关系[18, 19]。这提示AMPK与SIRT1可能在调节能量代谢过程中存在着内在联系[20]。我们的前期细胞研究结果证实,RV可能通过激活AMPK、进而激活SIRT1的表达抑制鱼藤酮诱导的多巴胺能神经元线粒体损伤和细胞凋亡[5]。但也有研究报道敲除SIRT1后,RV激活AMPK、改善线粒体功能的作用消失[6],提示SIRT1与AMPK之间存在相互调控作用。本实验结果表明,给予RV后,SIRT1表达量较MPTP组显著增加,同时p-AMPK蛋白水平较MPTP组亦显著升高,Cleaved caspase 3蛋白水平显著下降,与此同时,小鼠黑质区TH阳性神经元丢失率降低,纹状体组织中TH蛋白表达量增加。给予SIRT1特异性抑制剂EX527后,p-AMPK蛋白水平较RV+MPTP组显著降低,Cleaved caspase 3蛋白水平显著升高,与此同时,小鼠黑质区TH阳性神经元丢失率升高,纹状体组织中TH蛋白表达量下降。提示RV对MPTP帕金森病小鼠的保护作用是通过激活SIRT1,进而激活AMPK而获得。而我们前期的细胞实验抑制AMPK磷酸化后,抑制了SIRT1活性[5]。共同说明SIRT1与AMPK存在相互调控关系,且这种相互调控关系介导了RV对MPTP小鼠多巴胺能神经元的神经保护作用。
综合文献、我们的前期细胞实验与本实验的结果,我们认为RV可能通过激活SIRT1/AMPK信号通路,SIRT1与AMPK相互调控,下调凋亡相关蛋白Cleaved caspase 3水平,减少MPTP小鼠黑质区多巴胺能神经元丢失,从而有希望延缓或阻止PD的疾病进展。本研究有助于为PD的治疗提供理论依据和新靶点,具有重要的科学意义和临床应用前景。但RV对SIRT1/AMPK信号通路的直接调控机制、SIRT1/AMPK之间的具体相互调控作用及其下游作用靶点仍有待进一步研究。
| [1] |
Feng Y, Jankovic J, Wu YC. Epigenetic mechanisms in Parkinson's disease. J Neurol Sci, 2015, 349(1-2): 3–9. |
| [2] |
He Q, Koprich JB, Wang Y, et al. Treatment with Trehalose Prevents Behavioral and Neurochemical Deficits Produced in an AAV alpha-Synuclein Rat Model of Parkinson's Disease. Mol Neurobiol, 2015. |
| [3] |
Feng Y, Liu T, Li XQ, et al. Neuroprotection by Orexin-A via HIF-1alpha induction in a cellular model of Parkinson's disease. Neurosci Lett, 2014, 579: 35–40. |
| [4] |
Sajish M, Schimmel P. A human tRNA synthetase is a potent PARP1-activating effector target for resveratrol. Nature, 2015, 519(7543): 370–373. |
| [5] |
Wu Y, Li X, Zhu JX, et al. Resveratrol-activated AMPK/SIRT1/autophagy in cellular models of Parkinson's disease. Neurosignals, 2011, 19(3): 163–174. |
| [6] |
Price NL, Gomes AP, Ling AJ, et al. SIRT1 is required for AMPK activation and the beneficial effects of resveratrol on mitochondrial function. Cell Metab, 2012, 15(5): 675–690. |
| [7] |
Lin JN, Lin VC, Rau KM, et al. Resveratrol modulates tumor cell proliferation and protein translation via SIRT1-dependent AMPK activation. J Agric Food Chem, 2010, 58(3): 1584–1592. |
| [8] |
Silvestre MF, Viollet B, Caton PW, et al. The AMPK-SIRT signaling network regulates glucose tolerance under calorie restriction conditions. Life Sci, 2014, 100(1): 55–60. |
| [9] |
Jackson-Lewis V, Przedborski S. Protocol for the MPTP mouse model of Parkinson's disease. Nat Protoc, 2007, 2(1): 141–151. |
| [10] |
Blanchet J, Longpre F, Bureau G, et al. Resveratrol, a red wine polyphenol, protects dopaminergic neurons in MPTP-treated mice. Prog Neuropsychopharmacol Biol Psychiatry, 2008, 32(5): 1243–1250. |
| [11] |
Lofrumento DD, Nicolardi G, Cianciulli A, et al. Neuroprotective effects of resveratrol in an MPTP mouse model of Parkinson's-like disease: possible role of SOCS-1 in reducing pro-inflammatory responses. Innate Immun, 2014, 20(3): 249–260. |
| [12] |
Dietrich MO, Antunes C, Geliang G, et al. Agrp neurons mediate Sirt1's action on the melanocortin system and energy balance: roles for Sirt1 in neuronal firing and synaptic plasticity. J Neurosci, 2010, 30(35): 11815–11825. |
| [13] |
Kim DH, Jung YJ, Lee JE, et al. SIRT1 activation by resveratrol ameliorates cisplatin-induced renal injury through deacetylation of p53. Am J Physiol Renal Physiol, 2011, 301(2): F427–F435. |
| [14] |
Smith MR, Syed A, Lukacsovich T, et al. A potent and selective Sirtuin 1 inhibitor alleviates pathology in multiple animal and cell models of Huntington's disease. Hum Mol Genet, 2014, 23(11): 2995–3007. |
| [15] |
Wu Y, Le W, Jankovic J. Preclinical biomarkers of Parkinson disease. Arch Neurol, 2011, 68(1): 22–30. |
| [16] |
崔新新, 吴云成.缺氧诱导因子-1在帕金森病发病机制中的研究进展. 国际神经病学神经外科学杂志,2015, 42(3): 298–302. |
| [17] |
Feng Y, Liu T, Dong SY, et al. Rotenone affects p53 transcriptional activity and apoptosis via targeting SIRT1 and H3K9 acetylation in SH-SY5Y cells. J Neurochem, 2015, 134(4): 668–676. |
| [18] |
Cetrullo S, D'Adamo S, Tantini B, et al. mTOR, AMPK, and Sirt1: Key Players in Metabolic Stress Management. Crit Rev Eukaryot Gene Expr, 2015, 25(1): 59–75. |
| [19] |
刘晔, 王俊娟, 吴云成.沉默信息调节蛋白1对神经变性疾病的神经保护作用研究进展. 国际神经病学神经外科学杂志,2012, 39(6): 562–566. |
| [20] |
Ferretta A, Gaballo A, Tanzarella P, et al. Effect of resveratrol on mitochondrial function: implications in parkin-associated familiar Parkinson's disease. Biochim Biophys Acta, 2014, 1842(7): 902–915. |
 2016, Vol. 43
2016, Vol. 43




