扩展功能
文章信息
- 林和璞, 徐维林, 王强, 张宏伟, 马晓东
- LIN He-pu, XU Wei-lin, WANG Qang, ZHANG Hongwei, MA Xiaodong
- 替莫唑胺-PLGA纳米缓释微球的制备及体外药效研究
- Preparation of temozolomide-PLGA sustained-release nanoparticles and their in vitro efficacy
- 国际神经病学神经外科学杂志, 2016, 43(2): 153-157
- Journal of International Neurology and Neurosurgery, 2016, 43(2): 153-157
-
文章历史
收稿日期: 2015-09-14
修回日期: 2016-04-14
2. 解放军总医院神经外科, 北京 100853
胶质瘤生长呈浸润性,术后易复发,尤其是高级别胶质瘤,几乎100%复发[1]。研究显示80%以上的高级别胶质瘤在距第一次切除瘤腔边缘2 cm内复发,因此有效的局部药物治疗能够灭杀胶质瘤细胞,延缓肿瘤复发,延长生存期[2]。替莫唑胺(temozolomide,TMZ)是一种新型的含有咪唑四嗪(imidazotetrazine)环的烷化剂类抗肿瘤药物。替莫唑胺主要作用于胶质瘤细胞的核酸、蛋白质及肽亲核区等领域,影响肿瘤细胞分裂的各个时期,具有广谱抗肿瘤的活性[3]。研究者利用明胶海绵、淀粉、聚乙醇酸、海藻酸钠、聚乳酸及壳聚糖等物质作为缓释药物系统的载体都曾获得部分进展,但仍存在稳定性低、突释现象明显、释放速率不稳定等不足[4]。借鉴前人研究成果,本实验选用聚乳酸/羟基乙酸(polylactic-co-glycolic acid,PLGA)共聚物作为制备局部缓释化疗药物系统的载体材料[5]。本研究使用分子量不同的PLGA,采用超声乳化-溶剂挥发法制备替莫唑胺-聚乳酸/羟基乙酸(TMZ-PLGA)缓释微球系统,力求为新型给药途径-颅内缓释TMZ提供确切详实的研究基础。
1 资料和方法 1.1 药品与试剂替莫唑胺原料药 武汉思源化工有限公司
聚乳酸/羟基乙酸(PLGA) 山东省医疗器械研究所
聚乳酸/羟基乙酸(PLGA),分子量分别为15000、20000、33000、36000。
1.2 方法 1.2.1 制备缓释微球应用超声乳化-溶剂挥发法制备TMZ-PLGA纳米缓释微球。TMZ晶体溶于甲醇,PLGA聚合体溶于二氯甲烷,将两种溶液混合,所获得的溶液中TMZ与PLGA的质量比为1:9,所得到的有机溶液在含有聚乙烯醇的溶液中搅拌乳化,搅拌(800 rpm) 温度为室温,搅拌30min后速度降变为350 rpm,直至二氯甲烷及甲醇完全挥发。蒸馏水清洗得到的微球,过筛,除去不均匀颗粒,干燥冷冻,样品随机封包,并置于0℃冷藏。以上操作均在避光条件下进行。
1.2.2 高分辨光镜及扫描电镜观察首先利用显微镜观察四种不同分子量缓释微球的表面形态特征,继而利用TOSHIBA800S扫描电镜,电压20 kV,每一规格测量300个微球直径,按公式l计算微球平均直径:Vni是每5 μm跨度范围内微球数目,di是在该范围内微球粒径的平均值。
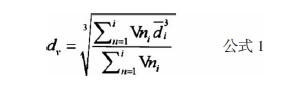
精密称取微球5 mg置于10 mL量瓶中,加适量二氯甲烷溶解微球,应用甲醇稀释至固定刻度,并过滤,量取过滤液100 μL稀释至2.5 mL,取其中20 μL溶液注入高效液相色谱仪,详细记录峰面积,利用公式计算出该缓释微球的载药量和包封率。其中微球的载药量=(微球中药物含量/微球重量)×100%,包封率=(微球中药物含量/投药量)×100%。
1.2.4 药物释放曲线的测定分别于1 h、3 h、6 h、12 h、24 h、48 h、72 h、96 h、120 h、168 h、240 h、360 h,480 h不同时间点取出样品,利用高效液相色谱法检测缓释微球中剩余的TMZ含量,用测定的微球中剩余的TMZ量来计算出缓释微球不同时间的TMZ释放量,进而绘制出不同分子量TMZ-PLGA缓释微球的体外环境下释放曲线并进行比较。
1.2.5 二氯甲烷残留率的测定气相色谱条件:初始温度40℃,并以20℃/min的速度升至250℃,进样口检测器的温度为250℃。柱前压 55 kPa.FID检测,色谱柱:DB-624(30 m × 0.32 nm,1.8 μm)。顶空条件:传输线温度为100℃,定量环温度为90℃,样品瓶温度80℃,定量环填充时间0.15 min,定量环平衡时间为0.05 min,样品瓶平衡时间10 min,进样时间为1.0 min。限量的配制:取二氯甲烷1.13 μL,于200 mL容量瓶中,加二甲基甲酰胺(DMF)至刻度,充分混匀,l mL顶空进样。称量样品加DMF l mL溶解,顶空进样。
2 结果 2.1 TMZ-PLGA缓释微球理化性质TMZ-PLGA缓释微球的制作有严格规范的制备条件,严格控制温度,采用超声乳化-溶剂挥发法制备缓释微球能够获得大小均匀、结构稳定的缓释微球。分析发现缓释微球的载药量和直径没有直接相关性,在同等制备条件下,分子量越大的PLGA所获得的微球直径越大,不同分子量的TMZ-PLGA的直径分布见表 1。高分辨光镜观察(亚甲蓝染色),微球表面光滑,无裂隙,微球无明显聚集,微球直径均匀(见图 1,2)。

|
| 图 1 |

|
| 图 2 |
| 实验样品 | 分子量 | LA/GA | 微球直径(μm) | 包封率% |
| A | 15000 | 75∶25 | 37.48±12.56 | 94.21±3.56 |
| B | 20000 | 50∶50 | 45.28±15.73 | 95.34±4.27 |
| C | 33000 | 50∶50 | 60.98±13.86 | 94.78±2.98 |
| D | 36000 | 25∶75 | 84.65±17.74 | 96.10±3.76 |
本实验制备的不同分子量TMZ-PLGA缓释微球最大载药量为10.2%,所有缓释微球的包封率均在90%以上,使制备过程中药物的损失量极少(不同分子量缓释微球包封率见表 1)。精确控制TMZ在缓释微球中的载药量,有利于降低高载药量导致严重的药物突释现象这一难题[6]。
2.3 TMZ-PLGA缓释微球的安全性二氯甲烷残留量测定结果:样品中二氯甲烷残留量测定为5.70‰,远低于国外文献报道颅内安全应用所要求的3%[7]。
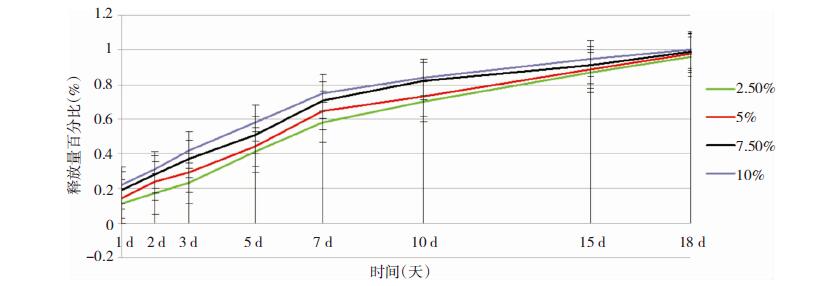
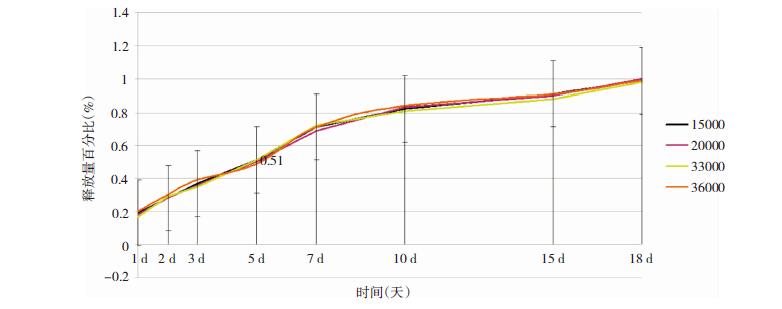
2.4 TMZ-PLGA缓释微球的释放曲线研究TMZ-PLGA缓释微球的释放曲线表明(见图 3,4),该缓释系统中药物TMZ可以持续释放2周以上,满足了局部化疗作用时间2周以上的要求[8]。分析研究结果表明,载药量越高,达到药物完全释放的时间越短(见图 3)。本研究数据用平均数±标准差表示,应用SPSS 14.0统计软件,采用方差分析,发现不同分子量PLGA载体对微球释放药物无明显影响(见图 4)。通过严格控制缓释微球的载药量,降低突释药量,解决缓释前期突释现象严重这一关键问题,达到缓释、控释的目的。
|
| 图 3 不同载药量微球(LA/GA=75:25,分子量 15000)释放曲线(n=3) |
|
| 图 4 不同分子量微球药物释放曲线(n=3) |
尽管术中磁共振技术、多模态功能神经导航技术及术中麻醉唤醒电生理检测等技术的应用极大地促进了胶质瘤手术治疗的发展,新型放疗设备和放疗手段的出现,以及以替莫唑胺为代表的新型化疗药物的研发,均对胶质瘤的诊治起到了有效的治疗作用[9]。临床研究表明,胶质瘤极少发生转移,80%以上的胶质瘤于原瘤腔边缘2 cm内复发,这一研究发现为局部化疗用药提供了新方向[10]。局部间质内化疗的主要优点在于不需要经过血脑屏障,直接作用于胶质瘤细胞,并且使瘤腔局部能够维持有效的化疗药物浓度,该方案能够强烈的抑制和杀灭瘤腔边缘2 cm内的胶质瘤细胞。理想的局部间质内化疗能达到使肿瘤静止甚至消失、预防复发的目的[11]。韩永涛等利用乳化-溶剂挥发法制备阿奇霉素-聚乳酸微球,微球大小均匀,平均直径为20.8±0.5 μm,包封率为68.3±1.28%,具有缓释作用[12];刘善奎等人制备DNA疫苗海藻酸钠微球则采用了油包水(W/O)乳化-离子交联法,所获微球球型圆整,实现了可控释药速率,平均直径为12.03±6.9 μm,微球聚集不明显,体外实验显示药物释放速率平稳,与微球载药量呈正比[13];陈建等的制备工艺方法采用全面优化微球的方案,获得了以壳聚糖为载体的TMZ-壳聚糖微球[14]。在充分总结前人在相关领域的研究基础上,本实验采用超声乳化-溶剂挥发法制备微球缓释化疗药物系统,本实验所制备的TMZ-PLGA缓释微球,表面光滑圆整,无裂隙,微球无明显聚集,微球大小均匀,体外环境下药物释放周期达2周以上,药物释放速率趋于平稳(见图 3、图 4),完全符合体内外实验所需。经研究检测所有缓释微球的包封率均超过90%,载药总量接近投放药物总量,二氯甲烷残余量为5.70‰,远低于国外文献报道的3%,完全符合颅内安全应用要求。TMZ稳定存在于缓释微球中,药物释放后不影响该缓释微球的稳定性和微球内剩余药物的理化性质[15]。因此本实验制备的TMZ-PLGA缓释微球系统具有高包封率、高稳定性、分散性好、不明显聚集、载药量适中、无明显突释现象、稳定的体外释放速率等优势。
制备缓释系统所利用的载体物质需要具备以下特点:⑴强大的载药能力和稳定缓释药物的能力;⑵结构稳定,纯度高;⑶生物可降解性能好;⑷理化性质和生物相容性良好,载体本身和降解后产生的物质无凝血作用、无毒性、无疤痕形成作用[16]。本实验采用PLGA(聚乳酸/羟基乙酸)作为缓释微球载体,作为外科手术缝合材料,PLGA具组织相容性良好,PLGA的分解产物主要为乳酸和乙醇酸,三羧酸循环将乳酸代谢为CO2和H2O排出体外,乙醇酸进入三羧酸循环代谢以CO2和H20的形式排出体外,或以原形从肾脏排出。另外通过调节PLA与GA的比例,可以调节缓释系统的可降解时间[17]。乳酸的疏水性强于甘醇酸,因此高含量乳酸的PLGA聚合体有较差的亲水性,吸收水分少,降解速率慢[18]。
研究表明PLGA降解包括3个步骤:①随机剪切链,聚合体分子量明显下降,可溶性单体产物无法产生;②体积和分子量迅速下降,单体和可溶性寡聚体形成;③寡聚体片断分解成可溶性单体,整个聚合体溶解[19]。以PLGA为载体的缓释微球中药物释放相应的也可以分为三个时期:(1)快速释放期,大部分突释现象发生在这一时期;(2)缓慢释放期,聚合体缓慢降解时的药物缓慢释放,这一时期是维持药物有效浓度、决定缓释时间长短、发挥药物作用的主要阶段;(3) 加快释放期,聚合体蚀解导致药物浓度出现一个较低的峰值。其中第一时期药物快速释放是导致缓释微球突释现象的主要阶段[20]。
本实验选用四种不同分子量(15000,20000,33000,36000)的PLGA作为载体制备缓释微球体系,经本实验研究证实不同分子量载体对缓释微球理化性质的影响无统计学意义。Shenderova等以低中高分子量(粘度分别为0.15、0.58、1.07) PLGA制作微球承载l0-羟喜树碱,发现分子量低的微球释放药物快[21]。本研究认为:不同研究所得结论不尽相同,考虑为不同载体的生物学特性及理化性质不同,例如疏水性药物与PLGA结合疏散,亲水性药物与PLGA结合紧密。选用不同材料作为载体可能获得相反的结论。由于本实验选择的PLGA聚合体粘度(代表分子量)差别不大,故未发现分子量不同的载体明显影响药物释放[22]。
4 结论本实验制备的TMZ缓释微球系统以不同分子量的PLGA为载体,体外释放周期超过2周,药物浓度保持稳定,包封率均高于90%,载药量接近投放药物总量。TMZ在缓释微球系统中稳定存在,药物释放后不影响缓释体系的稳定及微球内剩余药物的理化性质。二氯甲烷残留量为5.70‰,完全符合颅内安全应用的要求。
研究表明,本实验制备的纳米缓释微球系统在缓释、控释及安全应用等方面均符合体外细胞实验及动物实验要求,能够满足进一步实验需要。
| [1] | 《中国中枢神经系统胶质瘤诊断和治疗指南》编写组;中国中枢神经系统胶质瘤诊断和治疗指南(2012精简版).中华医学杂志,2012,92(33):2309-2313. |
| [2] |
Klepper Lia. Method of calculating the equivalent tumor dose as a function as to irradiated tumor tissue volume. Med Tekh, 2001 15–20. |
| [3] |
Kobayashi, H, Sawamura Y, Ishii N, et al. Temozolomide in the treatment of recurrent malignant glioma. No Shinkei Geka, 2006, 34(12): 1241–1247. |
| [4] | Su,Y, Li X, Liu Y,et al. Encapsulation and controlled Release of Heparin from Electrospun Poly (L-Lactide-co-epsilon-Caprolactone) Nanofibers,J Biomater Sci Polym Ed, 2011,22(1-3):165-177. |
| [5] |
Chen C, Xu T, Lu Y, et al. The efficacy of temozolomide for recurrent glioblastoma multiforme. Eur J Neurol, 2013, 20(2): 223–230. |
| [6] |
马晓东, 章文斌, 周定标, 许百男.BCNU缓释可降解微球的制备与特征. 中华神经医学杂志,2006, 5(7): 692–695. |
| [7] |
Menei P, Benoit JP, Celle MB, et a1. Drug targeting into the central nervous system by stereotactic implantation of biodegradable microspheres. Neurosurgery, 1994, 34(6): 1058–1064. |
| [8] |
Huang, Z M, He CL, Yang A, et al. Encapsulating drugs in biodegradable ultrafine fibers through co-axial electrospinning. J Biomed Mater Res A, 2006, 77(1): 169–179. |
| [9] | 李瑞,尤永平;纳米载体在胶质瘤基因治疗中的应用.国际神经病学神经外科杂志,2007,34(3):246-249. |
| [10] |
Ashby Ls, Ryken TC. Management of malignant glioma:steady, progress with multimodal approaches. Neurosurg Focus, 2006, 20(4): . |
| [11] |
马晓东, 章文斌, 周定标.BCNU缓释微球制备条件的优化. 中华神经外科疾病研究杂志,2006, 5(4): 303–306. |
| [12] | 韩永涛,黄桂华等,阿奇霉素聚乳酸微球的制备及其体外释药特性的研究.山东大学学报, 2006,44(8):853-856. |
| [13] |
刘善奎, 高申, 等.DNA疫苗海藻酸钠微球的制备及体外释药. 第二军医大学学报,2004, 25(1): 58–60. |
| [14] |
陈健, 黄书岚, 何文, 代文兵, 马金阳.替莫唑胺壳聚糖缓释微球的制备及体外释药特性. 中国医院药学杂志,2005, 25(12): 1115–1118. |
| [15] |
丁艳, 王金萍, 潘瑶.替莫唑胺脂质体制备工艺研究. 齐鲁药事,2010, 29(2): 111–113. |
| [16] |
曾晗冰, 李万里, 徐华梓.BSA-PLGA缓释微球制备工艺的优化. 实用医学杂志,2009, 25(17): 2935–2938. |
| [17] |
Wang YM, Isao H, Hitoshi L, et a1. Preparation and characterization of Poly (1actic-co-glycolic acid) microspheres for targeted delivery of a novel anticancer agent,Taxol. Chem Pharm Bull, 1996, 44(10): 1935–1940. |
| [18] | Zhou LF, Wang RZ, Bao SD, et al. Chinese guideline for diagnosis and treatment on central nervous system tumors. Zhonghua Yi Xue Za Zhi. 2012, 92: 2309-2313. |
| [19] |
Jalon EG, Blanco-Prieto MJ, Ygartua P, et a1. PLGA micro-particles:possible vehicles for topical drug delivery. Int J Pharm, 2001, 226(1-2): 181–184. |
| [20] |
Batycky RP, Hanes J, Langer R, et a1. A theoretical model of erosion and macromolecular release from biodegrading microspheres. J Pharm Sci, 1997, 86(12): 1464–1477. |
| [21] |
Shenderova A, Burke TG, Schwendeman SP, et al. Stabilization of 10-hydroxycamptothecin in poly (1actide-co-glycolide) microsphere delivery vehicles. Pharm Res, 1997, 14(10): 1406–1414. |
| [22] |
牛小东, 马弟娃, 田宏亮.替莫唑胺对比传统化疗药治疗脑胶质瘤疗效的系统评价. 国际神经病学神经外科杂志,2014, 41(1): 1–6. |
 2016, Vol. 43
2016, Vol. 43



