扩展功能
文章信息
- 黄春波, 程全, 王君宇, 陈风华
- HUANG Chun-bo, CHENG Quan, WANG Jun-yu, CHEN Feng-hua
- 一种判定颈内动脉床突旁动脉瘤位于硬膜下或海绵窦内的新方法
- A new method to determine the location of paraclinoid carotid aneurysms in subdural area or cavernous sinus
- 国际神经病学神经外科学杂志, 2016, 43(2): 128-131
- Journal of International Neurology and Neurosurgery, 2016, 43(2): 128-131
-
文章历史
收稿日期: 2016-02-28
修回日期: 2016-04-28
颅内动脉瘤是蛛网膜下腔出血的主要原因之一,死残率较高[1]。床突旁动脉瘤是临床常见的颅内动脉瘤,其位置关系决定其有不同的自然史和处理方法。位于海绵窦内的床突旁动脉瘤出血风险低可以随访观察,而位于硬膜下的床突旁动脉瘤可出现蛛网膜下腔出血,需尽早治疗。因此对床突旁动脉瘤术前影像学精确定位的研究具有重要意义[2, 3]。
本研究回顾30例颈内动脉床突旁动脉瘤伴蛛网膜下腔出血病例的手术前后3D-CTA图像,以前床突下缘与鞍结节的虚拟连线与动脉瘤关系判定近侧硬膜环与动脉瘤的关系,并与术中所观察到的动脉瘤情况对比研究,评价3D-CTA对颈内动脉床突旁硬膜下动脉瘤和海绵窦内动脉瘤的定位诊断价值。
1 材料与方法 1.1 研究对象回顾本手术组2012年7月~2015年4月间发现患有颈内动脉床突旁动脉瘤病人30例,男13例,女17例,年龄13~69岁(平均年龄49.4岁),其中12例为多发动脉瘤病人。所有病人均有蛛网膜下腔出血,术前术后都接受3D-CTA检查,在病人或家属知情同意并签署书面同意书后行手术治疗。
1.2 图像采集及处理采用德国西门子公司双源螺旋CT机(SOMATOM Definition),扫描参数:电压100 KV,电流250 mA,采集:64×0.6,螺距0.9,重建层厚0.75 mm,层距0.5 mm,矩阵512×512。使用的对比剂为非离子型对比剂碘普罗胺,含碘量370 mg/ml,规格50 ml/瓶,采用高压注射器以4.0 ml/S的速度经肘静脉置管注入60 ml(1 ml/kg)非离子型对比剂,智能跟踪技术,触发阈值100 Hu,扫描范围:C3水平至颅顶。在西门子专用工作站中进行图像重建,每个病人均完成以下处理:(1)多层面重建(MPR)或多平面曲面重建(CMPR):轴位+失状位+冠状位,必要时增加各种斜位;(2)容积显示重建(VR);(3)最大密度投影重建(MIP)。
1.3 图像评价及分析由一名神经外科医师与一名影像科医师共同进行阅片、图像评价。主要观察指标:动脉瘤的形态、大小和瘤颈宽度、瘤体和前床突下缘与鞍结节的虚拟连线的关系,并与手术结果进行对比研究。
2 结果30例病人共有颅内动脉瘤44个,其中颈内动脉床突旁动脉瘤32个,动脉瘤直径最小为1.8 mm,最大为29 mm,平均为8.7 mm。32个动脉瘤有20个位于左颈内动脉,12个位于右颈内动脉。24个颈内动脉硬膜下动脉瘤中有6个颈内动脉眼动脉段动脉瘤和18个颈内动脉床突段动脉瘤;24个颈内动脉硬膜下动脉瘤其中有19个位于颈内动脉内侧壁或者内后壁,5个位于颈内动脉前壁。
通过3D-CTA图像发现,24个颈内动脉硬膜下动脉瘤近端都在前床突下缘与鞍结节的虚拟连线上方(见图 1),8个海绵窦内动脉瘤远端都在前床突下缘与鞍结节的虚拟连线下方(见图 2)。经手术中观察,32个颈内动脉动脉瘤中近端在前床突下缘与鞍结节的虚拟连线上方的24个均被证实为硬膜下动脉瘤,而8个远端都在前床突下缘与鞍结节的虚拟连线下方的动脉瘤位于海绵窦内。
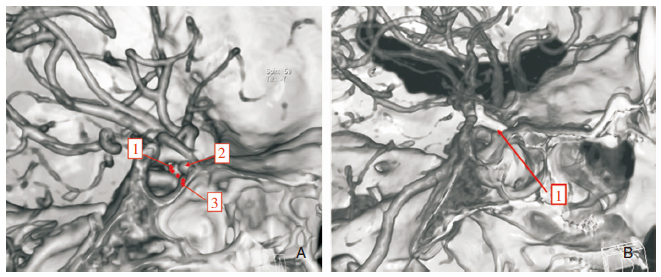
|
| 图 1 女性,48岁,为左侧颈内动脉床突段动脉瘤患者,A:为其术前图片,1为前床突,2为左侧颈内动脉床突段动脉瘤,3为鞍结节,虚线为前床突下缘与鞍结节的虚拟连线,动脉瘤位于虚线上方。B:为其术后图片,1为动脉瘤夹,术中证实为左侧颈内动脉床突段动脉瘤。 |
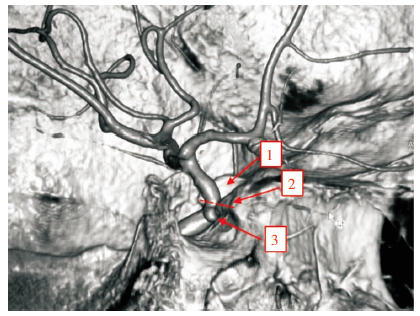
|
| 图 2 女性,56岁,为伴左侧颈内动脉海绵窦段动脉瘤的多发动脉瘤患者,1为前床突,2为鞍结节,3为颈内动脉海绵窦段动脉瘤,虚线为前床突下缘与鞍结节的虚拟连线,术中无法观察到此动脉瘤。 |
硬膜环是颈内动脉海绵窦段与硬膜内段的界定标志,它又可分为近侧环和远侧环,颈内动脉床突段走行于两环之间。远侧硬脑膜环是硬膜内外的传统解剖分界线,但远端硬膜环前外侧壁较厚,与颈内动脉结合紧密,而内后壁较为松散,有时是不完整的,蛛网膜下腔结构疝入颈内动脉的后方和内侧行成颈动脉穴[4],该穴通常与蛛网膜下腔相通,所以颈内动脉床突段的动脉瘤可以引起蛛网膜下腔出血[5]。因此我们认为,临床应用中应将近侧硬膜环作为颈内动脉硬膜下与海绵窦内动脉瘤分界的标志。然而近侧硬膜环在影像学不能显影,但显微解剖结果显示,近侧硬膜环位于前床突内侧的下缘,向内后侧延续为颈动脉穴的底和鞍隔,而鞍隔向前附着于鞍结节,与硬膜近环处于同一水平。故从骨性标志上看,前床突下缘与鞍结节的虚拟连线能够代表近侧硬膜环的平面。由于3D-CTA的图像上能很好显示颈内动脉与周围骨性解剖结构的关系,使得3D-CTA定位颈内动脉床突旁硬膜下和海绵窦内动脉瘤成为可能。
以往认为眼动脉的起源部位是DSA检查中鉴别颈内动脉海绵窦段和硬脑膜内起始段动脉瘤的传统解剖标志[6],然而眼动脉的起源部位个体变异大,Horiuchi等[7]报告85.7%的病人眼动脉起源于颈内动脉的硬膜内,紧靠远侧硬脑膜环的远侧,7.6%的患者眼动脉起源于硬膜外段,而有6.7%的患者眼动脉起源于两侧硬脑膜环之间。Taptas等[8]研究认为前床突可同样作为鉴别的解剖标志,但前床突体积和形状变异较大,而且在DSA检查中不易于观察,并不是可信的解剖标志。近几年随着技术的不断发展,MRI图像鉴别硬膜下与海绵窦内动脉瘤成为研究的热点。Tsuboi等[9]使用三维动态增强磁共振血管成像技术能使颈内动脉、海绵窦壁、动脉瘤和血管外结构区分。Thines等[10, 11]发现在T2加权(快速自旋回波)序列中脑脊液为高信号,在3.0T MRI空间分辨率研究中信号明显增强,通过连续薄层扫描的图像,可以观察硬脑膜海绵窦顶壁褶皱确定远侧硬脑膜环及了解相关解剖关系,识别海绵窦腔两侧的动脉瘤。Watanabe等[12]用3D-MR脑室造影和MR血管造影混合图像法,也能清晰鉴别脑脊液和海绵窦壁的边界,并用来定位远侧硬脑膜环,为动脉瘤与海绵窦顶壁之间的关系提供准确的信息。但MRI存在以远侧硬膜环为标记、骨质显示不清晰,检查时间长、程序繁杂、噪声大不利于已破裂动脉瘤病人等缺点。Gonzalez等[13]认为在CTA结果中视柱能准确界定近侧硬膜环的位置,如果动脉瘤起源于视柱的近心端,就位于海绵窦内,如果动脉瘤起源于视柱的远心端,就位于床突段或蛛网膜下腔。但普通CTA由于仅采用了颈内动脉前壁前的视柱作为一个点为定位标志,故较为粗糙,尤其是内后侧的动脉瘤易偏离。
研究中我们发现颈内动脉床突段动脉瘤少见源于颈内动脉外侧壁者,源于颈内动脉床突段前壁的动脉瘤瘤颈多是跨床突段和床突上段存在,而且大部分在床突上段而小部分位于床突段,可能是由于颈内动脉外侧壁和前壁硬膜环与动脉结合紧密难以膨大的缘故。颈内动脉床突段动脉瘤多数源于颈内动脉内后侧壁,位于颈动脉穴,它可以引起蛛网膜下腔出血。因此远侧硬膜环不应作为区分动脉瘤是否位于“硬膜下”的标志,而使用近侧硬膜环作为硬膜下和海绵窦内动脉瘤的分界似乎更为合理。我们经开颅手术和显微解剖证实,前床突下缘与鞍结节的虚拟连线能代表近侧硬膜环水平,能清晰界定颈内动脉硬膜下和海绵窦内动脉瘤,而且观察3D-CTA的最佳方向是自中线矢状面内侧观,以前床突下缘与鞍结节的虚拟连线为界,在该连线以上为颈内动脉硬膜下动脉瘤,在该连线以下为颈内动脉海绵窦内动脉瘤。尽管本研究与Gonzalez等[13]的研究一样,都采用了骨性标志作为界定的依据,但应用3D-CTA技术的图像更为清晰直观,对近侧硬膜环的界定更为准确,临床应用亦简单方便。
| [1] |
Steiner T, Juvela S, Unterberg A, et al. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. Cerebrovasc Dis, 2013, 35(2): 93–112. |
| [2] |
Lee N, Jung JY, Huh SK, et al. Distinction between Intradural and Extradural Aneurysms Involving the Paraclinoid Internal Carotid Artery with T2-Weighted Three-Dimensional Fast Spin-Echo Magnetic Resonance Imaging. J Korean Neurosurg Soc, 2010, 47(6): 437–441. |
| [3] |
Jeon JS, Ahn JH, Huh W, et al. A retrospective analysis on the natural history of incidental small paraclinoid unruptured aneurysm. J Neurol Neurosurg Psychiatry, 2014, 85(3): 289–294. |
| [4] |
Joo W, Funaki T, Yoshioka F, et al. Microsurgical anatomy of the carotid cave. Neurosurgery, 2012, 70(2 Suppl Operative): 300–312. |
| [5] |
Oikawa S, Kyoshima K, Kobayashi S. Surgical anatomy of the juxta-dural ring area. J Neurosurg, 1998, 89(2): 250–254. |
| [6] |
Punt J. Some observations on aneurysms of the proximal internal carotid artery. J Neurosurg, 1979, 51(2): 151–154. |
| [7] |
Horiuchi T, Tanaka Y, Kusano Y, et al. Relationship between the ophthalmic artery and the dural ring of the internal carotid artery. Clinical article. J Neurosurg, 2009, 111(1): 119–123. |
| [8] |
Taptas JN. Intradural and extradural ICA. J Neurosurg, 1979, 51(6): 877–878. |
| [9] |
Tsuboi T, Tokunaga K, Shingo T, et al. Differentiation between intradural and extradural locations of juxta-dural ring aneurysms by using contrast-enhanced 3-dimensional time-of-flight magnetic resonance angiography. Surg Neurol, 2007, 67(4): 381–387. |
| [10] |
Thines L, Delmaire C, Le Gars D, et al. MRI location of the distal dural ring plane: anatomoradiological study and application to paraclinoid carotid artery aneurysms. Eur Radiol, 2006, 16(2): 479–488. |
| [11] |
Thines L, Lee SK, Dehdashti AR, et al. Direct imaging of the distal dural ring and paraclinoid internal carotid artery aneurysms with high-resolution T2 turbo-spin echo technique at 3-T magnetic resonance imaging. Neurosurgery, 2009, 64(6): 1059–1064. |
| [12] |
Watanabe Y, Nakazawa T, Yamada N, et al. Identification of the distal dural ring with use of fusion images with 3D-MR cisternography and MR angiography: application to paraclinoid aneurysms. Am J Neuroradiol, 2009, 30(4): 845–850. |
| [13] |
Gonzalez LF, Walker MT, Zabramski JM, et al. Distinction between paraclinoid and cavernous sinus aneurysms with computed tomographic angiography. Neurosurgery, 2003, 52(5): 1131–1137. |
 2016, Vol. 43
2016, Vol. 43



