扩展功能
文章信息
- 常凯杰, 马明明, 张晓辉, 杨期东, 张杰文
- CHANG Kai-Jie, MA Ming-Ming, ZHANG Xiao-Hui, YANG Qi-Dong, ZHANG Jie-Wen
- 肢带型线粒体肌病一个家系的临床和病理特点研究
- Clinical and pathological features of a family with limb-girdle type mitochondrial myopathy
- 国际神经病学神经外科学杂志, 2016, 43(1): 22-26
- Disease Surveillance, 2016, 43(1): 22-26
-
文章历史
- 收稿日期: 2015-12-01
- 修回日期: 2016-01-19
2. 中南大学湘雅医院神经内科, 湖南省长沙市 410008
线粒体病是由线粒体DNA(mitochondrial DNA,mtDNA)或核DNA(nuclear DNA,nDNA)缺陷导致的线粒体结构和功能障碍而引起的一组疾病。该病常同时累及多个器官,也有少数患者仅表现为四肢肌无力或运动耐力下降,此种类型也被命名为肢带型线粒体肌病[1]或单纯型线粒体肌病[2]。骨骼肌中出现破碎红纤维(ragged-red fibers,RRF)是线粒体病的特征性病理特点。肢带型线粒体肌病报道相对罕见,至今尚未有对家系患者的详细研究。本文通过对一组肢带型线粒体肌病家系中的3名患者进行临床资料收集、骨骼肌病理分析及基因检测,以研究家族性肢带型线粒体肌病患者的临床和病理特点,同时分析本家系致病基因突变位点。
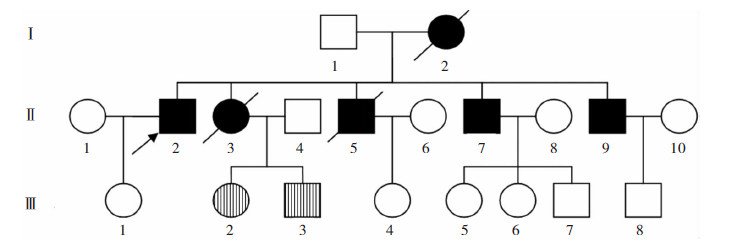
1 对象与方法 1.1 研究对象2014年07月至河南省人民医院就诊的一组家系,该家系3代共15名成员,出现症状的患者共6名(图 1)。
|
| 图 1 本文家系图谱。I、Ⅱ、Ⅲ表示家系三代,箭头标记为先证者,□表示健康男性,■表示患病男性,○表示健康女性,●表示患病女性,阴影表示无症状的携带者,斜线标记表示已去世。 |
该家系患病成员主要症状均表现为逐渐进展的肢带肌与躯干肌无力,及运动不耐受症状,起病隐匿,病情逐渐加重,肌肉无力从四肢近端及躯干肌起病,逐渐发展至四肢远端,无晨轻暮重,晚期出现呼吸困难症状,均无脑卒中、癫痫症状,无头痛,无肌阵挛及视网膜变性,无眼外肌麻痹,无吞咽困难,无肌肉疼痛。6名患者在当地医院诊断为进行性肌营养不良,均未治疗。其中,Ⅰ2、Ⅱ3、Ⅱ5三名患者分别于35岁、30岁和37岁发病,于72岁、44岁和52岁因呼吸困难、心慌等症状去世。Ⅱ2、Ⅱ7、Ⅱ9三名患者临床特点见表 1。
| 病例 | 性别 | 发病年龄 (岁) | 就诊年龄 (岁) | 病程 (年) | 临床症状 | |||||||||
| 颅面肌肌 力(级) | 颈肌肌 力(级) | 腰带肌肌 力(级) | 上肢近端 肌力(级) | 上肢远端 肌力(级) | 下肢近端 肌力(级) | 下肢远端 肌力(级) | 肌萎缩 | 呼吸 困难 | 心慌 | |||||
| Ⅱ2 | 男 | 47 | 61 | 14 | Ⅴ | Ⅱ | Ⅱ | Ⅱ | Ⅳ- | Ⅲ | Ⅳ- | 有 | 有 | 有 |
| Ⅱ7 | 男 | 50 | 54 | 4 | Ⅴ | Ⅳ | Ⅳ- | Ⅳ- | Ⅳ+ | Ⅳ- | Ⅳ+ | 无 | 有 | 有 |
| Ⅱ9 | 男 | 43 | 45 | 2 | Ⅴ | Ⅳ+ | Ⅳ- | Ⅳ | Ⅴ | Ⅳ | Ⅳ+ | 无 | 无 | 无 |
与家系成员签署知情同意书后,对家系成员进行详细的病史采集、体格检查,同时全面询问既往史、家系史、婚姻史、孕产史、个人史等情况。对现存三位患者Ⅱ2、Ⅱ7、Ⅱ9行血肌酸激酶检测、血乳酸检测、神经电生理及头部磁共振检查。
1.2.2 肌肉病理组织标本制备经充分与患者及家属沟通且患者及家属签署知情同意书后,对现存三位患者分别选取左侧肱二头肌进行活检。标本进行冰冻处理,切片行苏木精-伊红(hematoxylin-eosin,H-E)、改良Gomori三色(modified Gomori Trichrome,MGT)、琥珀酸脱氢酶(succinate dehydrogenase,SDH)、细胞色素c氧化酶(cytochrome c oxidase,COX)、还原型辅酶I-四氮唑还原酶(NADH-tetrazolium reductase,NADH-TR)、腺苷三磷酸酶(adenosine triphosphatase,ATPase)等常规组织化学染色,以及Dystrophin-N、Dystrophin-C、Dystrophin-R、Dysferlin、Sarcoglycan-α、Sarcoglycan-β、Sarcoglycan-γ、Sarcoglycan-δ等免疫组织化学染色。
1.2.3 分子遗传学检查患者及家属签署知情同意书后对现存三位患者及家系中其余成员均抽取外周血4 mL,采用DNA抽提试剂盒(北京天根生物技术有限公司)并按操作说明提取DNA,选取正常人DNA作为对照组。使用24对具有部分片段重叠的引物[3],其中针对A3243G突变设计的引物为:正向5’-CCTCCCTGTACGAAAGGACA-3’,负向5’-GCCTAGGTTGAGGTTGACCA-3’。PCR反应体积为50 μL,含Mix 25 μL,上游引物2 μL,下游引物2 μL,DNA模板5 μL,去离子水16 μL,94℃ 5 min→94℃ 30 s→55℃ 30 s→72℃ 1 min→72℃ 10 min,4℃保存,30个循环,1.5%琼脂糖凝胶电泳观察结果。PCR产物送上海生工生物公司行Sanger测序。
2 结果与分析 2.1 临床资料分析Ⅱ2、Ⅱ7和Ⅱ9三位患者血肌酸激酶均轻度升高,分别为369 U/L、280 U/L和270 U/L(正常值:10~190 U/L)。三位患者静息血乳酸均轻度升高,分别为3.8 mmol/L、3.6 mmol/L和3.3 mmol/L(正常值:0.5~2.0mmol/L);运动后即刻血乳酸明显升高,分别为11.2 mmol/L、8.2 mmol/L和8.1 mmol/L,运动后10 min血乳酸水平仍较高,分别为8.1 mmol/L、5.2 mmol/L和4.7 mmol/L。Ⅱ2、Ⅱ7和Ⅱ9三位患者神经电生理均提示肌源性损害,重复电刺激试验无衰减。Ⅱ2、Ⅱ7和Ⅱ9三位患者头颅磁共振均未见明显异常。
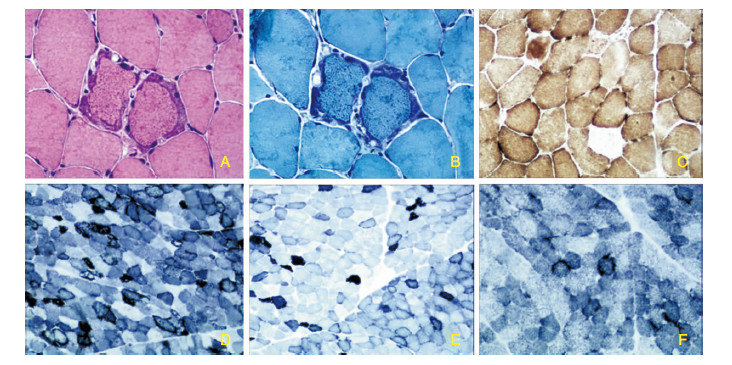
2.2 肌肉病理染色结果3位患者H-E染色、MGT染色均可见典型的RRF(图 2A、图 2B)。RRF在SDH染色中呈蓝色深染,亦被称为破碎蓝纤维(ragged-blue fibers,RBF),其在病理染色中最为灵敏。RRF在患者Ⅱ2、Ⅱ7、Ⅱ9中分别约占30%、10%和5%(图 2D、图 2E、图 2F)。RRF在COX染色中大部分是酶活性增强的,少部分为酶活性减弱或缺失(图 2C)。SDH染色中均未见琥珀酸脱氢酶高反应性血管(strongly succinate dehydrogenase reactive vessels,SSV)。ORO染色及PAS染色未见脂肪或糖原增多。免疫组织化学(dystrophin-N、dystrophin-C、dystrophin-R、dysferlin、sarcoglycan-α、sarcoglycan-β、sarcoglycan-γ、sarcoglycan-δ)均未见异常。
|
| 图 2 肌肉病理染色结果。A:H-E染色示RRF;B:MGT染色示RRF;C:COX染色示RRF酶活性增高或缺失;D:患者Ⅱ2 SDH染色示RRF大约占30%;E:患者Ⅱ7 SDH染色RRF大约占10%;F:患者Ⅱ9 SDH染色RRF大约占5%。 |
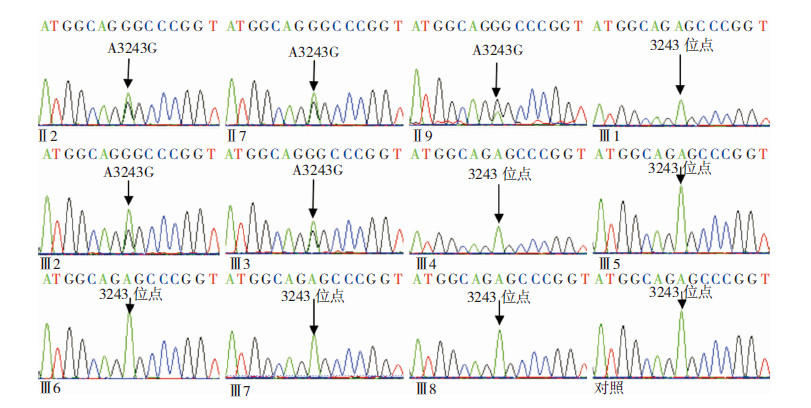
对3位患者及家系中其余人员进行的基因测序显示,患者Ⅱ2、Ⅱ7、Ⅱ9及家系中Ⅲ2、Ⅲ3均存在A3243G异质性突变且杂合峰高不同(图 3),家系其余成员未发现A3243G突变。
|
| 图 3 A3243G位点Sanger测序结果。 |
肢带型线粒体肌病相对少见,国内自2003年以来陆续有报道[4, 5, 6],儿童与成人均可发病,主要症状为肌肉无力及运动不耐受,受累部位多位于肢带肌和躯干肌,肢体近端重于肢体远端,也可累及眼外肌和延髓肌,可伴肌萎缩和肌张力降低。由于该病主要累及骨骼肌,而无中枢神经系统受累,因而极易误诊为进行性肌营养不良、多发性肌炎、脊肌萎缩症等疾病。本家系患者发病年龄为30~47岁,首发表现为躯干及肢体近端肌肉无力,运动不耐受,病情进行性加重,数年后肌无力进展至肢体远端,晚期出现心肌及呼吸肌受累,患者病史、体格检查及头部影像学排除脑部受累,临床特点与文献报道相似[1, 2, 4, 5, 6]。三位患者行肌肉活检的患者肌肉病理检查均可见典型RRF,且肌纤维内未发现大量脂肪滴沉积,排除了由于线粒体β氧化导致的脂肪累积病伴线粒体异常的可能性。对家系行线粒体基因检测,发现了mtDNA A3243G突变,因此诊断该家系患者为肢带型线粒体肌病。
Kamakura等[7]曾报道一例肢带型线粒体肌病反复出现呼吸衰竭,基因检测发现mtDNA A3243G突变。本家系患者晚期均出现了呼吸衰竭,说明此家系患者病变累及到了膈肌,这表明膈肌受累也是肢带型线粒体肌病的临床特点。本家系患者起病年龄为30~47岁,较其它相关报道的肢带型线粒体肌病患者的发病时间偏晚,有报道[6]发现某些肢带型线粒体肌病可转化为线粒体脑肌病,特别是早发型的肢带型线粒体肌病。我们推测晚发型的肢带型线粒体肌病不容易出现中枢神经系统受累。血清CK水平可反映肌纤维坏死程度。高珊珊等[5]总结了17例肢带型线粒体肌病的CK水平,发现除1例正常外,余16例CK均有不同程度增高。本家系患者血CK均轻度升高(270~369 U/L),提示肢带型线粒体肌病可存在轻度肌纤维坏死。血乳酸和运动乳酸试验对线粒体病的诊断有重大价值。本家系患者静息血乳酸水平均增高,运动后血乳酸明显升高,为正常值的4~5倍,运动后休息10 min血乳酸水平仍不能降低至正常。由此可见,血乳酸测定和运动乳酸试验可以辅助诊断肢带型线粒体肌病。国内外文献[1, 2, 4, 5, 6]报道,肢带型线粒体肌病神经电生理大多为肌源性损害,少部分为神经源性损害或神经源性肌源性混合性损害,有学者推测神经源性损害可能与神经肌肉接头处的肌纤维变性坏死有关。本家系3例患者神经电生理均呈肌源性损害,与文献报道相符。
RRF是线粒体病的特征性病理特点,虽然在老年男性或者代谢性中毒性肌病、肌营养不良等患者中有时也可以观察到RRF,但是数量很少且同时伴有各自病理学特征。Morgan-Hughes等[8]认为,RRF超过4%可以诊断线粒体肌病或脑肌病。本家系行肌肉活检的三名患者肌肉病理中均发现了典型的RRF,且结合临床来看,患者发病时间越长,肌无力程度越重,肌肉病理中RRF数量越多。国内高素琴等[4]通过对9例肢带型线粒体肌病研究,发现肢带型线粒体肌病患者肌肉病理中RRF数量与肌无力严重程度呈正相关。本报道首次在同一家系中进行研究,患者致病基因相同,排除了不同基因突变位点对病情严重程度产生的干扰。此外,国内外报道与本研究均未发现患者肌肉病理中的RRF数量与患者发病年龄、进展速度或CK水平有明显相关。由此可以推测,在肢带型线粒体肌病患者中,随着疾病的进展,肌无力程度逐渐加重,肌肉中RRF数量也逐渐增加。本家系3位患者骨骼肌COX染色中RRF以深染为主,少部分为酶活性缺失。一般认为RRF的产生是细胞能量供应下降、线粒体受刺激后增生并大量聚集的结果,是影响线粒体内蛋白质合成的mtDNA受损的形态学表现[9]。RRF使肌细胞中线粒体的数量增多,但是由于突变线粒体的功能异常,环氧化酶的活性降低或消失[10]。SSV提示小动脉的平滑肌细胞内线粒体异常增多,在线粒体脑肌病伴高乳酸及卒中样发作(MELAS)和肌阵挛性癫痫伴破碎红纤维综合征(MERRF)患者的肌肉活检中比较常见。国内高珊珊等[5]研究了18例肢带型线粒体肌病患者的肌肉病理,均未发现SSV。而赵丹华[6]等则认为肌肉病理检查中出现SSV的线粒体肌病患者易发展为线粒体脑肌病。我们推测肌肉病理中无SSV可能是肢带型线粒体肌病与线粒体脑肌病的不同之处,且SSV可能与线粒体病患者的中枢神经系统受累有关。
遗传异质性是线粒体病的特点,即同一临床表型可由不同的基因突变引起[11],肢带型线粒体肌病亦如此。目前国内外已报道的该病的致病性突变主要包括线粒体tRNA和CYTB基因突变[12],其中tRNA基因突变的种类最多,既可见于散发患者,也可见于家族性线粒体肌病患者,包括mtDNA A3243G突变、mtDNA A8344G突变、mtDNA A3276G突变和mtDNA A9567G突变等,其中以mtDNA A3243G突变最为常见[6]。为研究本家系致病基因突变位点,对患者行线粒体基因测序,本家系患者检测出mtDNA A3243G突变,与有关报道相符。mtDNA A3243G突变是最常见的线粒体脑肌病致病基因突变,可引起80%的线粒体脑肌病伴高乳酸血症和卒中样发作(mitochondrial encephalomyopathy with lactic acidosis and stroke-like episodes,MELAS),而引起的肢带型线粒体肌病罕见[6]。我们推测mtDNA A3243G突变的临床异质性与mtDNA突变比例有关,当mtDNA突变比例高时,临床表现为线粒体脑肌病,而mtDNA突变比例较低时,临床表现为肢带型线粒体脑肌病。这同时提示线粒体tRNA基因突变可能为家族性肢带型线粒体肌病的热点突变区域。
| [1] | Hirata K, Nakagawa M, Higuchi I, et al. Adult onset limb-girdle type mitochondrial myopathy with a mitochondrial DNA np8291 A-to-G substitution. J Hum Genet, 1999, 44(3):210-214. |
| [2] | Mori M, Momoi M Y. Pure mitochondrial myopathy. Nihon Rinsho, 2002, 60(suppl 4):302-305. |
| [3] | Rieder MJ, Taylor SL, Tobe VO, et al. Automating the identification of DNA variations using quality-based fluorescence re-sequencing:analysis of the human mitochondrial genome. Nucleic Acids Res, 1998, 26(4):967-973. |
| [4] | 高素琴,焉传祝,刘淑萍,等.单纯线粒体肌病九例的临床与病理研究.中华神经科杂志, 2003, 6(6):481-482. |
| [5] | 高珊珊.单纯型线粒体肌病及CPEO的临床、病理和预后随访研究.山东大学, 2008. |
| [6] | 赵丹华,栾兴华,陈彬,等.8例肢带型线粒体肌病患者的临床、病理特点和线粒体基因突变分析.中国神经免疫学和神经病学杂志, 2010, 17(5):334-337. |
| [7] | Kamakura K, Abe H, Tadano Y, et al. Recurrent respiratory failure in a patient with 3243 mutation in mitochondrial DNA. J Neurol, 1995, 242(4):253-255. |
| [8] | Petty RKH, Harding AE, Morganhughes JA. The clinical features of mitochondrial myopathy. Brain, 1986, 109 pt 5(6):915-938. |
| [9] | Fukuhara N, Tokiguchi S, Shirakawa K, et al. Myoclonus epilepsy associated with ragged-red fibres (Mitochondrial abnormalities):Disease entity or a syndrome. J Neurol Sci, 1980, 47(1):117-133. |
| [10] | Moraes C. The mitochondrial tRNA mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS):genetic, biochemical, and morphological correlations in skeletal muscle. Am J Hum Genet, 1992, 50(5):934-949. |
| [11] | 王朝霞,栾兴华,张英,等.97例线粒体肌病/脑肌病患者的线粒体DNA突变分析.中华医学杂志, 2008, 88(46):3254-3256. |
| [12] | Andreu AL, Bruno C, Shanske S, et al. Missense mutation in the mtDNA cytochrome b gene in a patient with myopathy. Neurology, 1998, 51(5):1444-1447. |
 2016, Vol. 43
2016, Vol. 43


