扩展功能
文章信息
- 孙红军, 田立桩, 荔志云
- 乳头状胶质神经元肿瘤1例报道
- 国际神经病学神经外科学杂志, 2015, 42(6): 527-529
- Disease Surveillance, 2015, 42(6): 527-529
-
文章历史
- 收稿日期: 2015-11-02
- 修回日期: 2015-12-17
乳头状胶质神经元肿瘤(papillary glioneuronal tumor,PGNT)是一种罕见的,发生在中枢神经系统幕上和侧脑室附近的肿瘤[1]。1998年 Komori等第一次描述并命名PGNT[2]。WHO 2007中枢神经系统肿瘤新分类标准中将PGNT单独列为八大肿瘤实体之一[3]。PGNT目前被认为起源于神经胶质前体细胞或神经上皮干细胞[4]。其具有良性生长过程,属于Ⅰ级神经胶质肿瘤[3]。目前国内外已报道了约68例[1]。本例瘤灶位置特殊,极易误诊,现将其报道,旨在提高对本病的进一步认识。
1 临床资料患者,男,32岁,主因“反复意识丧失伴肢体抽搐10余年”入院。患者于2003年无明显诱因突然出现意识丧失伴肢体抽搐,持续约半小时意识恢复,醒后对发作过程不能回忆,未治疗。1周后再次出现类似发作,持续约10余分钟,就诊于附近诊所,考虑“癫痫”,给予“卡马西平 0.1 g 口服 3/日”。此后仍间断发作,发作时表现为先是左侧肢体麻木、抽搐,再出现意识丧失伴全身抽搐,咬牙,1~2分钟后缓解,多次就诊于外院。2014年01月17日就诊于我院神经内科,行头颅MRI(图 1):额部大脑镰右侧见大小约3.0×2.6×3.5cm的肿块影,T1WI像呈低信号,T2WI像呈以高信号为主的混杂信号,FLAIR呈不均匀高信号,DWI呈等低混杂信号;肿块邻近额叶脑实质及胼胝体呈受压状,肿块以宽基底附着于大脑镰;增强扫描肿块不均匀明显强化;多考虑不典型脑膜瘤。心电图:先天性心脏病(室间隔缺损)。经治疗后症状好转出院。于2月11日,以“颅内占位性病变”收住我科。查体:生命体征平稳,神志清楚,全身浅表淋巴结未触及肿大;脑膜刺激征阴性,颅神经检查阴性;心脏各瓣膜听诊区均可闻及3/6级收缩期杂音,四肢肌力肌张力、腱反射正常,全身深浅感觉对称存在,病理征阴性。各项生化检查未见明显异常。初步诊断为“①颅内占位病变:脑膜瘤;②先天性心脏病;③症状性癫痫”。
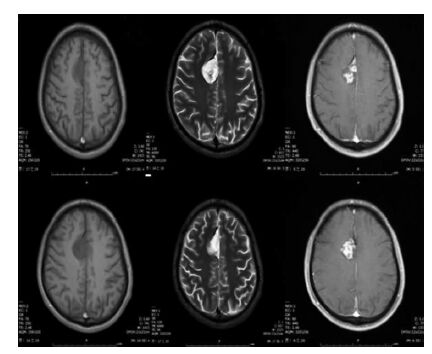
|
| 图 1 磁共振平扫与增强:T1加权像、T2加权像及MRI增强像。 |
手术所见:肿瘤紧贴大脑镰,位于脑实质外,大脑镰侧未见基底,未与大脑镰粘连,与脑组织间可见边界,软脑膜及部分脑组织被侵蚀,血液供应来源于脑实质侧,肿瘤质地稀软,血供丰富,有不完整包膜,色灰红。
组织病理学:HE染色观察(图 2中A-B):瘤组织局部细胞密度高,胞浆透亮,多核圆形,核大小不一致,深染,弥漫生长,伴微囊形成,部分呈海绵状,部分细胞梭形,交错排列。免疫组化(图 2中C~L):GFAP局部梭形细胞(+)(图C),NeuN(+)(图D),CD34血管(+)(图E),Vim(++)(图F),EMA(-)(图G),S-100(+++)(图H),Ki-67>10%(图I),Syn(+++)(图J),Cyclin D1(++)(图K),CD57(-)(图L)。病理诊断:(额部大脑镰右侧)乳头状胶质神经元肿瘤。
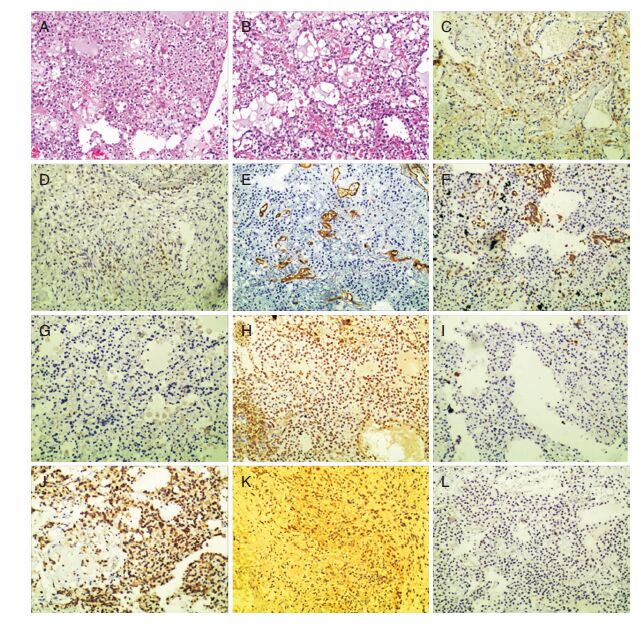
|
| 图 2 A、B(HE染色,×200):A.单层或假复层胶质细胞围绕透明混合性血管构成假乳头结构;B.胶质细胞与神经元混合存在。C-L(免疫组化染色,×200):瘤组织中GFAP、NeuN、CD34、Vim、EMA、S-100、Ki-67、Syn、Cyclin D1和CD57的表达。 |
PGNT作为混合胶质神经元肿瘤家族的一员,其具有乳头状结构和星形胶质细胞与神经元/神经细胞双向细胞群体的特征[1]。典型的颞叶病灶最常见的临床症状是癫痫发作,而其它部位的病变通常是头痛和非特异性体征和症状。目前国内外报道的病例,CT和MRI均显示幕上病变,由皮质延伸至白质,或可能更深层。Schlamann等[5]通过大宗病例荟萃分析发现,39%病例病灶呈囊性变,39%病例病灶呈囊实性混合病变,固体成分在增强片上呈弥漫性斑片状,囊性肿块内有壁结节或钙化斑块存在,增强MRI呈环状强化。目前报道的PGNT年龄范围为4~75岁(中位年龄23岁),肿瘤范围大小为1~9厘米(平均4.5厘米),由于瘤周水肿的影响使病变可能更大。免疫组化显示假乳头结构细胞GFAP和S-100均呈阳性[1]。相关研究发现,大多数情况下,PGNT存在Rosenthal纤维,增殖指数Ki-67低。近年来发现数例具有侵袭性,瘤细胞具有有丝分裂活跃、核分裂象、坏死及血管内皮细胞增值活跃,提示肿瘤并非都属Ⅰ级,可能还有更高级别的瘤体[6, 7, 8]。
本例PGNT由于缺乏典型影像学特征,极易误诊为脑膜瘤。本例PGNT与大脑镰旁脑膜瘤的鉴别难点是MRI,鉴别的要点是病理诊断,尤其是免疫组化。鉴别点:①MRI特征:本例PGNT以宽基底附着于大脑镰且胼胝体受压,极易误诊为大脑镰旁脑膜瘤。脑室周围PGNT的MRI典型表现[1]:瘤体生长位置较深,多起源于脑室周围白质,肿瘤周围可呈现水肿带;平扫呈长T1、长T2信号影,增强后瘤体实质部、囊壁以及壁结节呈明显强化。大脑镰旁脑膜瘤MRI表现[9]:基部位于大脑镰侧,邻近脑组织内凹呈锐角,与周围脑膜形成钝角,在MRI上基部沿硬脑膜侧呈鼠尾状影,称之为“脑膜尾征”;T1加权像多呈等信号或稍低信号影,增强后瘤体明显强化,边缘清晰,呈圆形、类圆形或哑铃状。②瘤体解剖位置特征:PGNT位于脑室周围白质深部,本例手术见大脑镰侧未见瘤基底,未与大脑镰粘连,软脑膜及部分脑组织被侵蚀,血液供应来源于脑实质侧,血供丰富,说明瘤体来源于脑实质深部。而大脑镰旁脑膜瘤来源于大脑镰侧的蛛网膜,其瘤基部位于大脑镰侧,瘤体可伸向脑实质或颅骨。③病理诊断:PGNT瘤组织中星形胶质细胞与神经元混合存在,以单层或假复层星形胶质细胞围绕透明混合性血管形成的假乳头结构为特征。PGNT免疫组化标记物GFAP、S-100阳性,Ki-67阳性率低。脑膜瘤瘤组织以蛛网膜帽状细胞为特征。脑膜瘤免疫组化标志物CD34、EMA、Ki-67、PR、S-100、Vimentin阳性[10]。
总之,不典型部位且影像学缺乏典型特征的PGNT极为罕见,极易误诊,尤其是脑膜瘤,初诊时必须考虑其它诊断。本病诊断与鉴别诊断,主要依靠病理诊断,尤其是免疫组织化学染色。通过本病例报道,希望广大临床医师充分重视。
| [1] | Carangelo B, Arrigucci U, Mariottini A, et al. Papillary glioneuronal tumor: case report and review of literature. G Chir, 2015, 36(2):63-69. |
| [2] | Komori T, Scheithauer BW, Anthony DC, et al. Papillary glioneuronal tumor: a new variant of mixed neuronal-glial neoplasm. Am J Surg Pathol, 1998, 22(10): 1171-1183. |
| [3] | Thurnher MM. 2007 World Health Organization classification of tumours of the central nervous system. Cancer Imaging, 2009, 9 Spec No A:S1-3. |
| [4] | Govindan A, Mahadevan A, Bhat DI, et al. Papillary glioneuronal tumor:evidence of stem cell origin with biphenotypic differentiation. J Neurooncol, 2009, 95(1):71-80. |
| [5] | Schlamann A, von Bueren AO, Hagel C, et al. An individual patient data meta-analysis on characteristics and outcome of patients with papillary glioneuronal tumor, rosette glioneuronal tumor with neuropil-like islands and rosette forming glioneuronal tumor of the fourth ventricle. PLoS One, 2014, 9(7):e101211. |
| [6] | Adam C, Polivka M, Carpentier A, et al. Papillary glioneuronal tumor:not always a benign tumor. Clin Neuropathol, 2007, 26(3):119-124. |
| [7] | Newton H B, Dalton J, Ray-Chaudhury A, et al. Aggressive papillary glioneuronal tumor:case report and literaturereview]. Clin Neuropathol, 2008, 27(5):317-324. |
| [8] | Javahery R J, Davidson L, Fangusaro J, et al. Aggressivevariant of laryglioneuronal tumor. Report of 2 cases. J Neurosurg Pediatr, 2009, 3 (1):46-52. |
| [9] | Saloner D, Uzelac A, Hetts S, et al. Modern meningioma imaging technigues. J Neurooncol, 2010, 99(3):333-340. |
| [10] | Ding Y, Qiu L, Xu Q, et al. Relationships between tumor microenvironment and clinicopathological parameters in meningioma. Int J Clin Exp Pathol, 2014, 7(10):6973-6979. |
 2015, Vol. 42
2015, Vol. 42

