扩展功能
文章信息
- 贺龙, 王莎, 柳红艳, 贺恒旺, 郭艳峰, 智孔亮, 袁世君, 代巧英
- HE Long, WANG Sha, LIU Hongyan, HE Hengwang, GUO Yanfeng, ZHI Kongliang, YUAN Shijun, DAI Qiaoying
- 鞍区肿瘤术后、重度颅脑损伤合并中枢性尿崩症的早期临床诊断意义及预后分析
- Analysis on early diagnosis and prognosis of central diabetes insipidus caused by sellar tumor surgery or severe traumatic brain injury
- 国际神经病学神经外科学杂志, 2015, 42(6): 515-518
- Disease Surveillance, 2015, 42(6): 515-518
-
文章历史
- 收稿日期: 2015-09-17
- 修回日期: 2015-12-07
中枢性尿崩症(Central diabetes insipidus,CDI)是鞍区肿瘤术后较为常见的并发症,此外颅脑损伤也易导致中枢性尿崩症的发生,其主要是由于水钠失衡引起,且严重影响患者预后[1]。根据尿量增多时间,CDI分为短暂性尿崩症、持续性尿崩症以及三相性尿崩症三种诊断类型[2]。临床研究显示[3],尿崩症与抗利尿激素(Antidiuretic hormone,ADH)合成、分泌障碍有关。目前,对于不同诊断类型尿崩症患者的早期诊断指标变化以及预后分析如何等研究报道较少。本研究旨在探讨鞍区肿瘤术后、重度颅脑损伤合并中枢性尿崩症不同诊断类型的早期临床诊断意义及预后分析。报道如下:
1 资料与方法 1.1 一般临床研究资料研究对象为2008年3月至2014年8月在我院神经外科收治的鞍区肿瘤术后与重度颅脑损伤患者,其中鞍区肿瘤术后患者27例,重度颅脑损伤患者21例,所有患者合并中枢性尿崩。根据相关文献CDI的诊断标准为[4]:①患者24 h尿量在5000至12000 ml之间,平均尿量在8800 ml;②尿比重在1.005以下,尿量在250 ml/h及以上;③血清钠在135 mmol/L及以上,尿钠在130 mmol/24h以下;④患者出现烦渴、多饮多尿、精神乏力萎靡且伴有烦躁不安;⑤高渗盐以及禁水试验无效,从而排除脑性盐耗及抗利尿激素不适当分泌综合征患者。根据诊断标准入选的48例CDI患者中男38例,女10例,年龄在9~63岁(平均年龄在33.7岁)。重度颅脑损伤患者中有颅底骨折18例,脑挫伤患者11例,单纯硬膜外血肿患者1例,脑挫伤合并硬膜外血肿患者2例。鞍区肿瘤术后患者,病理组织经检验证实垂体腺瘤21例,Rathke囊肿1例,鞍区脑膜瘤2例,颅咽管瘤3例,所有颅脑外伤患者格拉斯哥昏迷评分(GCS)在8分以下。根据中枢性尿崩症的分型诊断[5]:(1)短暂性尿崩症,即患者术后或颅脑损伤后当即发生,持续1周左右尿量恢复至正常水平;(2)持续性尿崩症,即患者在术后或颅脑损伤后1~6 d出现,症状较为严重,持续伴较重的电解质紊乱,持续2周以上,期间患者略有好转,但并不能恢复至正常;(3)三相性尿崩症,三相即为急性期、中间期和持续期。患者在急性期尿量陡然增加,持续5d左右,在中间期尿量减少,持续5 d左右,随后进入持续期。本研究按照中枢性尿崩症的分型诊断标准分为短暂性尿崩症组(A组)患者20例,持续性尿崩症组(B组)患者22例,三相性尿崩症组(C组)患者6例。三组患者在性别构成比、年龄以及GCS评分方面无统计学差异,数据具有可比性。
1.2 实验室检测患者于确诊后第1 d至第30 d,均需予以24 h尿量检测,检验人员每8 h检测一次血钠浓度以及血渗透压。检测患者每天24 h尿钠浓度、24 h尿渗透压以及尿相对密度,血浆心钠肽含量(ANP)。比较治疗时、治疗后患者上述指标变化。
患者在确诊后第1 d至第15 d检测血浆中抗利尿激素含量。确诊后的次日为第1 d,在第1~15 d内每日清晨抽取静脉血5 ml,置于含有抑肽酶的试管内,以3500 r/min的速度离心,在-40℃冰箱中保存备用。血浆中ADH采用放射免疫法进行测定。
1.3 治疗方法对于颅脑损伤患者需要给予积极治疗,鞍区肿瘤术后患者需要给予相应治疗,此外早期补足与尿量相当的液体,根据患者的伤身体状况以及检测情况合理补充钾、钠以及钙等,维持患者水以及电解质的平衡。3例早期症状较轻的患者,嘱咐饮水同时给予氢氯噻嗪片25 mg/次或者卡马西平0.20 g/次,每天3次,治疗时间在5 d以内,平均治疗时间在3.6 d。37例患者均口服氢氯噻嗪或卡马西平无效,患者持续尿量在4000 ml/24 h以上或者200 ml/h以上时,则采用皮下或者肌注垂体后叶素6 U/次,2~3次/d,治疗5~7 d,平均治疗时间在5.6 d。8例患者出现永久性尿崩,口服1-脱氨-8-右旋-精氨酸加压素(DDAVP)0.05 mg~0.2 mg/次,每天1~3次。
1.4 预后分析治疗6个月后,采用格拉斯哥预后评分(GOS评分)评价鞍区肿瘤术后、重度颅脑损伤患者预后情况,同时评价不同诊断类型中枢性尿崩患者预后情况。随访患者一年,观察患者生存情况。
2 统计学方法处理采用SPSS 19.0中文版统计软件包对各项数据进行统计分析,对于计量资料采用均数标准差(x±s),两组数据之间采用t检验比较,采用Kaplan Meier法进行生存分析,采用Cox风险比例模型分析中枢性尿崩与各检测指标的相关性,所有数据均以P<0.05为差异具有统计学意义。
3 结果 3.1 CDI治疗结束前后实验室检测指标情况研究结果显示,治疗开始时,A组患者24 h尿钠及24 h尿量与B组、C组相比,差异具有统计学意义(P<0.05);治疗结束后,A组、C组在血钠、血渗透压、24尿钠及24 h尿量均降低,同治疗时比较,差异具有显著性意义(P<0.05或P<0.01);治疗后A组、C组血渗透压,24 h尿钠均低于B、C组(P<0.05),见表 1。
| 时间 | 组别 | 血钠(mmol/L) | 血渗透压[mOsm/(kg·H2O)] | 24 h尿钠(mmol/24 h) | 24 h尿量(ml/24 h) | ANP(ng/ml) |
| 治疗开始时 | A组 | 182(87~298) | 361(227~469) | 368(214~512) | 7295(2597~9964) | 1.05±0.24 |
| B组 | 157(69~267) | 357(289~473) | 266(149~407) | 4221(2014~7036) | 1.12±0.27 | |
| C组 | 178(89~288) | 337(201~497) | 355(204~508)## | 7018(2388~7592)# | 1.09±0.19 | |
| 治疗结束后 | A组 | 138(67~227)▲ | 301(187~435)▲ | 240(99~399)▲▲ | 3169(1024~4367)▲ | 0.97±0.11 |
| B组 | 156(78~243) | 381(191~499)▲ | 278(112~437) | 3795(2877~5437)▲ | 0.98±0.10 | |
| C组 | 152(78~240)▲ | 398(199~466)#▲ | 267(107~428)▲▲ | 3967(2886~7069)#▲ | 0.97±0.12 | |
| 注:与A组比较,P<0.05,P<0.05;与B组比较,#P<0.05,##P<0.05;与治疗开始时比较,▲P<0.05,▲▲P<0.05 | ||||||
治疗后经GOS评分,C组、B组4分及以下患者例数明显高于A组(P<0.05),而5分均低于A组(P<0.05),而GOS平均分方面两组无显著性差异(P>0.05),C组在3分以下患者例数明显高于B组,而5分明显低于B组(P<0.05),见表 2。
| 组别 | GOS评分 | |||
| 3及分以下[n(%)] | 4分[n(%)] | 5分[n(%)] | 平均分 | |
| A组 | 0 | 2(10.00) | 18(90.00) | 4.9±0.1 |
| B组 | 5(22.73) | 12(54.55) | 5(22.73) | 4.2±0.5 |
| C组 | 3(50.00)# | 3(50.00) | 0# | 3.7±0.6 |
| 注:与短暂性尿崩症组比较,P<0.05;与持续性尿崩症组比较,#P<0.05 | ||||
A组血平均ADH含量在第3 d将至最低,为术前血浆ADH水平的32.20%,术后第4 d ADH上升,至第10 d恢复至术前水平;B组ADH在第8天将至最低,为术前水平的29.17%,术后第9 d开始上升,但2周后仍低于术前水平;C组ADH在术后第3 d降到术前水平的49.87%,随后开始上升,至第8 d后开始下降,于第12 d下降至术前水平的45.83%,2周内未恢复至术前水平,见图 1。
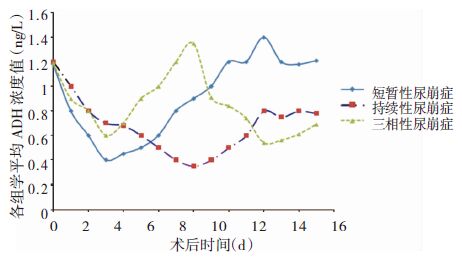
|
| 图 1 三组CDI患者血清ADH浓度变化情况 |
患者随访1年,其中A组患者生存状况良好,与B组患者死亡患者3例(13.63%)、C组患者死亡患者3例(50.00%)相比较,差异有统计学差异(P<0.05),见图 2。
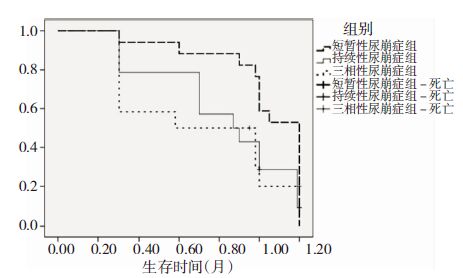
|
| 图 2 三组患者Kaplan-Meier生存曲线 |
随访后1年,以CDI预后好坏为因变量(1好,0坏),其中GOS评分在3及以下者为坏,4及以上为为好,另以性别、年龄以及实验室指标等为自变量进行Logistic回归分析,结果显示,年龄、脑水肿、ADH、尿量为CDI预后的影响因素(P<0.05),见表 3。
| 因素 | β | S.E. | χ2值 | OR值 | 95%CI | P值 |
| 年龄 | 0.57 | 0.74 | 11.63 | 2.89 | 1.34~7.79 | 0.009 |
| 性别 | 0.17 | 0.35 | 1.21 | 1.13 | 0.93~2.26 | 0.089 |
| 脑水肿 | 0.49 | 0.66 | 7.36 | 2.41 | 1.43~9.39 | 0.025 |
| ADH | 0.81 | 0.89 | 8.69 | 2.28 | 1.25~6.2 | 0.019 |
| 血渗透压 | 0.22 | 0.36 | 1.13 | 0.73 | 0.69~1.97 | 0.078 |
| 血钠 | 0.46 | 0.61 | 2.24 | 0.98 | 0.81~2.79 | 0.052 |
| 尿量 | 0.67 | 0.76 | 5.78 | 1.33 | 1.07~4.75 | 0.042 |
| ANP | 0.24 | 0.43 | 1.24 | 0.87 | 0.56~1.88 | 0.065 |
尿崩症是由于ADH分泌和释放不足或者是患者肾脏组织对抗利尿激素反应不敏感甚至缺陷导致尿量明显增多、尿崩的临床综合症状[6]是鞍区肿瘤术后患者较为常见的并发症[7]。ADH也被称之为精氨酸血管加压素或者血管加压素,其主要由下丘脑视上核的大细胞神经元合成、释放。研究显示,鞍区出现肿瘤时将累及下丘脑视上核,从而导致ADH分泌受阻,视上核内的神经元细胞即使剩余在10%左右,也能够维持ADH的需要,但当神经元细胞少于10%时便会引起CDI,因此神经元细胞数量与鞍区肿瘤症状严重程度有一定关系[8]。在我们的研究中垂体腺瘤患者为21例(21/27,77.78%),其为导致CDI最为常见的鞍区肿瘤之一。重度颅脑损伤所导致的中枢性尿崩症为继发性尿崩症,也是由于下丘脑视上核损伤后导致神经内分泌功能紊乱,从而引起ADH分泌不足。CDI根据尿量增多时间分为短暂性尿崩症、持续性尿崩症以及三相性尿崩症。有研究证实[11],损伤的部位不同产生的尿崩症类型也不尽相同,如鞍区肿瘤在鞍膈以上,则易出现永久性尿崩症。垂体柄出现不可逆损伤时,导致下丘脑神经元分泌缺陷或功能障碍,引起ADH分泌不足,导致持续性尿崩症的发生[12]。三相性尿崩症患者在临床上较为少见,多见于颅咽管瘤术后。本研究发现6例(12.5%)。通过本研究显示,短暂性尿崩症患者ADH在治疗后第10d开始上升,而持续性、三相性尿崩症患者在治疗2周内均未恢复至术前水平,而通过随访研究也显示,持续性、三相性尿崩症患者预后评分也低于短暂性尿崩症患者组。临床研究已经证实早期诊断尿崩症的类型有助于患者预后。通过随访1年后患者各项指标,显示年龄、脑水肿、ADH、尿量为中枢性尿崩症的影响因素,说明ADH在临床诊断上的重要性。以往已经有研究报道证实,ADH与中枢性尿崩症有一定的关系,通过本研究也说明了ADH在尿崩症中的变化,尤其是治疗前后也存在一定的变化,说明其在中枢性尿崩症的重要诊断价值。通过本研究发现,持续性尿崩症、三相性尿崩症患者出现死亡的可能性高于短暂性尿崩症患者,原因可能是永久性尿崩症易导致机体各种电解质出现紊乱,引起神经元细胞出现萎缩、凋亡,进而造成损伤进一步严重,引起死亡。
综上,鞍区肿瘤术后、重度颅脑损伤合并CDI患者的预后与血清ADH水平、24小时尿量有一定的相关性,不同类型CDI预后生存状况存在一定差异。
| [1] | Ghirardello S,Hopper N, Albanese A, et al. Diabetes insipidus in craniopharyngioma: postoperative management of water and electrolyte disorders. J Pediatr Endocrinol Metab, 2006,19(Suppl 1):413. |
| [2] | Verbalis JG. Management of disorders of water metabolism in patients with pituitary tumors. Pituitary,2002,5(2):119-132. |
| [3] | John CA,Day MW. Central neurogenic diabetes insipidus, syndrome of inappropriate secretion of antidiuretic hormone, and cerebral salt-wasting syndrome in traumatic brain injury. Critical care nurse, 2012, 32(2):e1-e7. |
| [4] | 顾锋,金自孟,张殿喜,等. 中枢性尿崩症408例的病因及临床特点分析.中华医学杂志,2001,81(19):1166-1174. |
| [5] | Asano T, Yamada H, Yoshida M, et al. Hypothalamic type of hypopituitarism and central diabetes insipidus probably linked to Rathke's cleft cyst. Internal medicine, 2015, 54(8):293-301. |
| [6] | 胡德志,江澄川,高辛. 尿-血渗透压比值和尿-血钠浓度比值的监测对颅脑损伤后尿崩综合征的意义.中华急诊医学杂志,2005,14(2):103-106. |
| [7] | Stewart TC,Alharfi IM,Fraser DD. The role of serious concomitant injuries in the treatment and outcome of pediatric severetraumatic brain injury. The journal of trauma and acute care surgery,2013,75(5):836-842. |
| [8] | 张金男,高宇飞,赵丛海,等. 神经外科术后中枢性尿崩症ADH变化曲线及其临床意义.吉林大学学报.医学版,2006,32(6):1087-1090. |
| [9] | Verbalis JG. Management of disorders of water metabolism in patients with pituitary tumors. Pituitary, 2002, 5 (2):119-132. |
| [10] | Fukino K,Yamada S, Ohta T, et al. Serial M R intensity changes of the posterior pituitary in patient s with diabetes insipidus after transsphenoidal surgery for pituitary adenom as: report of two cases. Pituitary, 2003, 6 (4):215-219. |
| [11] | Goudakos JK,Markou KD,Georgalas C. Endoscopic versus microscopic trans-sphenoidal pituitary surgery: a systematic review and meta-analysis.Clin Otolaryngol, 2011,36(3):212-220. |
| [12] | Nakamura F, Kishimoto Y, Handa T, et al. Myelodysplastic syndrome with central diabetes insipidus manifesting hypodipsic hypernatremia and dehydration. American journal of hematology, 2004, 75(4):213-216. |
 2015, Vol. 42
2015, Vol. 42
