扩展功能
文章信息
- 江礼宾, 牛朝诗, 鲍得俊, 丁宛海, 邓大丽
- JIANG Li-bin, NIU Chao-shi, BAO De-Jun, DING Wan-hai, DENG Da-li
- 神经电生理监测技术在圆锥马尾病变手术中的应用
- Application of intraoperative neurophysiological monitoring in surgery for cauda equina and conus medullaris lesions
- 国际神经病学神经外科学杂志, 2015, 42(6): 510-514
- Disease Surveillance, 2015, 42(6): 510-514
-
文章历史
- 收稿日期: 2015-10-09
- 修回日期: 2015-12-15
2. 安徽省脑立体定向神经外科研究所, 安徽 合肥 230001
2. Anhui Provincial StereotacticNeurosurgical Institute, Hefei, Anhui Province, 230001
由于脊髓圆锥周边有较多马尾神经,当出现病变时,常造成圆锥和马尾共同的损害,故将发生在该部位的病变统称为圆锥马尾病变[1]。圆锥马尾病变手术易损伤马尾神经,难度较大。为了减少术后并发症、保护脊髓神经功能,神经电生理监测技术得到了越来越广泛的应用。2009年3月至2014年4月安徽医科大学附属省立医院神经外科收治圆锥马尾病变患者110例,均采用神经电生理监测下显微外科手术,现总结如下:
1 资料与方法 1.1 一般资料本组圆锥马尾病变手术110例,其中男性57人,女性53人;年龄10~79岁,平均47.4岁;相关临床资料见表 1。
| 临床表现 | 腰痛或下肢疼痛 | 91例 |
| 下肢无力 | 42例 | |
| 感觉障碍 | 63例 | |
| 大小便功能障碍 | 35例 | |
| 性功能障碍 | 3例 | |
| 病理类型 | 神经鞘瘤 | 66例 |
| 神经纤维瘤 | 5例 | |
| 脊膜瘤 | 7例 | |
| 室管膜瘤 | 8例 | |
| 星形细胞瘤 | 4例 | |
| 畸胎瘤 | 2例 | |
| 上皮样囊肿 | 2例 | |
| 脂肪瘤 | 1例 | |
| 大B细胞淋巴瘤 | 1例 | |
| 转移癌 | 1例 | |
| 小圆细胞恶性肿瘤 | 1例 | |
| 囊肿 | 10例 | |
| 纤维组织增生钙化 | 2例 | |
| 病变部位 | 髓外硬膜内病变 | 77例 |
| 髓内病变 | 21例 | |
| 髓外硬膜外病变 | 11例 | |
| 髓外硬膜内外病变 | 1例 |
采用气管内插管,尽量不用肌松药物,仅在麻醉诱导阶段应用肌松药罗库溴铵,手术开始时停用。患者取侧卧位或俯卧位,根据病变定位取腰骶部直切口,显微镜下操作。
1.3 神经电生理监测方法采用加拿大Xltek EPWorks 36通道术中神经电生理监测系统,监测手段包括体感诱发电位(somatosensory evoked potential,SEP)、运动诱发电位(motor evoked potential,MEP)和肌电图(electromyography,EMG),术中同时进行下肢MEP+SEP+电刺激器触发EMG监测。
SEP:刺激针电极置于双侧内踝后侧方胫后神经,记录电极置于头顶C3和C4点(按照国际脑电图学会制定的10/20导联系统),主要为P37、N45。术中持续监测SEP的变化,以手术开始时的SEP为基线,术中SEP与之比对。以波幅降低50%或潜伏期延长10%作为报警标准[2]。
MEP:采用经颅电刺激,螺旋电极置于皮质足投射区,即10/20导联系统的C1/C2,互为参考电极,记录电极置于腓肠肌、括约肌等。MEP监测过程中出现波幅下降50%,潜伏期增加2.5ms,即具有警示意义。
EMG:记录电极置于肿瘤所在节段的神经根相应支配的肌肉中,如股四头肌、腓肠肌、肛门括约肌等,持续应用EMG监测(自发性EMG)。对于可疑的组织结构使用单极或双极电刺激器直接刺激记录激发EMG,明确脊髓、神经根的位置以及与病变的解剖关系,避免误伤。以自发和激发EMG监测过程中出现爆发性和(或)持续性肌电活动进行实时报警。
1.4 统计学方法按脊髓神经功能改善情况将患者分成三组,对每组患者神经电生理监测指标进行自身比较,检测结果采用SPSS 17.0统计软件分析。各项监测指标均以x±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果 2.1 术中神经电生理监测17例患者术中出现SEP报警,积极寻找原因,减少对脊髓及神经刺激或压迫后 10~20 min,15例患者SEP 波幅渐渐恢复正常后继续手术,另外2例经积极处理30 min后波幅虽恢复至20%以下,但继续手术后波幅再次降低超过50%,故停止手术。12例患者术中出现MEP报警,经过暂停手术处理后,其中10例MEP恢复正常,2例未恢复,术后下肢肌力无改善。57例患者术中出现自发性EMG报警,经减少牵拉、停用电刀及电凝等处理后报警消失,应用激发EMG进行神经根定位,确定“安全地带”,其中16例因病变与周围脊髓神经粘连紧密而采取了大部分切除,保护了脊髓功能。
2.2 肿瘤切除程度(表 2,图 1)显微镜下病变全切除92例(83.6%),次全或大部分切除18例(%)。
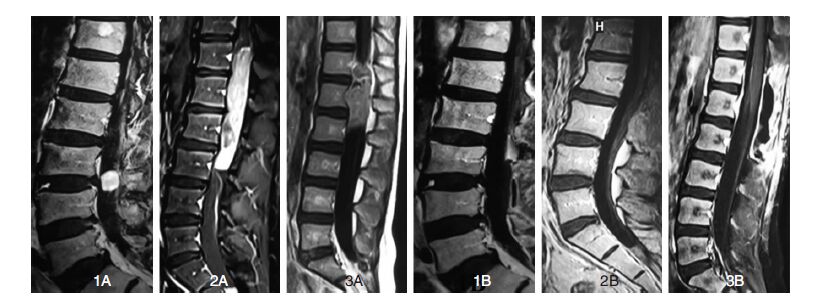
|
| 1A神经鞘瘤术前,1B室管膜瘤(WHOⅡ级)术前,1C小圆细胞恶性肿瘤术前 2A神经鞘瘤术后,2B室管膜瘤(WHOⅡ级)术后,2C小圆细胞恶性肿瘤术后 图 1 圆锥马尾病变术前术后影像学 |
| 切除程度 病变位置 | 髓外硬膜内病变(77例) | 髓内病变(21例) | 硬膜外病变(11例) | 硬膜内外病变(1例) | 总计(110例) |
| 全切除例数 | 73(94.8%) | 11(52.4%) | 8(72.7%) | 1(100%) | 92(83.6%) |
| 次全/大部分切除例数 | 4(5.2%) | 10(47.6%) | 3(27.3) | 0 | 18(16.4%) |
术后随访1~58个月,神经系统查体及JOA评分发现脊髓神经功能改善102例(92.8%),无变化4例(3.6%),下降4例(3.6%)。对102例脊髓神经功能改善的患者自身监测指标进行比较,病变切除前后,SEP潜伏期以及MEP潜伏期都缩短,SEP波幅上升,差异有统计学意义(P<0.05);4例脊髓神经功能无变化的患者,病变切除前后上述指标差异无统计学意义(P>0.05);4例脊髓神经功能下降的患者,病变切除前后上述指标差异有统计学意义(P<0.05)(见表 3)。由此可见,神经电生理监测指标的变化与术后脊髓神经功能改善情况基本相吻合。
| 脊髓神经功能改善情况 | 神经电生理监测指标 | 病变切除前 | 病变切除后 | P值 |
| 改善(102例) | SEP潜伏期(ms) | 44.31±2.12 | 40.64±2.31 | P<0.05 |
| SEP波幅(μV) | -3.42±0.65 | -5.59±1.86 | P<0.05 | |
| MEP潜伏期(ms) | 46.17±2.41 | 40.24±3.68 | P<0.05 | |
| 无变化(4例) | SEP潜伏期(ms) | 42.66±1.79 | 42.91±2.42 | P>0.05 |
| SEP波幅(μV) | -4.28±1.17 | -4.67±0.98 | P>0.05 | |
| MEP潜伏期(ms) | 45.63±1.65 | 46.03±2.65 | P>0.05 | |
| 下降(4例) | SEP潜伏期(ms) | 43.73±1.79 | 46.87±2.03 | P<0.05 |
| SEP波幅(μV) | -4.15±1.08 | -2.74±1.13 | P<0.05 | |
| MEP潜伏期(ms) | 45.73±1.95 | 49.63±3.28 | P<0.05 |
马尾圆锥部已无脊髓实质,马尾神经主要支配下肢、会阴部和泌尿生殖器,故该段肿瘤病变常引起其支配部位的运动感觉及括约肌功能障碍,如下肢感觉障碍、大小便功能障碍等,神经根痛为本病最常见的首发症状[3]。本组病例中首发症状为腰痛或下肢疼痛的有91例(82.7%)。对于圆锥马尾部肿瘤,手术切除是公认的最有效的治疗方法。边界较清的肿瘤,如室管膜瘤、神经鞘瘤等,手术全切除是最佳治疗方案[4]。但手术操作过程中将会涉及到重要的脊髓感觉和运动传导通路[5],因此术中脊髓神经结构和功能完整性也就成为治疗成败的关键。而神经电生理技术可以提供脊髓神经的功能定位与监测。
常用术中监测方法有运动诱发电位(motor evoked potential,MEP)、体感诱发电位(somatosensory evoked potential,SEP)和肌电图(electromyography,EMG)。
SEP是最早应用于临床的术中监测技术,具有快捷、灵敏、方便等特点。SEP的改变不但可以直接反映损伤同侧脊髓感觉通路传导状态,而且还可以间接反映同侧脊髓运动通路的状况[6],潜伏期及波幅与脊髓损伤程度密切相关,对脊髓功能的保护安全有效,并且能够为评价手术效果和预后提供客观依据。对于髓内圆锥肿瘤,由于肿瘤侵袭使得脊髓膨胀、扭曲、解剖结构受损,后正中沟难以辨认,连续监测SEP,有助于后正中沟的辨认[7]。但SEP也存在其局限性。SEP不能监测下行的运动纤维,易受吸入麻醉影响,且手术操作使脊髓受到冲击、震动、触压、牵拉等都可引起 SEP不同程度的变化,从而出现“假阳性”(SEP 术中发生变化,但术后功能无改变)。由于SEP对运动传导束的功能仅是间接反应,当脊髓前动脉受累等导致运动传导束受损,而感觉传导束受影响较小时,记录的SEP结果可以正常;SEP刺激的是混合性周围神经,当单个脊神经根受损,记录的SEP结果也可以正常,从而出现“假阴性”(神经功能已有改变,但SEP术中无变化)。
MEP主要反映躯体运动通路的功能与完整性,特别是最易受损的脊髓前角运动神经元的功能状态,可以对脊髓缺血作出快速反应[8]。MEP 的波幅是提示脊髓损伤可靠而灵敏的指标,在监测脊髓损伤时,MEP比SEP更敏感,稳定性和可靠性更强[9]。MEP直接反应皮质脊髓束的功能状态,但外周记录的肌肉由多根脊神经根参与支配,因此单纯应用MEP也不能正确反应脊髓后索和脊神经根功能[10]。
EMG直接反应支配该肌肉的神经根的功能状态,包括自发EMG和激发EMG。自发EMG是在正常状态下通过表面电极或针电极记录肌肉静息电活动,所记录的肌电图为“平线”,当术中对神经有牵拉等刺激时就会引起该神经所支配的肌肉收缩产生动作电位;激发EMG是有目的地电刺激外周或脊髓神经根,使神经所支配的肌肉收缩。但EMG不能很好地监测脊髓功能。
各种监测方法都有自身的优缺点,研究表明[11]单独SEP监测,监测敏感性为90%,联合MEP监测,监测敏感性高达98.5%。本组患者就采用了下肢MEP+SEP+电刺激器触发EMG联合应用,不但可以全面地监测脊髓功能,还可以尽量避免监测过程中假阳性、假阴性的发生,互相弥补不足[12]。
本组110例圆锥马尾病变患者均在神经电生理监测进行显微外科手术,SEP和MEP全面监测脊髓功能,EMG评估脊髓、神经根的位置以及与病变的解剖关系,并对病变周围的脊髓和神经根进行“预警”,确定切除范围。联合监测相关指标改变的趋势与患者术后脊髓神经功能改善情况具有一致性。
由于圆锥马尾部位空间较大,出现症状时病变多已长时间生长、体积较大,对神经压迫较重,肿瘤与神经根广泛黏连,甚至包裹神经根,神经根失去正常的光泽与形态,呈片状或索条状,导致术中难以分辨。对于这类手术,我们将EMG作为术中监测的重点。采用自发EMG及激发EMG对神经根进行实时监测与定位,辨别神经根及其走行,确定手术切除的安全范围,可最大程度地保护神经不受损伤,对分离组织施加明显高于刺激阈值的刺激量仍未有肌电活动,则认为此组织不是神经组织,可以切断。本组患者中16例通过EMG监测和激发EMG定位,确定病变与周围脊髓神经粘连紧密而采取了大部分切除,避免了脊髓和神经根损伤。部分髓内病变与周围界限不清,即便是在显微镜下也难以分辨,如何判断病变切除范围成为手术者面临的难题。如果切除范围过小,无法解除肿瘤压迫,影响治疗效果;如果切除范围过大,则可能导致脊髓损伤,产生严重后果。对于这类手术,我们将SEP和MEP应作为术中监测的重点,及时提示手术者采取措施,防止对脊髓造成不可逆的损伤[13]。本组病例中,12例髓内病变患者术中出现MEP报警,其中10例在采取补救措施后MEP恢复正常,2例虽采取补救措施,但直至手术结束MEP也未恢复,这可能与SEP和MEP有一定的滞后有关,报警时神经损伤可能已经发生。
另外,麻醉药物,尤其是肌松剂对神经电生理监测的结果也有影响[14]。因此本组病例中采用气管内插管,使用异丙酚、瑞芬太尼、依托咪酯等静脉麻醉药物,尽量不用肌松药物,以免影响电生理监测结果。仅在麻醉诱导阶段一次性应用肌松药罗库溴铵,手术开始时停用。
通过本组病例的研究,我们对于圆锥马尾病变手术中神经电生理监测总结以下几点:①在圆锥马尾手术中,显微技术联合神经电生理监测技术能够实时监测和定位脊髓、神经根的位置以及与病变的解剖关系,实现“神经根解剖和功能”融合,从而达到尽可能完整保留神经功能基础上实现病变最大安全切除;②手术危险阶段主要是:切开硬脊膜及肿瘤包膜时、分离肿瘤包膜与脊髓神经时,术者需利用神经电生理辨别脊髓和神经根的位置、走向,确定安全范围,才能进行手术操作;③显微镜下操作要轻柔,尽量锐性分离,避免钝性牵拉,刺激压迫神经时间不要太长,应间断放松;④电生理监测人员应正确放置电极及电极导线,出现异常的电位变化及时向术者报告,以免发生不可逆的神经损伤;⑤麻醉过程中尽量不使用肌松药物,以免影响电生理监测的可靠性。
术中神经电生理监测可以实时了解脊髓神经功能的完整性,监测结果可靠、灵敏,结合显微神经外科技术可以明显提高圆锥马尾病变的全切率,减少神经损伤和术后并发症,提高手术疗效及安全性。
| [1] | Sakai Y, Matsuyama Y, Kamyama Y, et a1. Spinal myxopapillary ependymoma:neurological deterioration in patients treated with surgery. Spine, 2009, 34(15):1619-1624. |
| [2] | Akagami R, Dong CC, Westerberg BD. LocaIized transcranial electrical motor-evoked potentials for monitoring cranial nerves in cranial base surgery. Neurosurgery, 2005, 57(1Suppl):78-85. |
| [3] | Nakamura M, Ishii IL Watanabek, et a1.Long-term surgical outcomes for myxopapillary ependymomas of the cauda equina. Spine,2009,34(21):E756-760. |
| [4] | Lotfinia I, Vahedi P. Intramedullary cervical spinal cord ganglioglioma, review of the literature and therapeutic controversies. Spinal Cord, 2009, 47(1): 87-90. |
| [5] | 陈赞, 菅凤增. 椎管内肿瘤与脊柱稳定性. 中国现代神经疾病杂志, 2013, 13(12):986-987. |
| [6] | Chi Heon Kim, Chun Kee Chung. Surgical outcome of a posterior approach for large ventral intradural extramed-ullary spinal cord tumors. Spine, 2011,8:531-537. |
| [7] | Sala F, Bricolo A, Faccioli F, et al. Surgery for intramedullary spinal cord tumors: the role of intraoperative(neurophysiological) monitoring. Eur Spine J, 2007, 16(Suppl 2): 130-139. |
| [8] | 宋启民, 费昶,杨卫忠, 等. 术中运动诱发电位监测对脊髓功能完整性的保护作用. 国际神经病学神经外科学杂志, 2010, 37(4): 374-376. |
| [9] | Kothbauer KF.Intraoperative neurophysiologic monitoring for intramedullary spinal cord tumor surgery.Neurophysiol Clin,2007,(37):407-414. |
| [10] | Deletis V,Sala F.Intraoporative neurophysiological monitoring of the spinal cord during spinal cord and spine surgery:a review foeus on the corticospinal tracts.Clin Neurophysiol,2008,119(2):248-264. |
| [11] | Lo YL,Dan YF,Tan YE,et al.Intraoperative monitoring study of ipsilateral motor evoked potentials in scoliosis surgery. Eur Spine J, 2006, 15(Suppl 5):656-660. |
| [12] | Il Choi, Seung-Jae Hyun, Joong-Koo Kang,et al. Combined Muscle Motor and Somatosensory Evoked Potentials for Intramedullary Spinal Cord Tumour Surgery. Yonsei Med J, 2014, 55(4):1063-1071. |
| [13] | Weinzierl MR,Reinaeher P,Gilsbach JM,et a1.Combined motor and somatosensory evoked potentials for intraoperative monitoring:intra-and postoperative data in a series of 69 operations.Neurosurg Rev,2007,30(2):109-116. |
| [14] | Iwasaki M, Hida K, Aoyama T,et al. Thoracolumbar intramedullary subependymoma with multiple cystic formation: a case report and review. Eur Spine J, 2012, 86:2357-2360. |
 2015, Vol. 42
2015, Vol. 42

 ,
,