扩展功能
文章信息
- 李红英
- LI Hong-Ying
- 缺血性脑卒中患者颈动脉易损斑块磁共振表现
- Magnetic resonance findings of carotid vulnerable plaques in patients with ischemic stroke
- 国际神经病学神经外科学杂志, 2015, 42(6): 492-495
- Disease Surveillance, 2015, 42(6): 492-495
-
文章历史
- 收稿日期: 2015-10-10
- 修回日期: 2015-11-11
缺血性脑卒中是当今常见的高发病率、高致残率、高致死率的老年性疾病,已成为世界性健康问题。真正因为血管狭窄引起脑缺血性低灌注的病变很少,尸检显示,在动脉粥样硬化基础上,易损斑块突然破裂,继而血栓形成引起缺血性脑卒中占大多数。对缺血性脑卒中患者颈动脉易损斑块的MR检查,能及早发现相关因素,对防治脑卒中复发,具有十分重要的意义。
1 资料与方法 1.1 研究对象收集2014年3月~2015年9月经头颅MRI证实的首发或再发缺血性脑卒中患者并经过B超检查筛选颈动脉狭窄病人38例,其中男20例,女18例,年龄45~81岁。临床主要症状:颈部不适,语言不清,头痛,恶心,呕吐,肢体无力,运动障碍。既往有高血压病史28例,糖尿病病史6例,冠心病9例,吸烟史30例。所有患者在我院超声科由固定的2位经验丰富的超声科副主任医师检查。使用美国GELOGIO700彩色多普勒超声检查仪,探头频率为8~12 MHz。观察内膜中层厚度(intima-media thickness,IMT),IMT为管腔内膜交界面到中膜与外膜交界面的垂直距离。局部IMT>1.2 mm为动脉粥样硬化斑块。所有患者均行颈部CE-MRA及冠状位高分辨率MR扫描。
1.2 检查方法使用 Siemens 3.0T超导MR成像系统和8-NV头颈联合线圈。嘱患者仰卧,头颈部固定于线圈内。将高压注射器连接好,先行颈部血管3D TOF扫描,然后最大密度投影(MIP)及多平面重建(MPR)重建图像观察颈动脉狭窄处。于管腔狭窄处冠状位3D-T1WI平扫,TRS位PDW相扫描,TRS位T2WI扫描。然后CE-MRA,蒙片扫描,继而注射对比剂,透视状态下当发现主动脉弓上三支血管显示,立即启动3D扫描。最后3D冠状位T1WI增强扫描。扫描序列及参数如下,双回波质子密度加权相及T2加权相,TR和TE分别为3000 ms/13 ms和3000 ms/60 ms,以于管腔狭窄处为中心,上下各8层,视野为14 CM,层厚/层间距为2 mm/0 mm,矩阵为256×256,采集次数为2次。
2 结果颈总动脉分叉区狭窄20例,颈内动脉狭窄或者闭塞18例,钙化8例,点状,不规则形状,各个序列成低信号。无钙化纤维成分为主19例,等低信号。明显脂质核心6例,斑块内出血2例,信号与出血时间长短密切。脂质坏死核心信号2例,T1WI序列呈高信号。溃疡或者纤维帽撕裂 1例纤维帽不完整。见表 1、图 1。
| 斑块类型 | 信号特征 |
| 脂质坏死核心 | 脂质坏死核心若为甘油三酯,则为短T1短T2,脂质坏死核心若为胆固醇则表现为短T1长T2信号。脂质坏死核心T1WI相呈高信号。 |
| 斑块内出血 | 是斑块不稳定的重要因素,信号取决于血红蛋白的结构和氧化状态,因此,跟出血时间有关,T1WI相作为首选,信号与出血时间有关,在出血早期,高铁血红蛋白位于细胞内,亚急性期,高铁血红蛋白位于细胞外,慢性期,则以含铁血红素为主。 |
| 斑块纤维帽 | 斑块纤维帽,富含胶元的基质和平滑肌组成,有研究发现,大多数斑块可见高信号带,有时斑块内层弧形T1WI等信号,T2WI及PDW强弱不等信号,而3DTOF序列多为低信号。 |
| 钙化 | 在各种序列成低信号 |
| 斑块内炎性浸润 | T1WI略低,T2WI略高,边界模糊,增强后有强化。 |
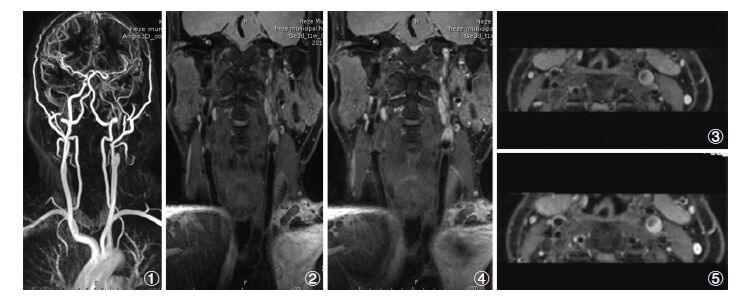
|
| 图 1 MR所见。①CE-MRA扫描:左侧颈内动脉近段管腔偏心性狭窄,闭塞。左侧颈内动脉远心段未见显示。②冠状位3D-T1W相平扫:左侧颈内动脉近段管腔偏心性狭窄,闭塞。管壁增厚,呈不均匀高信号。③冠状位3D-T1W相平扫MPR重建横轴位,管壁增厚,斑块呈不均匀高信号。④冠状位3D-T1W相增强,管壁增厚,斑块呈不均匀强化。⑤冠状位3D-T1W相增强MPR重建横轴位,管壁增厚,斑块呈不均匀强化。 |
易损斑块是所有易于发生血栓形成或者发展迅速的危险斑块。Blaser等研究发现,单纯颈动脉狭窄对判断缺血性脑卒中不敏感。颈动脉粥样硬化斑块破裂是最重要的始动环节。在颈动脉粥样硬化斑块基础上形成血栓是缺血性脑卒中发生、发展的主要病理学生理学基础。
易损斑块的诊断标准[1]:⑴主要标准:①管腔狭窄>90%;②薄的纤维帽和脂质核心;③活动性炎症,单核细胞及巨噬细胞浸润,有T细胞 浸润;④内皮脱落及表面血小板聚集;⑤斑块裂隙。⑵次要标准:①斑块表面钙化结节;②血管内径下见黄亮斑块;③斑块内出血;④内皮功能障碍;⑤斑块正性重构。
颈动脉粥样硬化斑块的高斑块负荷及明显向腔内重构是导致斑块破损的重要因素[2],同时颈动脉斑块风险性与脂质含量、纤维帽的厚度密切相关。薄的纤维帽、大的脂质核心、斑块内出血是最具代表性的易损斑块特征[3]。颈动脉斑块稳定性依赖于其内脂质核心的大小和成分、纤维帽的厚度以及炎性反应或新生血管,是否伴发斑块内出血[4]。“易损斑块”还有其他类似的名称,如“危险斑块、软斑、高风险斑块和不稳定斑块”等用来描述这类高风险斑块。易损斑块的病理学分类[5]:①具有破裂倾向的易损斑块:大脂质核心、薄纤维帽,并包括巨噬细胞在内的炎性细胞浸润;②纤维破裂,表面继发性血栓形成,造成血管不全闭塞,存在早期血栓机化;③富含糖蛋白基质、平滑肌细胞的斑块,斑块表面发生糜烂;④表面出现显著糜烂的斑块,血小板血栓形成,造成血管不完全闭塞;⑤斑块内出血造成斑块短时间内明显增大,管腔狭窄程度迅速恶化;⑥钙化结节向管腔内突起明显;⑦慢性狭窄性斑块伴严重钙化,陈旧性血栓形成、偏心性管腔。
MRI检查中斑块的多对比序列包括:亮血三维时间飞跃(3DTOF)、黑血T1、PD、T2WI及CE-MRA。颈动脉易损斑块的MR特征[8, 9, 10, 11]:①脂质坏死核心(lipid-rich necrotic core,LRNC):因T2WI采用的回波时间不同(40~80 ms)及LRNC的物理特性液相、固相的不同,在T2WI相信号强度不一,有时呈低信号,有时呈中等或者高信号。仅T2WI难以鉴别脂质坏死核心。脂质坏死核心若为甘油三酯,则为短T1短T2,脂质坏死核心若为胆固醇则表现为短T1长T2信号[6, 7]。脂质坏死核心T1WI相呈高信号。②斑块内出血(intraplaque hemorrhage,IPH):是斑块不稳定的重要因素,信号取决于血红蛋白的结构和氧化状态,因此跟出血时间有关,T1WI相作为首选,信号与出血时间有关,在出血早期,高铁血红蛋白位于细胞内,亚急性期,高铁血红蛋白位于细胞外,慢性期,则以含铁血红素为主。③斑块纤维帽:富含胶元的基质和平滑肌组成,有研究发现,大多数斑块可见高信号带,有时斑块内层弧形T1WI等信号,T2WI及PDW强弱不等信号,而3DTOF序列多为低信号。④钙化在各种序列呈低信号。⑤斑块内炎性浸润:炎症是斑块发生及破裂的核心问题,尤其在不稳定斑块,炎症细胞的比例明显增高。⑥新生血管:反应炎症的存在,特别是纤维帽内新生血管生成会增加斑块的不稳定性。动脉斑块增强检查的目的在于显示纤维帽是否完整,其机制在于斑块的血供增加并且血管内皮渗透性增加,导致造影剂进入血管外间隙[12]。
颈动脉易损斑块内的成分研究结果显示LRNC最大体积百分比较大、IPH、纤维帽过薄或者破裂是发生缺血性脑卒中的强烈预测因素。缺血性脑卒中与颈动脉易损斑块密切相关[13]。导致缺血性脑卒中的主要原因是斑块的不稳定性和血栓的形成,颈动脉狭窄程度不再是预测缺血性脑卒中事件的发生指标。因此,从疾病预防角度出发,以一条或者几条颈动脉为检测窗口,结合遗传和血液生物标志物,综合评价缺血性脑卒中的风险是脑血管病一级预防的重要研究方向。斑块MR成像可用于评价斑块是否为易损斑块并最终确定个体心血管事件发生的危险性,还能为临床提供斑块成分及斑块负荷信息,从而有助于确定个体最佳的治疗方案。斑块成像可对影像斑块治疗的因素进行评价,如斑块成分及体积的改变,特别是对斑块稳定性的潜在作用。其远期作用在于检测斑块的进展,并且在斑块诱发临床症状之前能够提供更有价值的信息。
MR对软组织的分辨率较高,能对不同性质的斑块病理成分进行有效的分析研究,及时准确的评价斑块的大小、性质,能指导临床合理地调整药物,有效的控制患者的病情。MR具有测量客观准确、无损伤、无辐射、多参数指导、多序列成像、反复检查等优势,近年来被临床广泛用于斑块的评价[13, 14]。其不足之处在于颈动脉分叉存在涡流,有可能夸大狭窄的程度;严重狭窄与闭塞不易区分;MR检查费用较高,检查持续时间长;体内带有金属异物不能采用MR检查。
缺血性脑血管病患者在年龄、性别等不可干预因素不能改变的情况下,要及早考虑控制斑块易损性的发生,发展,对合并易损斑块的患者,要加强早期MR诊断,早期检测,且积极干预,能及早有效的预防缺血性脑血管病的二次发生。
| [1] | Biasi GM, Froio A. the Imaging in Carotid Angioplasty and Risk of Stroke (ICAROS) study. Circulation, 2004, 110(8): 756-762. |
| [2] | Katano H, Yamada K, Sakurai K, et al. Depiction of the vasa vasorum during carotid endarterectomy by intraoperative videoangiography. Stroke Cerebrovasc Dis, 2014, 23(10): 2920-2927. |
| [3] | Gijsen FJ, Nieuwstadt HA, Wentzel JJ, et al. Carotid Plaque Morphological Classification Compared With Biomechanical Cap Stress: Implications for a Magnetic Resonance Imaging-Based Assessment. Stroke, 2015, 46(8): 2124-2128. |
| [4] | Pedersen SF, Sandholt BV, Keller SH, et al. 64Cu-DOTATATE PET/MRI for Detection of Activated Macrophages in Carotid Atherosclerotic Plaques: Studies in Patients Undergoing Endarterectomy. Arterioscler Thromb Vasc Biol, 2015, 35(7): 1696-1703. |
| [5] | Sano N, Satow T, Maruyama D, et al. Relationship between histologic features and outcomes of carotid revascularization for radiation-induced stenosis. Vasc Surg, 2015, 62(2): 370-377. |
| [6] | Kashiwazaki D, Akioka N, Kuwayama N, et al. Pathophysiology of acute cerebrovascular syndrome in patients with carotid artery stenosis: amagnetic resonance imaging/single-photon emission computed tomography study. Neurosurgery, 2015, 76(4): 427-433. |
| [7] | Selwaness M, van den Bouwhuijsen Q, van Onkelen RS, et al. Atherosclerotic plaque in the left carotid artery is more vulnerable than in the right. Stroke, 2014, 45(11): 3226-3230. |
| [8] | Kiyofuji S, Inoue T, Hasegawa H, Tamura A, et al. Emergent surgical embolectomy for middle cerebral artery occlusion due to carotid plaque rupture followed by elective carotid endarterectomy. Neurosurg, 2014, 121(3): 631-636. |
| [9] | Chan JM, Monaco C, Wylezinska-Arridge M, et al. Imaging of the vulnerable carotid plaque: biological targeting of inflammation in atherosclerosis using iron oxide particles and MRI. Eur J Vasc Endovasc Surg, 2014, 47(5): 462-469. |
| [10] | Zavodni AE, Wasserman BA, McClelland RL, et al. Carotid artery plaque morphology and composition in relation to incident cardiovascular events: the Multi-Ethnic Study of Atherosclerosis (MESA). Radiology, 2014, 271(2): 381-389. |
| [11] | Fukuda K, Iihara K, Maruyama D, et al. Relationship between carotid artery remodeling and plaque vulnerability with T1-weightedmagnetic resonance imaging. J Stroke Cerebrovasc Dis, 2014, 23(6): 1462-1470. |
| [12] | Truijman MT, Kwee RM, van Hoof RH, et al. Combined 18F-FDG PET-CT and DCE-MRI to assess inflammation and microvascularization in atherosclerotic plaques. Stroke, 2013, 44(12): 3568-3570. |
| [13] | Makowski MR, Botnar RM. MR imaging of the arterial vessel wall: molecular imaging from bench to bedside. Radiology, 2013, 269(1): 34-51. |
| [14] | Witkiewicz W, Klimeczek P, Iwanowski W, et al. Dual source computed tomography in analysis of significance and morphology carotid plaques. Przegl Lek, 2013, 70(3): 118-122. |
 2015, Vol. 42
2015, Vol. 42

