扩展功能
文章信息
- 魏社鹏, 赵继宗
- 复发高级别胶质瘤的治疗
- 国际神经病学神经外科学杂志, 2015, 42(4): 396-400
- Disease Surveillance, 2015, 42(4): 396-400
-
文章历史
- 收稿日期: 2015-05-24
- 修回日期: 2015-08-25
2. 首都医科大学天坛医院神经外科, 北京 100050
高级别胶质瘤(High-grade gliomas,HGG)是一种恶性的、通常条件下生长迅速的原发性脑肿瘤。组织病理学上,主要包括间变胶质瘤(间变星形细胞瘤,间变少枝胶质瘤和间变少枝-星形细胞瘤)和胶质母细胞瘤。目前尚无随机对照试验来比较激进治疗和支持治疗的结果,所以复发后治疗方案的选择必须个体化。再次干预带来的益处,必须与医源的神经毒性以及该毒性对病人生活的影响进行仔细的权衡。
本文将重点讨论各种复发的间变胶质瘤和胶质母细胞瘤的治疗手段(主要包括手术,放疗和全身性治疗)对病人的影响。
1 诊断通常把治疗诱导的类似疾病进展的影像学改变,称之为假性进展(Pseudoprogression)。假性进展通常发生在放、化疗结束后的3个月内,其本质为亚急性的、和治疗有关的反应,在MRI上表现为类似肿瘤进展相似的影像[1]。放、化疗结束后,影像学上表现为恶化的病人中,30%~50%的病人被临床或者活检手术确诊为假性进展[2]。在持续化疗至少6个月后,假性进展在影像上表现为自发缓解或者稳定,所以其诊断通常是回顾性的。除活检之外,没有任何单一的临床或者影像学手段能够鉴别假性进展和真实进展。如果术后的病理结果是坏死,则化疗仍需要继续进行[3]。
2 治疗前的体力状态治疗前的体力状态是最重要的预后因子之一[4]。其它的因素包括:病变的范围、组织病理级别(初次和复发时)、症状稳定的时间以及复发类型(局部还是弥漫)[5]。局部复发、尤其是那些长时间稳定的病人和那些原发的难治性或弥漫性生长的病人相比,是较好的再次干预的对象。同理,一开始为低级别胶质瘤,其后进展为HGG的患者和那些一开始即为HGG患者相比,疗效更好。
2.1 体能状态良好者体能状态良好的病人适合进一步的治疗。再次治疗须根据复发的类型,潜在的组织病理学级别和既往接受过的治疗而精心选择。手术切除并不能获得恒久的肿瘤控制,通常需要辅以全身性治疗,除非手术时植入了卡莫司汀(BCNU)贴片。从低级别胶质瘤复发为HGG的患者,会从再次放疗中受益。偶尔,再次放疗应用于局灶复发的或原发灶以外的病灶,尤其是有全身性治疗禁忌症的时候,例如骨髓抑制。对于大部分复发的、选择不参加临床试验的胶质母细胞瘤者,贝伐单抗常常被选做2线药物。化疗对于复发的存在1p19q 联合缺失的间变胶质瘤患者可能是个更好的治疗选择。交替电场治疗装置在特定的医学中心,可以作为复发胶质母细胞瘤的另一个补救措施。
2.2 体能状态虚弱者体能状况虚弱的病人,在补救治疗中可能会获得更多的毒性。很多病例追求后续治疗所冒的风险远远大于其带来的好处。贝伐单抗对那些影像上存在肿瘤周围水肿又害怕使用激素的患者有用,因为靶向治疗可以对抗水肿,从而省去使用激素。通常没有比参加临床试验更好的治疗方法。对于那些不愿意或者不能参加临床试验的病人,治疗的选择应当个体化。需要考虑病人的偏爱、既往接受过的治疗、功能状态、生活质量和总的治疗期望。美国国家综合癌症网络以及欧洲神经肿瘤协会的指南推荐如图 1[6]。
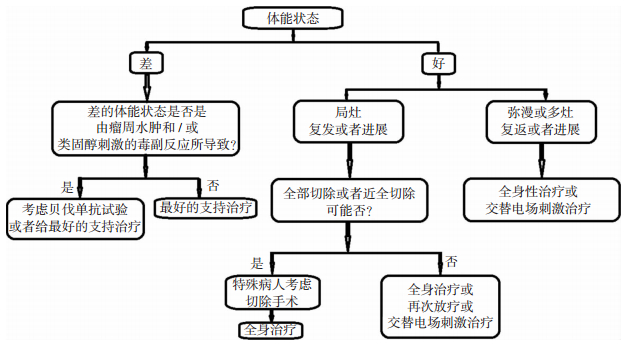
|
| 图 1 美国国家综合癌症网络以及欧洲神经肿瘤协会的指南 |
复发病变的再次手术治疗,包括活检或者再次肿瘤切除。只有20%~30%的病人适合于2次手术治疗[6]。活检手术可以区分肿瘤复发和假性进展。有时候即使获得足量的组织,也难以对两者进行鉴别,因为切除的组织可能是治疗后反应和有活力肿瘤组织的混合物。那些体积庞大、且有明显占位效应的肿瘤可能从2次手术中获得好处。患者良好的体力状态是长期生存最有意义的预示因素。其它提示预后较好的因素包括:年轻、初次手术后较长的生存时间、以及2次手术时切除广度[7]。最新研究发现,病变累及室管膜,是最重要的、独立的不良预后因素[8]。
3.2 放疗再次放疗的疗效尚不确定。回顾性分析认为,局灶复发并有良好体力状态的患者,能够从现代精准的放疗手段中获益[9]。
3.2.1 累及野照射传统放疗区域的再次照射,对复发HGG病人并不推荐。然而,局部放疗对特定的病人是可行的[10]。一组101例复发的HGG病人[11]接受了再次放疗,其中III 级的中位生存期是12个月,IV 级是8个月;一年的生存率III级者是65%,IV级者是23%;平均剂量是36Gy(15~62Gy),每周五次,每次2Gy。
3.2.2 立体定向放射外科114例复发的HGG病人[12]在施行立体定向放疗之后,III级病人的平均无进展期是8.6个月,IV级者是4.6个月;其中除5例病人采用直线加速器治疗外,其余病人均采用伽码刀放疗。其中放疗导致的坏死见于24%的病例。
3.2.3 近距离放射治疗(Brachytherapy)一组66例复发胶质母细胞瘤病人[13],从植入同位素的那天算起,平均生存期是49周;67例间变星形细胞瘤的平均生存期是52周;胶质母细胞瘤和间变星形细胞瘤的3年生存率分别是15%和24%;尽管92%的病人没有发生急性毒性反应,但是40%的病人最终因为放射性坏死而进行了再次手术。有研究认为,那些植入前进行过肿瘤切除的患者,发生放射性坏死的几率相对较低[14]。尽管间质内放疗可以给局部复发的病人带来较长的生存期,但是因为立体定向放疗和分次局灶限定区域放射治疗技术的发展,间质放疗的角色逐渐减小。
3.3 全身性治疗(见表 1)| 药物类别 | 剂量和时间 |
| 贝伐单抗* | 10 mg/kg 第1天和第15天,每四周循环 |
| 贝伐单抗* | 15 mg/kg 第1天和第22天,每六周循环 |
| 卡莫司汀 | 150~200 mg/m2 第一天,每六周循环 |
| 环己亚硝脲 | 90~110 mg/m2 第一天,每六周循环 |
| PCV[1] | 甲基苄肼 100 mg/m2 第1~10天 |
| (每6~8周循环) | 环已亚硝脲 100 mg/m2 第1天 |
| 长春新碱 1.5 mg/m2(≤2 mg)第1天 | |
| PCV[2, 3] | 甲基苄肼 60 mg/m2第8~21天 |
| (每6~8周循环) | 环已亚硝脲 100 mg/m2第1天 |
| 长春新碱 1.5 mg/m2(≤2 mg)第8天和第29天 | |
| 替莫唑胺 | 150~200 mg/m2/日共5天,每四周循环 |
| (标准) | |
| 替莫唑胺 | 150 mg/m2/日第1~7天和第15~21天,每四周循环 |
| (强化) | 75~100 mg/m2/日第1~21天,每四周循环 |
| 50 mg/m2/日连续使用 | |
| 辅助替莫唑胺[4] | 75 mg/m2/日放疗同时 |
| 150~200 mg/m2/日共5天,每四周循环,≤6个周期 | |
| 1. Medical Research Council trial. J Clin Oncol 2001; 19:509. 2. Levin,VA,et al. Int J Radiat Oncol Biol Phys 1990; 18:321. 3. van den Bent,MJ,et al. Neurology 1998; 51:1140. 4. Stupp,R,et al. N Engl J Med 2005; 352:987. | |
针对复发或者进展性的HGG,最常用的全身性治疗的药物是贝伐单抗,亚硝基脲和再次尝试的替莫唑胺(TMZ)治疗。对于那些具有足够体力状态的患者,无论如何,参加临床试验都是个优先的选择。
3.3.1 贝伐单抗贝伐单抗作单用或者联合伊利替康或者洛莫司汀,在WHO III级和IV级恶性胶质瘤的2期临床试验中,已被证明有明显的临床效果[15]。在BELOB的临床试验中,153例复发的胶质母细胞瘤患者既往曾经接受标准的放、化疗的患者,被随机分到贝伐单抗,洛莫司汀(110 mg/m2)或者两者联合组,平均总生存期在两个单药治疗组是8个月,而在联合治疗组是12个月[15]。
有限的临床试验结果表明,复发的HGG病人经过贝伐单抗治疗,预后很差,而且对其它治疗反应不佳[16, 17]。一项回顾性研究提示,与10 mg/kg每2周一次的标准剂量相比,低剂量(7.5 mg/kg每三周)的贝伐单抗治疗显示出了更长的生存期[18]。其它剂量对那些有神经功能损害、行动不便的病人来说,可能更加简便。出于此种考虑,3周一次的给药方案(5,10,或 15 mg/kg)是个替代的选择。
与贝伐单抗相关的毒性反应包括心血管反应例如高血压,血栓栓塞,左心室功能不全;非心血管的副反应包括蛋白尿,伤口延迟愈合和出血[19]。没有进行抗凝治疗的复发HGG病人,采用贝伐单抗单药治疗后,大约有2%~3%的病人会并发颅内出血[20]。
3.3.2 亚硝基脲类不适合参加临床试验以及贝伐单抗进行治疗的,且初始时采用TMZ治疗的复发HGG患者,选择亚硝基脲类为基础的化疗是个合理的选择。亚硝基脲类(如卡莫司汀,福莫司汀)单药使用或者联合例如甲基苄肼,氯乙洛莫司汀和长春新碱(PCV)的方案,均在2期临床试验中显示出了积极的效果[21]。在enzastaurin的3期临床试验中洛莫司汀作为对照组,病人平均的无进展期和总生存持续时间分别为1.6个月和7.1个月[22]。在cediranib 的3期临床试验中,对照组中病人对洛莫司汀的反应率为9%,平均无进展期和总生存期分别为2.7和9.8个月[23]。
447例接受单纯放疗后复发的HGG病人,在3期临床试验中,将联合方案PCV和TMZ进行比较后发现,在无进展期(分别为3.6个月和4.7个月)和总生存期(6.7个月和7.2个月)方面,两者没有显著性差异[24]。
3.3.3 替莫唑胺再化疗复发HGG进行化疗的2期临床试验的结果表明,不同剂量的TMZ结果各异[25]。一般认为,首次使用TMZ结束几个月后即复发的且存在MGMT启动子甲基化的病人,适合再次使用TMZ治疗。TMZ化疗有效的病人中,集中剂量给予并不比常规剂量疗法有任何优势[24]。一项随机的复发胶质母细胞瘤的2期临床试验[26]中,采用剂量集中型TMZ对病人进行治疗,即每两周中第一周150 mg/m2/日口服,第2周休息;或者每四周中前3周100 mg/m2/日,第四周休息。初步的结果表明:不同剂量组所获得的最终疗效类似。该研究还表明,最重要的疗效预示因素是MGMT启动子的甲基化状态;不论剂量如何,6个月无症状病人的比率在MGMT启动子甲基化组与未甲基化组分别为40%和7%。
3.4 交替电场治疗装置(NovoTTF-100A)这是一种新型便携式的治疗装置,可以产生低强度交替变化的电场。一组237例复发的胶质母细胞瘤患者[27]接受了交替电场装置的随机试验治疗,结果表明,电场治疗组和化疗组的平均无进展期(2.2和2.1个月)和总生存期(6.6和6个月)相似;客观的反应率,电场组并不比化疗组有明显提高(14%和10%)。来自美国国家综合癌症网络的专家一致认为,交替电场治疗可以作为复发胶质母细胞瘤的一个治疗方案[9]。
3.5 支持疗法最理想的支持治疗对于所有复发或者进展的HGG而言,无论病人是否继续接受别的治疗都很重要。皮质类固醇(主要是地塞米松)和抗癫痫药物被用于消除瘤周水肿和控制癫痫发作。这些药物对脑肿瘤病人来说,尤其是年长的病人,均具有非特异的副作用和毒性。体质差的,包括那些不能行走以及日常生活不能自理的患者,最好仅给以最适度的支持治疗。
4 总结HGG是恶性的、生长迅速的原发性脑肿瘤。综合性的治疗方案包括最大限度的手术切除、辅助放疗和辅助化疗。复发或者再次进展的HGG治疗非常困难,没有证据表明激进的治疗方案能延长生存期。治疗方案的选择应当个体化,要考虑到病人的偏好、既往接受过的治疗、体能状态、生活质量和治疗的总体目标。2期临床试验研究的结果显示,贝伐单抗减少了病人对激素的依赖,影像上也显示出肿瘤生长受抑制的效果。如有可能,复发的HGG病人可以选择参加临床试验。
| [1] | O'Brien BJ, Colen RR. Post-treatment imaging changes in primary brain tumors. Curr Oncol Rep, 2014, 16(8):397. |
| [2] | Young RJ, Gupta A, Shah AD, et al. Potential utility of conventional MRI signs in diagnosing pseudoprogression in glioblastoma. Neurology, 2011, 76(22):1918-1924. |
| [3] | Brandsma D, Stalpers L, Taal W et al. Clinical features, mechanisms, and management of pseudoprogression in malignant gliomas. Lancet Oncol, 2008, 9(5):453-461. |
| [4] | Kappelle AC, Postma TJ, Taphoorn MJ, et al. PCV chemotherapy for recurrent glioblastoma multiforme. Neurology, 2001, 56(12):118-120. |
| [5] | Keles GE, Lamborn KR, Chang SM, et al. Volume of residual disease as a predictor of outcome in adult patients with recurrent supratentorial glioblastomas multiforme who are undergoing chemotherapy. J Neurosurg, 2004,100:41. |
| [6] | Weller M, van den Bent M, Hopkins K, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol, 2014, 15(3):e395. |
| [7] | Oppenlander ME, Wolf AB, Snyder LA, et al. An extent of resection threshold for recurrent glioblastoma and its risk for neurological morbidity. J Neurosurg, 2014, 120(4):846-853. |
| [8] | Park CK, Kim JH, Nam DH, et al. A practical scoring system to determine whether to proceed with surgical resection in recurrent glioblastoma. Neuro Oncol, 2013, 15(8):1096-1101. |
| [9] | NCCN guidelines available at http://www.nccn.org/professionals/physician_gls/f_guidelines.asp#site(Accessed on September 24, 2014). |
| [10] | Nieder C, Astner ST, Mehta MP, et al. Improvement, clinical course, and quality of life after palliative radiotherapy for recurrent glioblastoma. Am J Clin Oncol, 2008, 31(3):300-305. |
| [11] | Combs SE, Thilmann C, Edler L, et al. Efficacy of fractionated stereotactic reirradiation in recurrent gliomas:long-term results in 172 patients treated in a single institution. J Clin Oncol, 2005, 23(34):8863-8869. |
| [12] | Kong DS, Lee JI, Park K, et al. Efficacy of stereotactic radiosurgery as a salvage treatment for recurrent malignant gliomas. Cancer, 2008,112(9):2046-2051. |
| [13] | Scharfen CO, Sneed PK, Wara WM, et al. High activity iodine-125 interstitial implant for gliomas. Int J Radiat Oncol Biol Phys, 1992,24(4):583-591. |
| [14] | Patel S, Breneman JC, Warnick RE, et al. Permanent iodine-125 interstitial implants for the treatment of recurrent glioblastoma multiforme. Neurosurgery, 2000, 46(5):1123-1128. |
| [15] | Taal W, Oosterkamp HM, Walenkamp AM, et al. Single-agent bevacizumab or lomustine versus a combination of bevacizumab plus lomustine in patients with recurrent glioblastoma(BELOB trial):a randomised controlled phase 2 trial. Lancet Oncol, 2014, 15(9):943-953. |
| [16] | Piccioni DE, Selfridge J, Mody RR, et al. Deferred use of bevacizumab for recurrent glioblastoma is not associated with diminished efficacy. Neuro Oncol, 2014,16(6):815-822. |
| [17] | Rahman R, Hempfling K, Norden AD, et al. Retrospective study of carmustine or lomustine with bevacizumab in recurrent glioblastoma patients who have failed prior bevacizumab. Neuro Oncol, 2014,16(11):1523-1529. |
| [18] | Levin VA, Mendelssohn ND, Chan J, et al. Impact of bevacizumab administered dose on overall survival of patients with progressive glioblastoma. J Neurooncol, 2015,122(1):145-150. |
| [19] | Brandes AA, Bartolotti M, Tosoni A, et al. Practical management of bevacizumab-related toxicities in glioblastoma. Oncologist, 2015, 20(2):166-175. |
| [20] | Simonetti G, Trevisan E, Silvani A, et al. Safety of bevacizumab in patients with malignant gliomas:a systematic review. Neurol Sci, 2014, 35(1):83-89. |
| [21] | Chamberlain MC. Salvage therapy with lomustine for temozolomide refractory recurrent anaplastic astrocytoma:a retrospective study. J Neurooncol, 2015,122(2):329-338. |
| [22] | Wick W, Puduvalli VK, Chamberlain MC, et al. Phase Ⅲ study of enzastaurin compared with lomustine in the treatment of recurrent intracranial glioblastoma. J Clin Oncol, 2010, 28(7):1168-1174. |
| [23] | Batchelor TT, Mulholland P, Neyns B, et al. Phase Ⅲ randomized trial comparing the efficacy of cediranib as monotherapy, and in combination with lomustine, versus lomustine alone in patients with recurrent glioblastoma. J Clin Oncol, 2013,31(26):3212-3218. |
| [24] | Brada M, Stenning S, Gabe R, et al. Temozolomide versus procarbazine, lomustine, and vincristine in recurrent high-grade glioma. J Clin Oncol, 2010, 28(30):4601-4618. |
| [25] | Han SJ, Rolston JD, Molinaro AM, et al. Phase Ⅱ trial of 7 days on/7 days off temozolmide for recurrent high-grade glioma. Neuro Oncol, 2014,16(9):1255-1162. |
| [26] | Weller M, Tabatabai G, Kästner B, et al. MGMT Promoter Methylation Is a Strong Prognostic Biomarker for Benefit from Dose-Intensified Temozolomide Rechallenge in Progressive Glioblastoma:The DIRECTOR Trial. Clin Cancer Res, 2015, 21(9):2057-2064. |
| [27] | Stupp R, Wong ET, Kanner AA, et al. NovoTTF-100A versus physician's choice chemotherapy in recurrent glioblastoma:a randomised phase Ⅲ trial of a novel treatment modality. Eur J Cancer, 2012,48(14):2192-2202. |
 2015, Vol. 42
2015, Vol. 42
