扩展功能
文章信息
- 王兵, 廖勇仕, 梁日初
- WANG Bing, LIAO Yongshi, LIANG Richu
- 酷似高血压脑出血的基底节区血管畸形的显微外科治疗
- Microsurgical treatment of vascular malformations in basal ganglia mimicking hypertensive intracerebral hemorrhage
- 国际神经病学神经外科学杂志, 2015, 42(4): 346-348
- Disease Surveillance, 2015, 42(4): 346-348
-
文章历史
- 收稿日期: 2015-06-06
- 修回日期: 2015-09-01
自发性基底节区脑出血最常见的原因之一是高血压动脉硬化性血管病变,在临床工作中,本组偶遇数例此类脑出血病例并经手术病理证实为血管畸形,其临床表现及影像学与高血压脑出血非常相似,亦具有自身特点。为了提高该类患者术前诊断率、治愈率和减少治疗的盲目性,总结如下。
1 资料与方法 1.1 临床资料回顾性收集我院2011 年2 月~2014年12月收治的需开颅手术治疗的148例基底节区脑出血病例,其中12例经手术病理证实为脑血管畸形。12例病例中,男8例,女4例,年龄56~72岁,平均62.4±4.6岁。
1.2 临床表现既往有明确高血压病史者7例,否认者2例,不明者3例。主要临床表现:不同程度意识障碍,其中昏迷8例(浅昏迷6例,中度昏迷2例),昏睡4例,12例均有不同程度偏瘫,所有病例术前血压均升高大于160 mmHg。出血左侧5例,右侧7例,出血量45~70 ml,平均58.0±7.4 ml,合并SAH者3例。
1.3 影像学检查本组患者均行CT检查,高血压病史不明或否认高血压病史者行CTA检查。CT平扫显示:12例患者均表现为基底节区高密度病灶,混杂有低密度病灶,形状规则或不规则,3例合并SAH。5例行CTA扫描未显示血管畸形或动脉瘤(见图 1)。
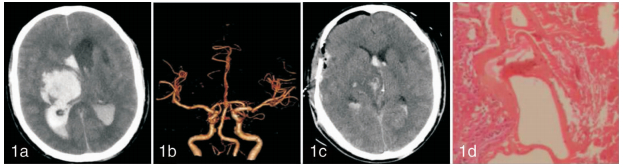
|
| 图 1 62岁男性患者,否认高血压病史。图1a术前CT右侧丘脑基底节区脑出血破入脑室,血肿呈高低混杂密度;图1b 术前CTA阴性;图1c行大骨瓣术式,术后复查血肿已清除;图1d术后病检(HE×40)可见扩张的管腔不一的血管,管腔内淤血,部分为壁薄无平滑肌的静脉,部分为可见中层及弹力板的动脉,扩张的脉管间为脑组织,提示AVM。 |
12例均采取开颅手术治疗,其中10例采取直切口小骨窗术式,另外2例中度昏迷、出血量较大者采用大骨瓣术式,术中均显微镜下经外侧裂-岛叶行皮质造瘘进入血肿腔。
2 结果12例患者经手术治疗,术中在吸除血肿可见与血肿壁粘连较紧、吸除困难可疑异常血管组织,呈条索状,与脑组织边界尚清,血管组织间有暗红色血肿,未见明显供血动脉及粗大引流静脉,沿血管组织周边切除病灶,可见血管组织向深部延伸。术后病检结果动静脉畸形8例,海绵状血管瘤4例(见图 1、图 2)。术后复查CT血肿清除满意,术后CTA未显示明显的异常血管组织,MRI常规扫描血肿腔及周边亦未发现明异常血管残留。12例患者均清醒出院,遗留不同程度神经功能障碍,主要为偏瘫及失语,出院后随访2个月~2年,未见再次出血病例。
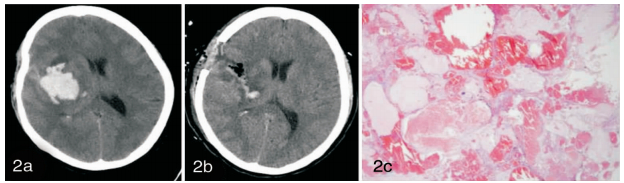
|
| 图 2 58岁女性患者,既往有高血压病史。图2a术前CT提示基底节区血肿并SAH,血肿呈高低混杂密度;图2b行小骨窗术式,术后复查血肿已清除;图2c术后病检(HE×40)示CA,镜下见扩张的大小不一的血管,腔内淤血,血管均为薄壁的静脉血管,与AVM的区别在于血管间不是脑组织。 |
基底节区血肿最常见的原因为高血压脑出血,目前的研究认为高血压基底节区脑出血责任血管多为豆纹动脉、丘脑穿通动脉,在长期高血压刺激下发生慢性病变基础上破裂出血,这些慢性病变主要包括小动脉硬化、脑血管透明脂肪样变性以及粟粒样微动脉瘤形成,这些病理变化在CTA或DSA上不能显示。其发病突然,进展迅速,很快出现神经功能缺失甚至意识障碍。本组12例病例中,都为中老年患者,其临床表现与高血压脑出血相似,CT平扫亦可见基底节区出血灶,CTA阴性。因此在临床诊疗中容易与高血压出血相混淆,尤其是血管畸形合并有高血压基础疾病者。回顾以上12例病例,除了相似之处外亦有自身的特点。
基底节区血管畸形出血患者可有或无高血压病史,发病后由于颅内压升高,血压多升高。对于高血压病史不明,发病后血压升高幅度不大者,以及明确否认高血压病史者,应高度警惕血管畸形出血可能。
本组12例病例CT平扫均呈高低混杂密度,即高密度血肿间混杂低密度灶,低密度病灶多为血管畸形灶,其CT值高于脑组织而低于血肿,根据测量CT值可与脑组织鉴别,尤其是在低密度病灶与脑组织相连的情况下。有时血肿可沿脑组织间隙走行,不像高血压基底节区出血灶规则。对于怀疑非高血压脑出血的病例我们术前进行了CTA检查,亦无明显阳性发现,临床上称之为隐匿性血管畸形[1]。隐匿性脑血管畸形是先天性脑血管畸形,目前多认为起源毛细血管水平的畸形,是青壮年自发性脑出血的原因之一。主要包括由血栓完全形成动静脉畸形(AVM)、海绵状血管畸形(CA)、静脉血管瘤(VA)、毛管扩张症等[2],有时几种畸形可同时并存。CT密度分辨率高,对于合并出血及钙化很敏感,有研究认[3]为病灶合并出血、钙化、无占位效应和水肿、相邻脑组织萎缩是隐匿性脑血管畸形CT和MRI中较特征性表现,对于少量出血病例意义较大。对于出血量较大的病例,由于血肿的占位效应,上述征象多不明显。另有研究认为MRI的SWI像有助于明确诊断,SWI 序列却不受血流速度影响,相反低速血流会增强磁敏感效应的信号变化,故其对此类血管畸形高度敏感。而且三维采集的SWI可以最大程度减小部分容积效应,结合相位信息SWI能发现常规MRI 或MRA 无法显示的血管结构,是筛查临床高度怀疑低流速血管畸形的理想工具,可作为术后复查的首选[4]。
本组12例病例中AVM占8例,CA 4例。有研究认为[5]:AVM出血最主要的是与AVM大小、AVM构筑、引流静脉数目、大小流向、管壁损伤、缺陷程度、血流动力变化密切相关。较易引起出血的因素有: 病灶较小( 畸形血管团直径<3 cm) 、穿支动脉供血、单一深静脉引流、伴发动脉瘤、 病灶内血管压力升高等[6]。基底节区AVM多为小型AVM,其供应动脉多为穿支动脉,引流静脉多为单支深静脉,血管内膜薄弱、弹力层薄或易断裂[7],其血流动力学亦呈高动力状态,因此较大型AVM更容易破裂出血。而对于此类小型AVM出血,开颅手术是最直接有效的办法。
对于基底节区小型血管畸形,出血后更有利于寻找及完整切除病灶。术中所见血管畸形多位于血肿壁边缘与脑组织交界处,术中行皮质造瘘后先进入血肿腔吸除血肿,对于与血肿壁粘连较紧不易吸除的病灶多为畸形血管团,可暂避开,待吸除部分血肿压力下降后再行处理,即清除血肿宜在血肿中心向周边吸引清除,而切除畸形血管团应在其与脑组织边界处进行。此12例病例中基底节区畸形血管团多较小,无明显供血动脉及粗大引流静脉,与脑组织侧有较明显边界,术中应沿此边界进行分离。而高血压脑出血多是一支豆纹动脉破裂出血,术中出血不多,止血较容易,因此造瘘口不必太大,通常1cm左右即能满足清除血肿及止血的需要。而血管畸形出血除了清除血肿外还应尽可能I期全切畸形血管团,建议造瘘口可适当扩大,避免过度牵拉脑组织或盲目操作电凝,造成不必要的损伤而影响术后神经功能恢复。大型畸形血管团静脉引流多向静脉窦或/和深部静脉引流,大多汇集为单根静脉引流,基底节区血管畸形属于深部血管畸形,其静脉引流方向为深部静脉。根据我们术中所见,未见到粗大的向深部引流的静脉,在分离畸形血管团的过程中其“根部”多深在,向丘脑甚至与脑室相通,术中应根据具体情况尽可能切除,若位于视野盲区不易处理,不可盲目拖拽牵拉,以免造成难以控制的出血。
综上,对于基底节区脑出血的患者,应警惕血管畸形出血的可能,术前应结合年龄、有无高血压病史、影像学特点注意鉴别,该部位血管畸形多较小,无明显粗大的供血动脉及引流静脉,术中应注意在血管畸形周边切除畸形血管团,可根据术中情况适当扩大皮质造瘘口,争取I期完整切除。
| [1] | 王健,刘荣耀,许友松等.隐匿性脑血管畸形的诊断与治疗(附15例报告).中国临床神经外科杂志, 2011,16(7):392-394. |
| [2] | 赵继宗.神经外科学.北京:人民卫生出版社, 2007:497. |
| [3] | 韩壮,王秀忠,田云霞,唐蕊,郭剑虹.隐匿性脑血管畸形CT、MRI诊断.临床荟萃, 2014,29(8):948-949. |
| [4] | 李科,金真,张磊等.磁敏感加权成像在隐匿性脑血管畸形中的诊断价值.中国临床医学影像杂志, 2010,21(9):618-621. |
| [5] | 李明洙,武文元,张占普,刘海波.脑动静脉畸形出血相关因素探讨.中华神经外科杂志, 2004, 20(3):228-231. |
| [6] | Mansmann U, Meisel J, Brock M, Rodesch G, Alvarez H, Lasjaunias P. Factors associated with intracranial hemorrhage in cases of cerebral arteriovenous malformation. Neurosurgery, 2000,46(2):272-279 |
| [7] | 孙异临,王忠诚,曲宝清,赵继宗,石祥恩.脑动静脉畸形超微病理与临床症状的关系.北京医学, 1997,19(1):3-6. |
 2015, Vol. 42
2015, Vol. 42
