扩展功能
文章信息
- 朱蔚文, 宋兴旺, 刘晓蓉, 廖卫平, 易咏红
- ZHU Wei-Wen, SONG Xing-Wang, LIU Xiao-Rong, LIAO Wei-Ping, YI Yong-Hong
- 少年型、成年型齿状核红核苍白球路易体萎缩症临床特征分析
- Clinical characteristics of juvenile-type and adult-type dentatorubral-pallidoluysian atrophy:a comparative analysis
- 国际神经病学神经外科学杂志, 2015, 42(4): 333-337
- Disease Surveillance, 2015, 42(4): 333-337
-
文章历史
- 收稿日期: 2015-07-17
- 修回日期: 2015-08-31
齿状核红核苍白球路易氏体萎缩症(dentatorubral-pallidoluysian atrophy,DRPLA)是一种罕见的遗传性神经系统退行性疾病,为脊髓小脑共济失调(spinocerebellar ataxias,SCA)的一种亚型,是常染色体显性遗传的多聚谷胺酰胺病。该病在日本有较多家系报道及临床研究,在中国人群中则较为罕见,临床报道很少。DRPLA有两种临床亚型:少年型及成年型,临床表现有明显异质性。我国国内先后报道了4例经基因检测确诊为成年型DRPLA先证者及其家系的临床特征及基因分析。而少年型DRPLA先证者的临床特征及基因分析未见报道。我院癫痫中心于2014年共确诊了3例少年型DRPLA先证者及1例成年早期型DRPLA先证者。现对其临床特征及基因突变特点进行对比分析。
1 资料和方法 1.1 研究对象在2014年至2015年间,广州医科大学附属第二医院癫痫中心就诊的病患中,对有肌阵挛性发作伴共济失调的患者进行遗传性共济失调相关基因检测。
1.2 研究方法在取得患者知情同意后抽取外周血3 ml送广州金域医学检验中心进行脊髓小脑共济失调基因检测(包含SCA1/2/3/6/7/12/DRPLA)。该中心采用荧光标记引物毛细电泳片段分析法检测SCA相关基因的CAG重复片段,从而计算CAG重复数。当仅检测到一种等位基因时,通过TP-PCR技术检测是否存在超出正常范围的等位基因。DRPLA基因检测技术方法采用Shoji Tsuji在2010年发表于GeneReviews中的技术方法。对每例DRPLA基因CAG异常扩增的先证者均进行头颅MRI+T2Flair扫描、24小时Video-EEG检查,详细病史询问,神经系统体查及家系调查。
2 结果 2.1 临床资料 2.1.1 病史及家族史病例1:男性,29岁。16岁开始出现强直阵挛发作、肌阵挛发作,智力逐渐减退,22岁开始间有乱语,易激惹哭闹,偶有攻击行为,25岁癫痫发作增多,并伴有行走不稳,言语含糊,到我院就诊时患者强直阵挛发作2~3次/月,肌阵挛发作10+次/d。体查:爆发样语言,构音不清,词不达意,记忆力理解力计算力明显下降,MMSE评分为9分(初中毕业),指鼻不准,轮替笨拙,跟膝胫试验无法完成,Romberg’s sign(+),醉汉步态明显,需扶行,双手震颤,行走时双上肢舞蹈样挥动。其它系统:宽肩,高弓足,脊柱侧弯。家族史:父亲50岁出现癫痫,行走不稳,构音障碍,55岁死于癫痫发作所致的脑外伤。母亲及姐姐无症状,姐姐DRPLA基因检测正常。见图 1。
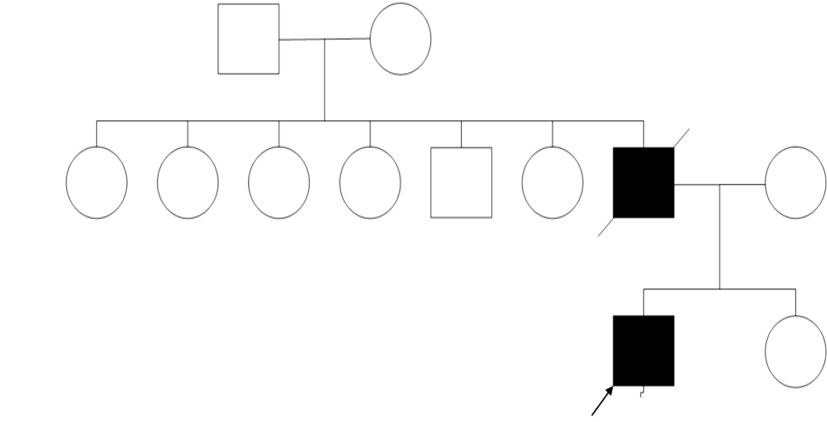
|
| 图 1 病例1家族图谱。 |
病例2:男性,23岁。14岁始出现肌阵挛发作及强直阵挛发作,次年出现行走不稳,不能跑步,行平地易跌倒,15岁始渐渐出现智力倒退,言语含糊,表达困难,生活不能自理,易激怒,对母亲有攻击行为,就诊时强直阵挛发作2~5次/月,发作易受情绪激动诱发,肌阵挛发作为1~2次/月,体查发现:接触欠佳,违拗明显,阵发性大叫,间有视幻觉。理解力计算力差(上学至初中2年级),100-7=?无法完成,言语欠清,爆发样及吟诗样,词不达意,双眼水平扫视速度明显减慢,醉汉步态明显,肢体及躯干有不自主扭动,其它检查不配合。其它系统:宽肩,高弓足。家族史:爷爷60岁左右走路不稳(已故),父亲40岁开始走路不稳,经常突发手抖掉碗筷,记忆力减退(已故),弟弟出生后有癫痫发作,不能行走,智力低下,6岁去世。其大伯家两个儿子均有癫痫发作,13岁起病,17、18岁去世。见图 2。
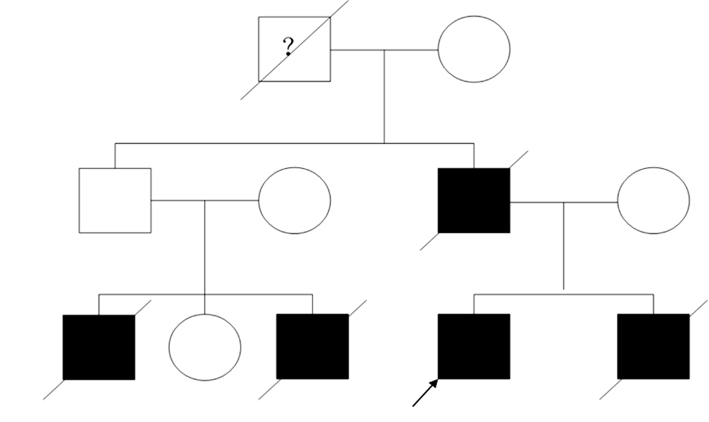
|
| 图 2 病例2家族图谱。 |
病例3:男性,17岁。9岁开始出现肌阵挛发作、复杂部分性发作、继发性强直阵挛发作,9岁以后智能渐减退,14岁出现行走不稳,脾气差,偏执,无攻击行为。体查:智力低下,不会写自己名字,计算不能,站立时前后摇晃,步态不稳,间见双手头肩不自主抖动,接触不良,违拗明显,体查不合作。家族史:父亲40岁时出现行走不稳,记忆力下降,智能减退。姐姐有癫痫史,智能尚可,行走稍欠稳,易摔跤。患者一个伯父有癫痫发作,叔公家的堂伯、堂姑、堂姑儿子智能低下,行走欠稳,因经济较差,家中的其他人均未行基因检测。见图 3。
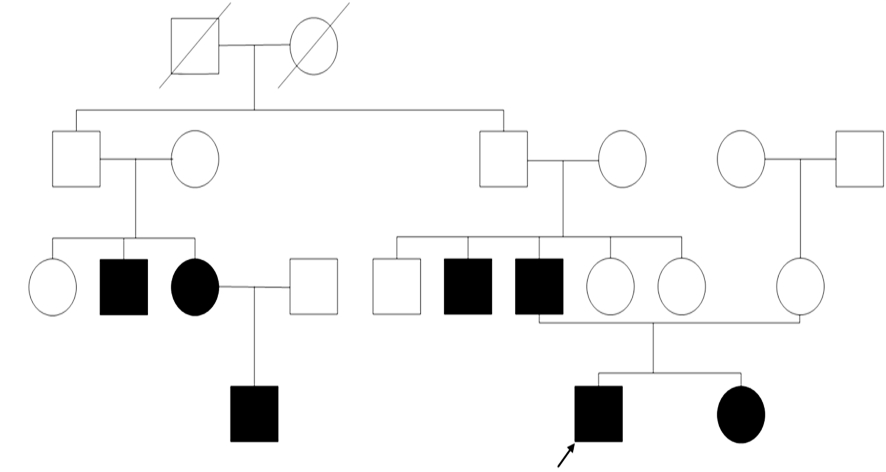
|
| 图 3 病例3家族图谱。 |
病例4:女性,31岁。22岁怀孕后期出现强直阵挛发作,数月发作1次,平时每日数次肌阵挛发作,双手震颤(紧张时明显),记忆力下降,反应迟缓。体查:行走稍欠稳,爆破性语言,计算力差,轻微旋转性眼震,指鼻欠准,轮替动作笨拙,Romberg’s sign(+)。家族史:母亲有“紧张精神时全身抖动明显”,58岁去世。外公亦有类似病史,行走不稳,后期坐轮椅。见图 4。
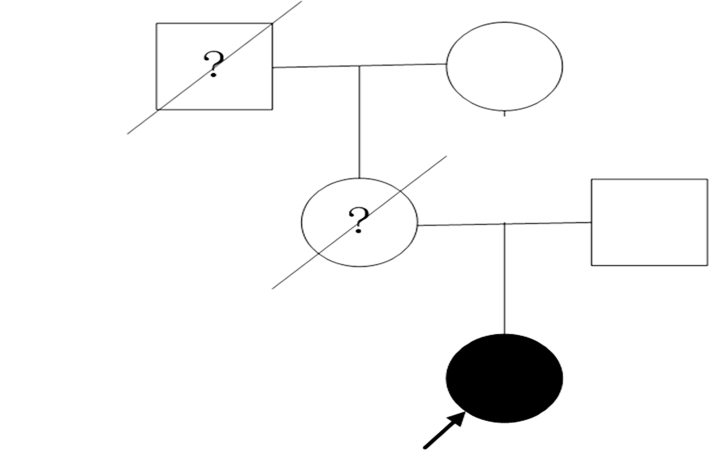
|
| 图 4 病例4家族图谱。 |
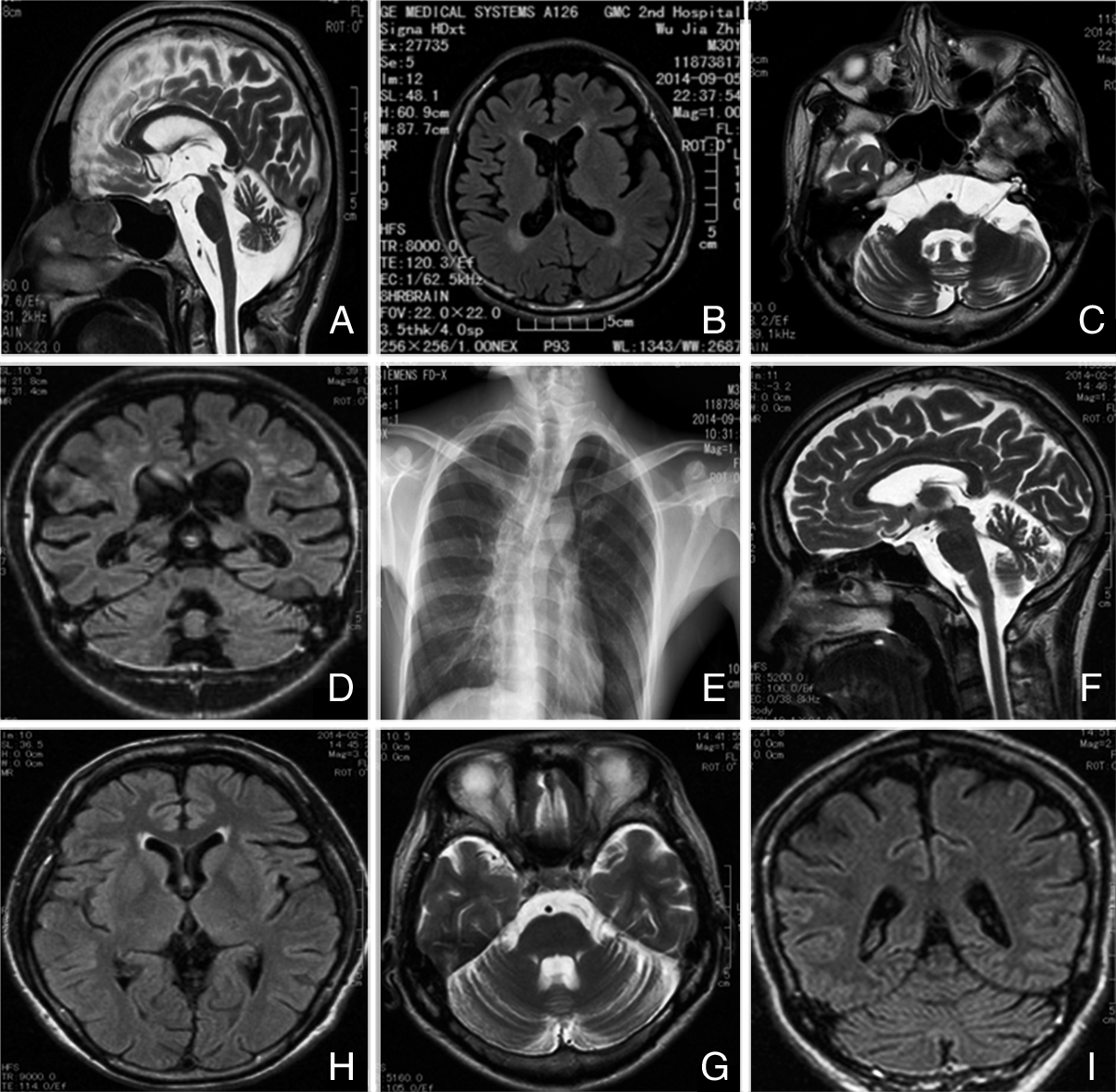
头颅核磁共振成像:病例1、病例2、病例3 的 MRI示两侧侧脑室前、后角周围白脑质对称的淡薄斑片状T2 Flair高信号;双侧脑沟,脑裂明显增宽变深;桥前池,环池及小脑延髓池明显增宽扩大,脑室系统扩大。提示广泛重度脑皮质、脑干、小脑萎缩,双侧脑白质变性改变。病例4头颅MRI示脑沟脑裂增宽加深,脑室系统轻度增宽,考虑轻度脑萎缩。见图 5。
|
| 图 5 患者头颅MRI影像。A:病例1,T2像矢状位,桥前池,环池及小脑延髓池明显增宽扩大;B:病例1,T2 Flair像基底节萎缩,侧脑室前后角周围脑白质对称的淡薄斑片状高信号;C:病例1,T2像轴位,脑干、小脑齿状核明显萎缩;D:病例1,T2 Flair像冠状位,脑沟,脑裂明显增宽变深,脑室扩大,皮层下白质斑片状信号增高;E:病例1,胸片,双侧锁骨平宽,脊柱侧弯;F:病例4,T2像矢状位,桥前池,环池及小脑延髓池轻度增宽扩大;H:病例4,T2 Flair像基底节未见明显异常;G:病例4,T2像轴位,脑干轻度萎缩;I:病例4,T2 Flair像冠状位,脑沟,脑裂略增宽变深。 |
脑电图:病例1,脑电背景偏慢化,为持续中低波幅6~7 Hz θ节律,频见多灶性放电(双侧顶、枕、后颞、双侧中央中线中-高波幅尖波、尖慢波)。病例2,脑电背景慢化,为持续各导中低波幅2~2.5 Hz δ活动。各导夹杂低幅尖波,棘波发放。病例3,脑电背景慢化,为持续各导中低波幅3~4.5Hz δ活动。各导较多尖波,棘波发放。病例4,脑电背景正常,频见全面性高至极高幅单个或3~4Hz棘慢波短程阵发。
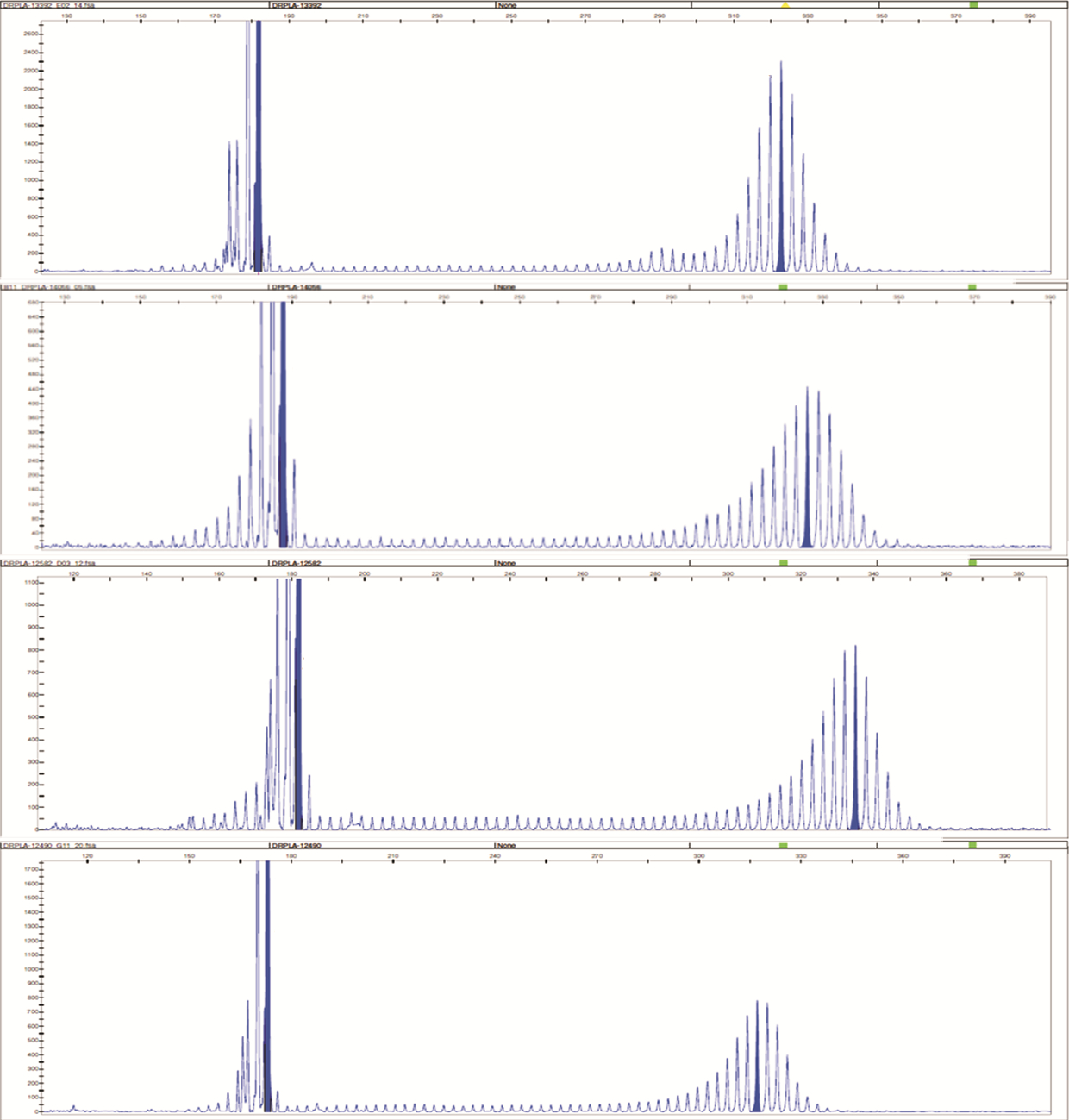
2.2 基因检测结果DRPLA基因的CAG重复数:病例1为15/64次,病例2为17/65次,病例3为15/68次,病例4为12/62次。4位患者血清检测到的SCA1、2、3、6、7、12相关基因的CAG重复数结果均属于正常范围。见图 6。
|
| 图 6 DRPLA基因检测结果。A:病例1 DRPLA基因CAG重复次数15/64次;B:病例2 DRPLA基因CAG重复次数为17/65次;C:病例3 DRPLA基因CAG重复次数为15/68次;D:病例4 DRPLA基因CAG重复数为12/62次。 |
DRPLA基因定位于12p13.31区,编码在中枢神经系统广泛表达的蛋白atrophin-1,在DRPLA基因的5号外显子中存在着(CAG)n片段,编码产生一段多聚谷胺酰胺肽链。当(CAG)n重复扩增异常增多,可引起atrophin-1中多聚谷氨酰胺链过长,使atrophin-1产生细胞毒性,最终引起神经元变性坏死[2]。
DRPLA临床表现有明显异质性,大部分患者以共济失调为主症,同时伴有肌阵挛、癫痫、智能减退、不自主运动、精神行为异常等一种或几种临床症状,亦有部分患者早期共济失调不明显,或以精神症状为主。多项临床观察发现20岁前起病的患者均有癫痫发作,20岁后起病的患者可能会出现癫痫,40岁后起病的患者癫痫发生几率很小。癫痫发作类型包括:肌阵挛、强直、阵挛、强直-阵挛等全面性发作。在临床上根据患者起病年龄分为少年型和成年型。少年型起病年龄低于20岁,通常有进行性肌阵挛、癫痫、进展性共济失调、智力倒退,可伴有不自主运动或精神异常。其中部分患者在婴儿期或儿童期起病,有严重精神运动发育迟缓,并可能伴有植物神经功能紊乱,多于起病后10年内死亡[3]。本组3例少年型患者中2例有高弓足,宽肩,1例有脊柱侧弯,提示该型可能伴有骨骼发育异常。成年型则分为早发型和晚发型,早发型以共济失调为主症,多伴有不自主运动,可伴有痴呆和癫痫发作;晚发型为40岁后发病,有共济失调步态、构音障碍和记忆力下降等症状。
20岁前起病的患者需要与lafora病、翁韦里希特氏病、神经元腊样脂褐质病、MERRF病、家族性肌阵挛性癫痫、戈谢病等进行鉴别,而20岁后起病的患者需要与亨廷顿病、其它的遗传性脊髓小脑性共济失调鉴别。如果MRI矢状位显示脑桥被盖部有显著的萎缩则对诊断DRPLA有特别意义[3]。
CAG重复次数的多少与起病年龄、临床表现的异质性、MRI呈现的脑萎缩程度、范围及预后、生存时间密切相关。(CAG)n扩增次数越多,起病年龄越早,病情越重,影像学和脑电异常更明显。正常人群CAG重复次数为6~35次,大部分少于20次。在DRPLA患者中则≥49次,伴有进行性肌阵挛性发作的少年型病人≥64次。本组3例少年型患者CAG重复次数均大于64次,而且分析其病史和家族史均有明显的遗传早现及父传子现象,其原因可能为扩增后的(CAG)n结构在生殖细胞减数分裂时极不稳定,精子中的(CAG)n结构更容易发生较大的扩增,因此父系遗传对临床表型影响更大[1, 4]。
DRPLA绝大多数家系报道来源于日本,迄今我国大陆仅有4例家系报道[5, 6],台湾及香港分别有1例和2例家系报道[8]。其中国内的3个DRPLA家系是通过对708个SCA家系的先证者和119例散发SCA患者进行基因分析检出发现的[5],而另一项对67个SCA家系的先证者和66个散发SCA患者的研究则未发现DRPLA基因(CAG)n扩展异常增多[7]。由此可见,DRPLA在中国人群中是罕见的。
另一方面检出率低可能也与部分患者未被纳入检测有关。我们分析在既往的筛选研究中,选取的检测对象主要为成年的共济失调患者,而少年型或青年早期型患者由于有长期癫痫发作史,行走不稳等运动能力减退伴随着智能下降容易被误认为是脑瘫或其它癫痫性脑病所致,部分掩盖了共济失调这一表征。为了避免误诊、漏诊,我们建议对出现肌阵挛发作并伴共济失调的癫痫病人,尤其同时有智能减退,精神症状和不自主运动的患者,应该及时进行MRI检查,如果MRI显示有小脑,脑干,基底节萎缩,则需要进一步作DRPLA基因检测。
| [1] | Maruyama S, Saito Y, Nakagawa E, et al. Importance of CAG repeat length in childhood-onset dentatorubral-pallidoluysian atrophy. J Neurol, 2012, 259(11):2329-2334. |
| [2] | Yamada M. Dentatorubral-pallidoluysian atrophy (DRPLA). Neuropathology, 2010, 30(5):453-457. |
| [3] | Tsuji S. Dentatorubral-pallidoluysian atrophy. Handb Clin Neurol, 2012, 103:587-594. |
| [4] | Hasegawa A, Ikeuchi T, Koide R, et al. Long-term disability and prognosis in dentatorubral-pallidoluysian atrophy:a correlation with CAG repeat Length. Mov Disord, 2010, 25(11):1694-1700. |
| [5] | 张鑫,郝莹,顾卫红,等.齿状核红核苍白球路易氏体萎缩症家系的临床和基因突变分析.中华医学遗传学杂志, 2013, 30(1):31-35. |
| [6] | 陈涓涓,曾振兴,吴军,等.以认知功能障碍为首发症状的齿状核红核苍白球路易体萎缩症一家系的临床、基因特点.中华神经科杂志, 2013, 46(10):692-696. |
| [7] | 宋兴旺,唐北沙,江泓,等.中国大陆南方汉族正常人群齿状核红核苍白球路易体萎缩基因三核苷酸重复变异研究.中华神经医学杂志, 2006, 5(9):915-917. |
| [8] | Yam WK, Wu NS, Lo IF, et al. Dentatorubral-pallidoluysian atrophy in two Chinese families in Hong Kong. Hong Kong Med J, 2004, 10(1):53-56. |
 2015, Vol. 42
2015, Vol. 42

