扩展功能
文章信息
- 李超
- LI Chao
- 应用甘油果糖联合吡拉西坦治疗2型糖尿病患者脑出血后脑水肿的临床观察
- Therapeutic effects of glycerol fructose combined with piracetam in treatment of encephaledema after intracerebral hemorrhage in patients with type II diabetes
- 国际神经病学神经外科学杂志, 2015, 42(4): 324-328
- Disease Surveillance, 2015, 42(4): 324-328
-
文章历史
- 收稿日期: 2015-04-15
- 修回日期: 2015-08-10
脑出血(intracerebral hemorrhage,ICH)是指原发性非外伤性脑实质内血管破裂引起的出血,常见病因包括高血压合并小动脉硬化、动脉瘤及脑血管畸形等,是一种临床急危重症[1]。脑水肿是脑出血后重要的并发症,一般在ICH 48 h后达到高峰,持续3 d至3周不等,其发生可加重颅内压增高,甚者导致脑疝形成,是影响脑出血死亡率和神经功能恢复的重要因素[1, 2, 3]。控制脑水肿传统治疗方案为甘露醇脱水降颅压,但近年来研究发现长期大剂量使用甘露醇容易发生肾功能不全和电解质紊乱等不良反应[4]。糖尿病患者由于本身疾病特征易合并肾功能不全和电解质紊乱,该类患者若发生脑出血或脑水肿,选择更为安全有效的治疗手段,对降低其死亡率,改善愈后具有重要意义。本研究即在该领域进行探讨,以供临床参考。
1 资料与方法 1.1 研究对象选取2013年1月至2014年12月在我院神经外科住院的138例2型糖尿病合并脑出血患者,随机分为三组:甘露醇组、甘油果糖组和甘油果糖-吡拉西坦联合组(合剂组),每组46例。
入组标准:①符合2型糖尿病和脑出血的诊断标准[5, 6];②经头颅CT和(或)MRI确诊基底节区脑出血,出血量10~30 mL;③脑出血首次发作,且在发病24 h内入院接受治疗;④患者意识清楚。
排除标准:①严重心、肝、肾功能障碍;②哺乳期或妊娠期妇女;③药物过敏;④精神障碍或癫痫患者。治疗过程中密切监测患者病情变化,若出现病情加重需手术者,或出现严重不良反应包括器官衰竭者,退出研究。
1.2 治疗方法所有患者安静卧床,并根据病情给予调整血压、液体支持等基础治疗。同时甘露醇组给予20%甘露醇250 mL静脉注射,每8小时1次,连续10 d;甘油果糖组给予甘油果糖注射液250 mL静脉注射,每12小时1次,连续10 d;合剂组给予甘油果糖注射液250 mL静脉注射,每12小时1次,联合吡拉西坦氯化钠注射液(山东威高药业有限公司,100 mL含吡拉西坦20 g)100 mL静脉注射,每8小时1次,连续10 d。
1.3 疗效观察指标 1.3.1 症状缓解率在首次用药2 h后,通过询问患者病情,统计各组患者恶心、呕吐、头痛等高颅压症状缓解情况。
1.3.2 颅内压的变化情况通过监测颅内压(intracranial pressure,ICP),记录ICP最大降幅及达到高峰时所需时间,并以ICP较基线值降低25%定义药物有效,记录患者药物作用起效时间和持续时间。
1.3.3 颅内血肿体积及水肿体积的变化情况分别于入院时,治疗第2天和第20天,对所有患者进行三次头颅CT检查。脑出血及水肿带体积按田氏公式计算,即最大横截面长轴×最大横截面短轴×出血层面(或水肿层面)×π/6[1]。颅内水肿体积=水肿带体积-脑出血体积,脑出血体积以入院时CT结果作为基线水平,颅内水肿体积以第二次CT结果计算所得水肿体积作为基线水平,比较三组患者在治疗第20天时脑出血和颅内水肿吸收情况。
1.3.4 神经功能改善情况于治疗前和治疗第20天,对所有患者采用斯堪的那维亚卒中量表(SSS)进行评分,比较三组患者治疗后神经功能改善情况。
1.4 安全性评价指标分别于治疗后第3天、第7天和第20天三次抽取静脉血检测患者血清肌酐值和血钾浓度,记录各组血清肌酐升高≥44.2 μmol/L或肌酐绝对值≥133 μmol/L的例数,及血钾浓度≥6.0 mmol/L或<3.5 mmol/L的患者例数。
1.5 统计学方法应用 SPSS 19.0软件进行数据处理,计量资料采用(x± s )表示,三组间均数比较采用方差分析,组间两两比较采用SNK-q检验;计数资料以率(%)表示,组间比较采用χ2检验。多个样本率的两两比较检验水准以P<0.025为差异有统计学意义;其余以P<0.05为差异有统计学意义。
2 结果 2.1 基线资料的比较三组在年龄、性别、发病到接受治疗时长和高血压患病率等临床资料的比较中,差异无统计学意义(P>0.05),具有可比性,见表 1。
| 组别 | 例数 | 年龄(x± s ) | 男/女(例) | 发病到接受治疗时长(x± s ) | 高血压[n(%)] |
| 甘露醇组 | 46 | 60.76±9.19 | 29/17 | 20.52±7.13 | 15(32.61) |
| 甘油果糖组 | 46 | 59.10±11.28 | 31/15 | 19.37±8.19 | 13(28.26) |
| 合剂组 | 46 | 61.48±9.89 | 28/18 | 19.46±10.85 | 19(41.30) |
三组患者首次用药后,高颅压症状缓解率分别为97.83%、93.48%和97.83%,组间差异无统计学意义。
2.3 ICP变化情况三组患者首次用药后颅内压随时间变化情况如图 1,三组颅内压均迅速下降,约1 h时达到谷底,之后缓慢回升。首次用药后颅内压最大降幅、起效时间、高峰时间和持续时间等指标,合剂组与甘露醇组差异也均无统计学意义,但合剂组颅内压最大降幅和起效时间同甘油果糖组差异具有统计学意义(见表 2)。
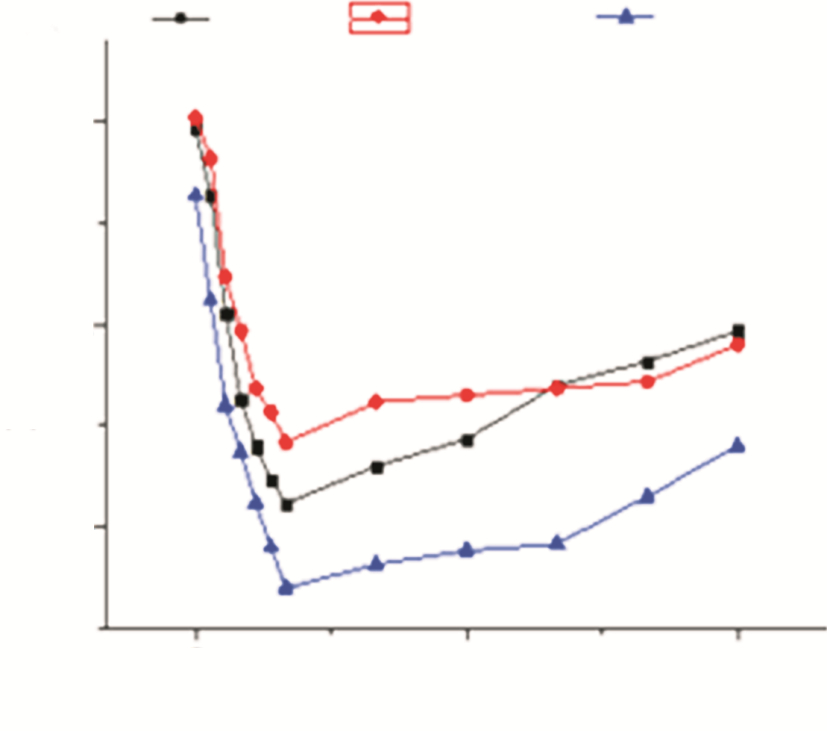
|
| 图 1 首次用药后ICP随时间变化情况。 |
| [x± s ] | |||||
| 组别 | 例数 | ICP降幅 | 起效时间 | 高峰时间 | 持续时间 |
| 甘露醇组 | 46 | 13.2±4.7 | 0.44±0.20 | 1.13±0.25 | 3.98±1.36 |
| 甘油果糖组 | 46 | 10.5±4.5* | 0.62±0.22** | 1.27±0.31 | 4.21±1.59 |
| 合剂组 | 46 | 12.8±4.9 | 0.42±0.19 | 1.15±0.27 | 4.66±2.01 |
| 注:*为与合剂组相比较,P<0.01;**为与合剂组比较,P<0.05。 | |||||
三组患者脑出血(入院时)和颅内水肿(治疗第2天)的基线体积差异无统计学意义;治疗后第20天,三组颅内血肿和颅内水肿减少量分别为13.9±5.6 mL和11.3±5.2 mL、13.4±4.7 mL和10.5±5.7 mL、16.6±5.9 mL和14.3±6.2 mL,合剂组同甘露醇组及甘油果糖组之间的差异均有统计学意义。见图 2。
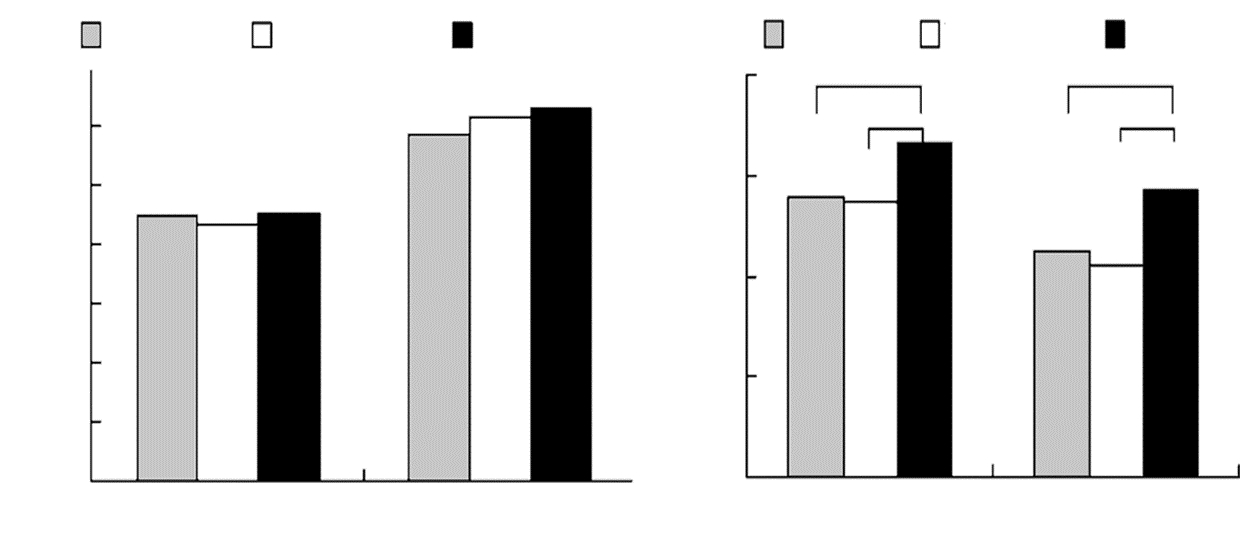
|
| 图 2 脑出血及颅内水肿的变化情况。A:三组患者脑出血和颅内水肿基线体积的比较;B:三组患者脑出血和颅内水肿吸收量的比较(**P<0.01; *P<0.05)。 |
入院时三组患者SSS评分见差异无统计学意义,治疗20天后再次进行SSS评分,三组均较入院时明显改善,三组SSS评分同入院时差值分别为15.12±6.87、14.18±5.76和19.12±7.27,合剂组显著优于甘露醇组合甘油果糖组。见图 3。
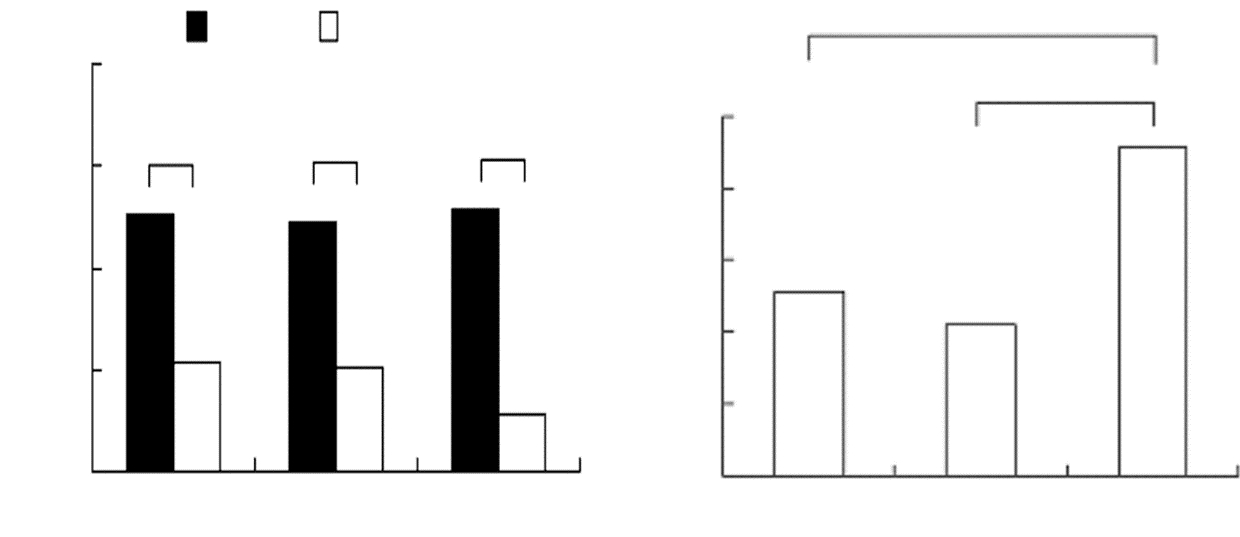
|
| 图 3 神经功能改善情况。A:三组患者治疗前后SSS评分结果的比较;B:三组治疗前后SSS评分差值的比较。**P<0.01。 |
甘油果糖组和合剂组分别同甘露醇组做两两比较,以α=0.025作为检验水准,甘油果糖组和合剂组肾功能异常的发生率同甘露醇组的差异均有统计学意义;甘油果糖组电解质紊乱发生率和甘露醇组的差别具有统计学意义,但合剂组同甘露醇组的差别无统计学意义,见表 3。
| [n(%)] | |||
| 组别 | 总例数 | 肾功能异常 | 电解质紊乱 |
| 甘露醇组 | 46 | 13(28.3) | 11(23.9) |
| 甘油果糖组 | 46 | 3(6.5)* | 3(6.5)* |
| 合剂组 | 46 | 3(6.5)* | 4(8.7) |
| 注:*为与甘露醇组比较,P<0.025。 | |||
脑出血后脑水肿是影响脑出血死亡率及神经功能恢复的重要因素。积极控制脑水肿,降低颅内压是脑出血急性期治疗的关键[2, 3]。目前,甘露醇脱水降颅压是治疗脑出血后脑水肿应用最广泛的方案,尤其在脑出血重症患者治疗中,其效果显著[4, 7]。但近年来,越来越多的临床研究发现应用甘露醇治疗脑水肿,特别是长期大剂量应用甘露醇,易导致患者肾功能异常及电解质紊乱,迫切需要一种更为安全有效的替代治疗方式[8]。糖尿病既是脑出血的危险因素,也更容易合并肾功能异常和电解质紊乱,为该类患者合并脑出血后选择更为安全有效的治疗方案意义重大。
甘油果糖治疗脑水肿的作用机制与甘露醇相似,也是一种高渗性脱水药物,与甘露醇相比,甘油果糖起效慢,降压作用小,作用时间长,肾损伤作用较小,在临床中多用于脑出血轻症患者[9]。王世金等[10]的一项随机对照试验发现对于轻症脑出血患者,甘油果糖的治疗效果和安全性均优于甘露醇。黎明丽等[11]一项纳入10项RCT,包括1174例患者的meta分析表明甘油果糖与甘露醇降低颅内高压的疗效相当,但甘油果糖安全性更佳。
吡拉西坦原为一种脑代谢改善药,可促进脑内ATP的生成,促进脑内代谢,Marisco等[12]发现吡拉西坦可以减轻氧化应激,维持脑核苷酸双磷酸酶,5’核苷酸酶和腺苷脱氢酶的活性,以保护脑神经,促进脑功能恢复。另外,也有研究发现吡拉西坦具有减少神经细胞凋亡的作用[13]。同时,20%吡拉西坦氯化钠注射液除了改善脑内代谢的作用外,同时是一种高渗性脱水药,其应用于脑出血患者可同时发挥其脱水降颅压和神经保护的双重功能,李超生等[14]的一项随机对照试验对比吡拉西坦和甘露醇治疗脑出血的疗效,发现两者降颅压的作用无明显差异,但前者改善患者神经功能的作用更显著。近年来,还有多项研究发现吡拉西坦同甘露醇等其他药物联合应用治疗脑出血的效果明显,且未发现长期应用会造成肾功能异常[15]。
本研究联合甘油果糖和吡拉西坦两种肾损害型小的高渗性脱水药应用于2型糖尿病合并脑出血患者,结果证实,合剂组在高颅压症状缓解率、颅内压最大降幅、药物起效时间、作用高峰时间和持续时间等指标均与甘露醇组无显著差别,而促进脑出血和颅内水肿吸收的作用及改善神经功能作用优于单用甘露醇和单用甘油果糖组。同时,合剂组肾功能异常和电解质紊乱发生率均小于甘露醇组。
综上所述,本研究认为对于2型糖尿病合并脑出血脑水肿患者,应用甘油果糖联合吡拉西坦较传统单用甘露更为安全,神经功能恢复效果更佳,值得临床推广。
| [1] | 王文娟,刘艳芳,赵性泉.脑出血治疗指南.中国卒中杂志, 2006, 12:888-899. |
| [2] | 吕美光,张小文,宋海锋,等.高血压性脑出血早期强化降血压近期预后的临床研究.中国医药科学, 2014, 04:11-14. |
| [3] | 张逵,张渊,范润金,等.高血压性小脑出血的手术治疗.国际神经病学神经外科学杂志, 2014, 41(6):510-513. |
| [4] | Gray J, Morbitzer K, Xi LD, et al. Hyponatremia in Patients with Spontaneous Intracerebral Hemorrhage. J Clin Med, 2014, 3(4):1322-1332. |
| [5] | 陆菊明.中国2型糖尿病防治指南(2013年版)更新要点的解读.中国糖尿病杂志, 2014, 10:865-869. |
| [6] | 张苏明.中国脑血管病(脑出血)防治指南介绍.中华医学会第十三次全国神经病学学术会议论文汇编, 2010, 1. |
| [7] | Abel W, Aileen MC, Ian R, et al. Mannitol for acute traumatic brain injury. Cochrane Database Syst Rev, 2013, 8:CD001049. |
| [8] | Solomon R, Werner C, Mann D, et al. Effects of saline, mannitol, and furosemide to prevent acute decreases in renal function induced by radiocon trast agents. N Engl J Med, 1994, 331(21):1416-1420. |
| [9] | 王丽泉,侯庆先,袁宏.甘油果糖与甘露醇治疗脑水肿的临床疗效比较.中国医药导报, 2007, 4(10X):136. |
| [10] | 王世金,赵海滨.甘油果糖及甘露醇用于少量脑出血效果比较.山东医药, 2011, 27:46-47. |
| [11] | 黎明丽,宋薇,胡汉昆,等.甘油果糖注射液对比甘露醇注射液治疗脑水肿疗效和安全性的Meta分析.中国药房, 2014, 44:4140-4143. |
| [12] | Marisco PC, Carvalho FB, Rosa MM, et al. Piracetam Prevents Scopolamine-Induced Memory Impairment and Decrease of NTPDase, 5'-Nucleotidase and Adenosine Deaminase Activities. Neurochem Res, 2013, 38(8):1704-1714. |
| [13] | Peng X, Min L, Bai Y, et al. The effects of piracetam on heroin-induced CPP and neuronal apoptosis in rats. Drug Alcohol Depend, 2015, 150:141-146. |
| [14] | 李超生,胡玲玲,王引明,等.吡拉西坦氯化钠注射液治疗脑出血的临床观察.中国临床神经外科杂志, 2012, 05:300-302. |
| [15] | 逯爱青.甘露醇联合吡拉西坦治疗脑出血后脑水肿的临床观察.白求恩军医学院学报, 2012, 04:313-314. |
 2015, Vol. 42
2015, Vol. 42
