扩展功能
文章信息
- 殷俊, 李艳冰, 沈琴, 杨晓苏
- YIN Jun, LI Yan-Bing, SHEN Qin, YANG Xiao-Su
- ERK和CREB磷酸化在硫氢化钠对大鼠脑缺血再灌注神经保护的机制探讨
- Roles of ERK and CREB phosphorylation in sodium hydrosulfide-induced neuroprotection after cerebral ischemia-reperfusion in rats
- 国际神经病学神经外科学杂志, 2015, 42(3): 223-228
- Disease Surveillance, 2015, 42(3): 223-228
-
文章历史
- 收稿日期: 2015-03-02
- 修回日期: 2015-04-09
2. 中南大学湘雅医院检验科, 湖南省长沙市 410008
硫化氢(hydrogen sulfide,H2S)是继一氧化氮和一氧化碳之后发现的一种新的气体信号分子,在神经系统、心血管活动调节等方面发挥着重要作用[1]。内源性H2S可以直接对中枢神经系统发挥作用,也可通过调节脑血管壁平滑肌张力来调节大脑血供。生理浓度的H2S对神经系统内的多种氧化性物质都有抑制及清除作用,从而减轻氧化应激,具有神经元保护作用。硫氢化钠(sodium hydrosulfide,NaHS)是外源性H2S的供体,吸收入血后能迅速转化成H2S。研究证明NaHS在心肌、肾脏、肝脏、大肠缺血再灌注损伤中能减轻靶器官损害,发挥抗炎、抗凋亡、抗氧化应激的作用[2, 3, 4]。近年来有研究发现NaHS对脑缺血损伤具有神经保护作用,但机制不明[5, 6]。磷酸化的环腺苷酸反应元件结合蛋白(cAMP response element binding protein,p-CREB)在脑损伤中对神经元有重要的保护作用[7]。p-CREB的这种神经保护作用是通过激活相关基因如c-fos和B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)的表达而完成,并通过抑制凋亡,促进修复、再生等使部分细胞在应激性损伤后仍得以存活。本研究拟通过建立局灶性脑缺血再灌注(ischemia-reperfusion,I/R)模型,用NaHS进行干预,动态观察大鼠局灶性脑缺血再灌后海马磷酸化细胞外调节蛋白激酶(phosphorylated extracellular signal-regulated kinase1/2,p-ERK1/2)、p-CREB和Bcl-2蛋白的表达,探讨外源性H2S神经保护作用的可能机制。
1 材料与方法 1.1 实验动物分组与模型制作本实验选用Sprague-Dawley雄性大鼠,随机分为假手术组、模型组(I/R)、NaHS干预组,每组60只,各组按再灌后处死的时间分为6 h,1 d,2 d,5 d,7 d五个亚组,每个亚组各12只。
模型组:采用右侧大脑中动脉栓塞2h后再灌注,参照Longa[8]线栓法制备,线栓采用0.26 mm单丝尼龙钓鱼线,保留2 h后拔出,形成再灌注。灌注前20 min腹腔注射生理盐水1 ml。
假手术组:进行各项手术操作,但线栓仅进入右侧大脑中动脉8~10 mm。 NaHS干预组:右侧大脑中动脉栓塞2 h后再灌注,灌注前20 min腹腔注射NaHS(100 μmol/L)1 ml(购自Sigma公司)。
1.2 取材及分配每亚组随机选取3只大鼠,动物处死后迅速取脑,行TTC染色;每亚组随机选取6只老鼠取梗死侧海马,提取蛋白后-80℃保存,行Western Blot检测;每亚组随机选取3只老鼠灌注、固定、脱水后冰冻切片机切片(脑片厚20 μm),贴片晾干后放入-80℃保存,行尼氏染色和免疫组化。
1.3 四氮唑红(TTC)染色大鼠处死后迅速取脑,置-20℃冰箱中冷冻20 min,距额极2 mm开始切片,每片厚2 mm,放入2%TTC(购自Amresco公司)溶液中37℃水浴30 min后,转入4%多聚甲醛中6 h后观察。
1.4 尼氏(Nissl)染色每亚组随机选取3只大鼠,每只8张玻片,按常规Nissl法进行染色。
1.5 Western Blot检测从各组蛋白样品中取25 μg总蛋白量进行蛋白电泳(10% SDS-PAGE,20~30 mA,2 h)和转膜(PVDF膜,200 mA,2 h)。先后用p-ERK1/2(1∶1000,购自CST公司)、p-CREB(1∶800,购自CST公司)和内参照β-actin(1∶2000,购自碧云天公司)一抗和辣根过氧化物酶标记的山羊抗兔/小鼠二抗(1∶2000)进行Western blot,分别检测ERK1/2和CREB 的磷酸化水平。
1.6 免疫组织化学染色用SABC法进行Bcl-2免疫组织化学染色。具体步骤参照武汉博士德SABC法试剂盒说明进行。阴性对照采用PBS代替一抗,其余操作同前。
1.7 结果观察用Quantity One软件(Bio-Rad)分析Western Blot图片,将各组的目的蛋白相对值除以β-actin相对值,即各组目的蛋白的相对表达量。免疫组化和尼氏染色采用HPIAS-1000高清晰彩色病理图像分析系统(武大影像工程公司)对切片进行图像分析。每个时间点每只大鼠每个指标随机选取4张切片,每张切片随机选取5个不重复视野,高倍镜下(10×40)观察计数每个视野中阳性细胞数,取均数作为各时间点该指标阳性细胞数。
1.8 统计学处理应用SPSS 13.0统计软件包进行统计学处理。数据用均数±标准差(x±s)表示,组间差异比较用ANOVA及Newman-Student多重比较t检验分析,两指标间相关分析采用双尾Pearson’s相关检验,P < 0.05认为差异有统计学意义。
2 结果 2.1 NaHS对大鼠脑缺血再灌注后脑梗死体积的影响假手术组大鼠脑组织呈一致红色,无梗死组织;I/R组可见右侧脑组织大小不一致的苍白色梗死组织,以距离嗅球尖端5~10 mm区明显,左侧脑组织均呈红色,且缺血灶的范围随再灌注时间的延长而扩大到整个右侧大脑中动脉供血区。NaHS干预组各时间点相对I/R组脑梗死体积减少,差异有统计学意义(P < 0.05)。应用Champion Image HPIAS-1000高清晰度彩色病理图文报告分析系统测出各区脑梗死面积,根据公式V=t(A1+……An)-(A1+An)t/2 算出梗死体积。其中t为切片厚度,A为梗死面积。脑梗死比例为梗死体积/总体积。见图1。

|
| 图 1 NaHS对大鼠脑缺血再灌注后脑梗死体积的影响。A:三组大鼠缺血再灌注24 h TTC染色比较。a:假手术组;b:I/R组;c:NaHS干预组。B:I/R组和NaHS干预组大鼠不同再灌注时刻点脑梗死比例比较。注:*为与I/R组比较,P < 0.05。 |
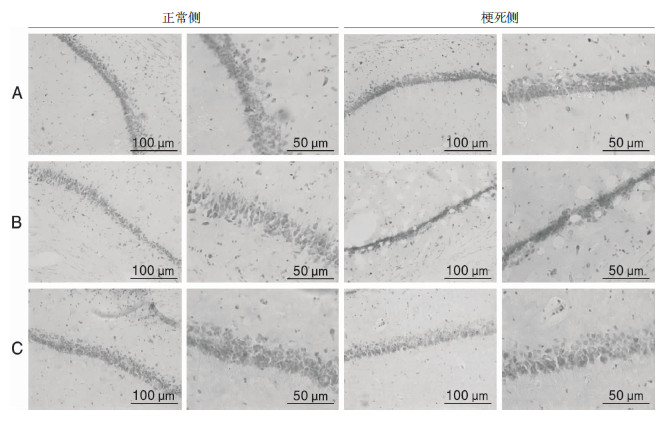
通过尼氏体可辨认或鉴定神经细胞的存在及其分布以及是否发生病理性改变。缺血再灌注6 h,I/R组梗死侧海马CA1区较正常侧深染的神经元减少,有一部分神经元染色变淡,一些神经元轮廓不清楚,24 h组深染的神经元明显减少。NaHS干预组相对I/R组梗死侧神经元表达增加,差异有统计学意义(P < 0.05)。见图2。
|
| 图 2 尼氏染色示大鼠缺血再灌注24 h后海马CA1区神经元表达情况。A:假手术组;B:I/R组;C:NaHS干预组。 |
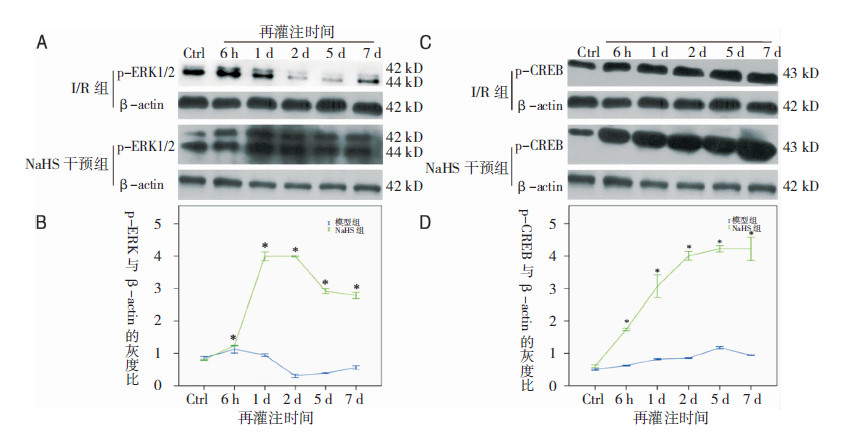
I/R组再灌注6 h时p-ERK1/2表达量稍增加,但其平均灰度值较假手术组无统计学意义(P>0.05);6 h后p-ERK1/2表达下降,再灌注2 d降到低谷后开始上升,7 d组和假手术组无明显差别。NaHS干预组p-ERK1/2再灌注后各时间点表达均明显增加,从6 h表达上调,1 d上升到峰值,组间平均灰度值比较差异明显,与I/R组相比差异有统计学意义(P ltq0.01)。I/R组再灌注6 h时p-CREB表达量稍增加,除5 d外其平均灰度值相对假手术组无统计学意义(P>0.05)。与I/R组相比,NaHS干预组再灌注各时间点p-CREB表达均明显增加,从6 h表达上调,5 d上升到高峰,组间平均灰度值比较差异明显,与I/R组相比差异有统计学意义(P < 0.01)。见图3。
|
| 图 3 NaHS对缺血再灌注损伤大鼠海马ERK 和CREB 磷酸化的影响。A:I/R组和NaHS干预组大鼠不同再灌注时刻点海马p-ERK1/2 的Western blot图谱。B:I/R组和NaHS干预组大鼠不同再灌注时刻点海马p-ERK1/2与β-actin灰度比趋势图。注:*为与I/R组比较,P < 0.05。C:I/R组和NaHS干预组大鼠不同再灌注时刻点海马p-CREB 的Western blot图谱。D:I/R组和NaHS干预组大鼠不同再灌注时刻点海马p-CREB与β-actin灰度比趋势图。注:*为与I/R组比较,P < 0.05。 |
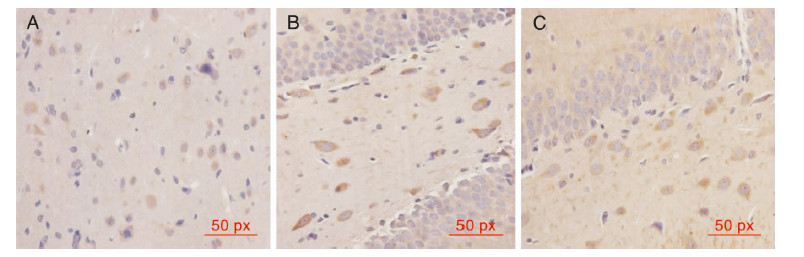
I/R组再灌注后6 h海马区神经元Bcl-2蛋白阳性表达增加,1 d达到峰值,阳性细胞计数明显增高,2 d组和5 d组表达有所下降,但仍高于假手术组。形态学上多数阳性细胞体积较大,细胞轮廓清晰,胞浆可见明显阳性表达,呈棕黄色。与假手术组比,缺血各组再灌注后各时间点Bcl-2蛋白表达增加,差异有统计学意义(P < 0.05)。与I/R组相比,NaHS组再灌注各时间点阳性表达的细胞数量均明显增多,差异有统计学意义(P < 0.05)。见表1、图4。
| (n=6, x±s) | |||||
| 6 h | 1 d | 2 d | 5 d | 7 d | |
| 假手术组 | 2.35±0.37 | 2.40±0.31 | 2.27±0.33 | 2.45±0.24 | 2.31±0.54 |
| I/R组 | 7.40±0.71* | 15.81±0.96* | 9.32±1.17* | 8.4±1.56* | 7.70±1.30* |
| NaHS干预组 | 7.28±0.92* | 17.41±1.1*# | 11.70±1.34*# | 9.23±1.10*# | 8.34±1.02* |
| 注:*为与假手术组相比较,P < 0.05;#为与模型组比较,P < 0.05。 | |||||
|
| 图 4 免疫组织化学示大鼠缺血再灌注1 d后缺血海马区神经元Bcl-2蛋白的表达(10×40)。A:假手术组;B:I/R组;C:NaHS干预组。 |
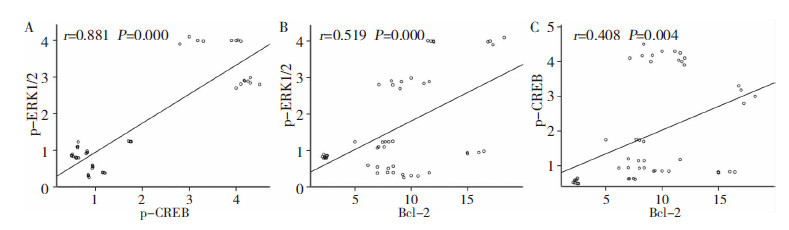
取I/R组,NaHS干预组再灌后各时间点p-ERK1/2和p-CREB灰度比、Bcl-2蛋白阳性细胞数分别进行双尾Pearson’s相关检验,其中p-ERK1/2和p-CREB灰度比之间的相关系数为0.881(P < 0.01),两者呈高度正相关;p-ERK1/2和Bcl-2蛋白表达之间的相关系数为0.519(P < 0.01),两者中度正相关;Bcl-2和p-CREB表达之间的相关系数为0.408(P < 0.01),两者中度正相关。见图5。
|
| 图 5 p-ERK1/2、p-CREB和Bcl-2蛋白表达的直线相关分析。A:p-ERK1/2和p-CREB;B:p-ERK1/2和Bcl-2;C:p-CREB和Bcl-2。 |
大量临床和实验研究表明,脑缺血再灌注可导致大脑缺血缺氧易感区海马发生迟发性神经元死亡,其主要的原因是神经元凋亡[9]。脑缺血再灌注后细胞凋亡呈动态改变,本研究也显示再灌6 h海马区已出现凋亡细胞,2 d后海马CA1区发生了明显的神经元死亡。
ERK1/2属于MAPKs家族的一员,ERK1/2主要被丝裂源刺激物激活,随后导致一系列转录因子的活化,并最终调节细胞增殖和分化。一般情况下,ERK1/2的磷酸化和一些保护机制有密切联系。ERK通路是通过哪些基因来参与脑缺血再灌注损伤的保护,它的上游调节机制有哪些,目前所知甚少。研究表明[10],大鼠脑缺血后初期海马CA1区神经元细胞体内ERK表达增强,可能通过活化神经保护性的基因转录而起神经保护作用。用Western blot和激光共聚焦显微镜在大鼠脑缺血模型上观察15 min脑缺血后MAPK 的活性变化,发现缺血再灌注后30 min和4 h在耐受缺血的CA3/DG 区细胞核有p-ERK表达,在死亡的CA1区神经元无表达,提示ERK参与缺血后的细胞保护[11]。采用沙土鼠前脑缺血再灌注损伤模型的研究表明,缺血预处理可能通过抑制CA1区JNK磷酸化、增强CA3区ERK 活性而保护海马细胞[12]。本研究显示大鼠中动脉缺血2 h再灌6 h海马p-ERK1/2表达略微升高后及开始降低,2 d降至低谷后缓慢上升,14 d基本恢复到正常水平。与I/R组相比,NaHS干预组在再灌注后海马p-ERK1/2开始升高,1 d达到峰值,2 d后开始下降,7 d仍高于假手术组。NaHS干预后能明显促进ERK1/2的磷酸化,促进下游分子的表达。提示使梗死体积减小及神经元凋亡减少的NaHS可能通过促进p-ERK的表达而参与神经保护。
既往研究表明,CREB是很多信号分子的目标蛋白,包括ERK;CREB的激活可能依赖于ERK通路[13]。CREB是所有细胞生长、增值、分化、存活所必须的,在所有器官中均有表达。在脑中,CREB和cAMP反应元件(cAMP response element,CRE)介导的信号系统参与了记忆、学习、突触传递、神经元的存活分化和轴突生长等。在动物实验中,短暂性缺血损伤可以使神经元内的CREB发生磷酸化[14],并使CRE启动转录基因表达。在海马区CA1锥神经元中,短暂性脑缺血引起的CREB磷酸化是短暂的,但在齿状回颗粒细胞中却有所延长[11],当CA1锥神经元随着缺血损伤而出现明显的死亡时,齿状回颗粒细胞却大量的存活,即在齿状回中起神经保护作用的可能是CREB。在全脑缺血模型中,梗死周围区p-CREB水平显著增高,而梗死中心区p-CREB阳性细胞数明显减少。我们的数据显示大鼠大脑中动脉缺血2 h后再灌注,I/R组再灌注各时刻点海马p-CREB表达略微升高,推测是缺血缺氧后CREB发生磷酸化而发挥神经元自我保护所致。与I/R组相比,NaHS干预组在再灌注后海马p-CREB开始升高,2 d达到峰值并且稳定,一直持续至7 d。支持NaHS的脑保护作用可能是通过促进p-ERK表达进而促进其目标蛋白p-CREB表达而实现的。
研究表明,CREB的神经保护作用是在其激活后通过对早期基因产物c-fos、Bcl-2蛋白、神经营养因子等转录的调控,来抑制神经元的凋亡和促进细胞的修复,使部分细胞在应激性损伤后得以存活[15]。有研究发现,在大鼠MCAO模型中,30 min预适应处理后,Bcl-2蛋白的表达增加抑制了神经元凋亡,有利于神经元生长存活,发挥神经保护作用。该机制中Bcl-2基因的转录依赖于CREB磷酸化水平,应用CRE诱饵寡核苷酸后Bcl-2的表达被阻断,无法发挥缺血预适应保护作用[15]。本研究显示海马区Bcl-2阳性细胞于再灌6 h后开始出现,1 d达高峰,随后呈下降趋势,提示Bcl-2蛋白可能在抑制细胞凋亡中发挥保护作用。NaHS能显著增加Bcl-2蛋白表达,进一步发挥抗凋亡作用。通过对p-ERK1/2、p-CREB和Bcl-2蛋白两两进行双尾Pearson’s相关检验发现三者均存在正相关关系。且p-ERK1/2、p-CREB高度相关。综合文献与本实验的结果,我们认为NaHS可能通过增加海马神经元ERK1/2的磷酸化,致使CREB磷酸化而被激活,p-CREB进而上调Bcl-2蛋白的表达,发挥其在脑缺血再灌注损伤时的神经元保护作用,减少脑梗死体积。
| [1] | Chen WL, Niu YY, Jiang WZ, et al. Neuroprotective effects of hydrogen sulfide and the underlying signaling pathways. Rev Neurosci, 2015, 26(2): 129-142. |
| [2] | Qipshidze N, Metreveli N, Mishra PK, et al. Hydrogen sulfide mitigates cardiac remodeling during myocardial infarction via improvement of angiogenesis. Int J Biol Sci, 2012, 8(4): 430-441. |
| [3] | Biermann J, Lagrèze WA, Schallner N, et al. Inhalative preconditioning with hydrogen sulfide attenuated apoptosis after retinal ischemia/reperfusion injury.Mol Vis,2011,17: 1275-1286. |
| [4] | Yan H, Xin S, Wang H, et al. Baicalein inhibits MMP-2 expression in human ovarian cancer cells by suppressing the p38 MAPK-dependent NF-κB signaling pathway. Anticancer Drugs, 2015. [Epub ahead of print]. |
| [5] | Ma L, Liu J, Zhang X, et al. p38 MAPK-dependent Nrf2 induction enhances the resistance of glioma cells against TMZ. Med Oncol, 2015, 32(3): 69. |
| [6] | Lan A, Liao X, Mo L, et al. Hydrogen sulfide protects against chemical hypoxia-induced injury by inhibiting ROS-activated ERK1/2 and p38MAPK signaling pathways in PC12 cells. PLoS One, 2011, 6(10): e25921. |
| [7] | 郑丽君,周芝文,杨杰.二苯乙烯苷对脑缺血再灌注大鼠TrkA及Bcl-2表达的影响.国际神经病学神经外科学杂志, 2013, 40(5): 412-417. |
| [8] | Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke, 1989, 20(1): 84-91. |
| [9] | von Heesen M, Müller S, Keppler U, et al. Preconditioning by Cilostazol Protects against Cold Hepatic Ischemia-Reperfusion Injury. Ann Transplant, 2015, 20: 160-168. |
| [10] | Lee KH, Ho WY, Wu SJ, et al. Modulation of cyclins, p53 and mitogen-activated protein kinases signaling in breast cancer cell lines by 4-(3, 4, 5-trimethoxyphenoxy) benzoic acid. Int J Mol Sci, 2014, 15(1): 743-757. |
| [11] | Liu X, Nie S, Huang D, et al. Mitogen-activated protein kinase and Akt pathways are involved in 4-n-nonyphenol induced apoptosis in mouse Sertoli TM4 cells. Environ Toxicol Pharmacol, 2015, 39(2): 815-824. |
| [12] | Mao XY, Cao YG, Ji Z, et al. Topiramate protects against glutamate excitotoxicity via activating BDNF/TrkB-dependent ERK pathway in rodent hippocampal neurons. Prog Neuropsychopharmacol Biol Psychiatry, 2015, 60: 11-17. |
| [13] | Zeng Z, Leng T, Feng X, et al. Silencing TRPM7 in Mouse Cortical Astrocytes Impairs Cell Proliferation and Migration via ERK and JNK Signaling Pathways. PLoS One, 2015, 10(3): e0119912. |
| [14] | Tanaka K, Nogawa S, Nagata E, et al. Persistent CREB phosphorylation with protection of hippocampal CA1 pyramidal neurons following temporary occlusion of the middle cerebral artery in the rat. Exp Neurol, 2000, 161(2): 462-471. |
| [15] | Kim SS, Jang SA, Seo SR. CREB-mediated Bcl-2 expression contributes to RCAN1 protection from hydrogen peroxide-induced neuronal death. J Cell Biochem, 2013, 114(5): 1115-1123. |
 2015, Vol. 42
2015, Vol. 42


