扩展功能
文章信息
- 卢超, 王非一凡, 王苟思义, 叶宁荣, 李钊, 李学军
- Lu Chao, Wang Fei-Yi-Fan, Wang Gou-Si-Yi, Ye Ning-Rong, Li Zhao, Li Xue-Jun
- 21例脑室内中枢神经细胞瘤的临床分析
- Clinical analysis of 21 cases of intraventricular neurocytoma
- 国际神经病学神经外科学杂志, 2015, 42(2): 159-163
- Disease Surveillance, 2015, 42(2): 159-163
-
文章历史
- 收稿日期:2015-03-20
- 修回日期:2015-05-05
中枢神经细胞瘤(central neurocytoma,CNC)的病理学诊断概念是l982年由Hassoun[1]首次提出,是一类颅内罕见的肿瘤,发病率低,约占颅内肿瘤的0.1%~0.5%,较少有大宗病例的文献报道。中枢神经细胞瘤多见于20~40岁的青壮年,无明显性别差异,常起源于透明隔的基底部,靠近室间孔、穹窿或侧脑室外侧壁[2]。由于侧脑室肿瘤位置深,且肿瘤常受周围组织包绕,故不易被全切,肿瘤复发率较高,预后不理想[3.4]。手术对脑组织的损伤不可避免,因此术后并发症较常见。我院2009年10月至2014年5月收治了21例脑室内中枢神经细胞瘤患者,本文对这些病例进行分析,总结了CNC的临床特征、治疗方法及预后。
1 资料与方法 1.1 一般资料本组患者共计21例,男性11例,女性10例,男女比例为1.1∶1,年龄16~52岁,平均32岁。
1.2 临床表现本组病程6天~2年(平均7个月)。本病例组中最多见的症状为头痛19例(90.5%),其次为视乳头水肿18例(85.7%)、恶心、呕吐l6例(76.2%)及视力下降l3例(61.9%),少见为复视6例(28.6%),轻偏瘫3例(14.3%)(见表 1-1)。
| 临床表现 | 例数(n) | 百分比(%) |
| 发作性头痛 | 19 | 90.5 |
| 恶心、呕吐 | 16 | 76.2 |
| 视乳头水肿 | 18 | 85.7 |
| 体检(无症状) | 2 | 9.5 |
| 轻偏瘫 | 3 | 14.3 |
| 复视 | 6 | 28.6 |
| 视力下降 | 13 | 61.9 |
本组21例患者常规行核磁共振检查,5例神经导航患者术前行磁共振弥散张量成像(DTI)和功能磁共振成像(BOLD-fMRI),7例行CT检查。MRI:双侧脑室不对称扩张,T1和T2像通常呈与皮质信号强度相等或稍强,囊性变和钙化常见,并可见肿瘤血管流空影;T2增强后肿瘤呈中等程度的强化。肿瘤最大直径2~7.3 cm,平均4.3 cm。钙化10例(占47.6%);囊变7例(占33.3%);流空血管影11例(占52.4%),脑室扩大15例(占71.4%)(见图 1-1)。
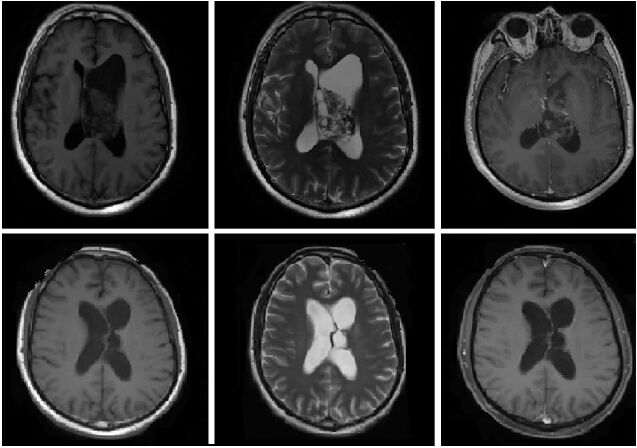
|
| 图 1-1 女性,36岁,术前MRI:T1像表现为左侧侧脑室内,形状不规则,混杂信号病灶,呈囊实性,与透明隔相邻,经室间孔长向对侧脑室,合并脑积水,可见血管流空影,增强像不均匀强化。术后MRI:肿瘤已全切,病理诊断为中枢神经细胞瘤。 |
本组所有患者施行开颅显微手术治疗,手术入路的选择依据肿瘤的部位、大小。采用经皮层造瘘经侧脑室入路13例,采用经纵裂经胼胝体入路8例;21例中有5例运用Brainlab神经导航结合术中使用管状脑牵开器(VBAS)的手术方式。具体方式为:术前行MRI检查时常规予DTI、fMRI检查,并运用Brainlab导航系统(Cranial view 3.0)制定术前导航计划,根据术前导航计划运用导航棒定位病灶,在头皮上对应位置标记出肿瘤的体表投影,围绕定位后的肿瘤体表投影设计手术切口。骨窗形成后,剪开硬脑膜,再次导航定位病灶,皮层切口选择以既可以避开视辐射,又可最短距离到达病灶为宜。术中皮层切开后均采用管状脑牵开器(VBAS,ViewSite,Vycor Medical公司)牵开皮质以暴露术野。次全切除患者术后辅以放疗。
1.5 病理检查21例患者每例组织标本均先由10%甲醛固定,然后常规石蜡包埋,最后作连续切片,切片厚度规定为5 um,常规HE染色及免疫组化染色检查。
1.6 随访随访主要采用电话与门诊方式。具体随访内容包括:患者术后的症状、体征(主要为视力视野)、影像学检查结果(主要为颅脑MRI检查)、生活质量以及生活自理能力等。生存质量评分采用KPS评分(Karnofsky Performance Status)进行评定,将生存质量分为优秀(KPS评分>80),一般(KPS评分60~80),差(KPS评分<60)三组。随访截止至2014年12月。
2 结果 2.1 术后病理肿瘤大体标本呈灰白色,部分钙化。镜下:可见肿瘤细胞呈圆形,胞质透明,通常罕见或缺乏有丝分裂和坏死。免疫组化提示多种神经元标记蛋白呈阳性,Syn染色与神经原生质有关,在中枢神经细胞瘤中常呈阳性(见图 2-1)。本组术后病理结果20例Syn(+),13例NSE(+),1例Oligo-2(+),6例GFAP(+),4例Neu-N (+),1例CgA (+),1例NF (+),1例S-100 (+),1例CD56 (+)。
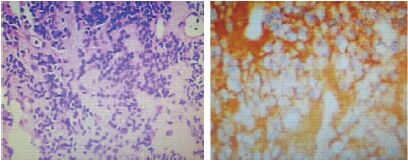
|
| 图 2-1 中枢神经细胞瘤组织学切片(HE染色)肿瘤组织由形态单一,分布密集的小圆细胞组成,可见无细胞性神经原纤维岛区。 免疫组化:组织切片可见Syn阳性,黄色荧光主要胞质,以神经原纤维岛区为甚。 |
本组病例中,2例术后并发硬膜外血肿,均行二次手术清除血肿;1例出现较重的脑水肿;皮下积液、对侧同向性偏盲各1例;脑积水1例;肺部感染1例(见表 2-1)。5例运用Brainlab神经导航结合术中使用管状脑牵开器(VBAS)的患者术后均未出现上述并发症。
本组21例术后复查MRI示肿瘤17例全切除,4例次全切除,其中5例运用Brainlab神经导航结合术中使用管状脑牵开器(VBAS)技术的患者均全切肿瘤。全切除者恢复良好,仅有1例出现肿瘤复发,经伽玛刀治疗后,肿瘤控制较好;次全切除的4例患者术后辅助放疗,复查2例肿瘤消失,2例残余肿瘤缩小。截止随访时间2014年12月25日。随访21例患者,随访时间最短6月,最长50月,平均22月。截止此次随访结束,未发现死亡病例,随访病人总体生存率(OS)为100%。根据Karnofsky表现评分标准(KPS 评分表),对患者术前、末次随访时的生活质量进行评分,其中17例KPS>80分,3例60~80分,1例<60分。5例运用Brainlab神经导航结合术中使用管状脑牵开器(VBAS)的患者术后KPS评分均>80分,预后良好。
3 讨论 3.1 流行病学特征多数文献认为CNC的好发年龄为20~40岁的青年,男女比例为1.02[DK(]∶[DK)]1,无性别差异[5, 6]。2009年10月至2014年5月我科共收治21例CNC患者,占同期收治的颅内肿瘤的0.23%,男性11例,女性10例,男女比例为1.1[DK(]∶[DK)]1,年龄16~52岁,平均32岁,与文献报道基本相符。本组资料表明该病为罕见疾病,常见于青年,无性别差异。
3.2 临床表现脑室内中枢神经细胞瘤的主要发生部位在透明隔近室间孔处(Monro孔),早期多无明显症状及体征,大多数病人肿瘤已有明显占位效应时才引起临床症状。头痛、呕吐、视乳头水肿、视力下降等症状为常见症状[7],其他少见的临床表现有复视、肌体乏力、轻偏瘫等,当肿瘤累及额叶时可进一步导致反应迟钝、记忆力减退和视觉障碍等症状[8]。因上述症状常无特异性,故本病易被误诊为脑室内的其它肿瘤。本组病例与文献报道相符。
3.3 影像学分析中枢神经细胞瘤起源于室间孔区域,CT表现为等或稍高密度的肿块影,密度不均匀,常见钙化。MRI表现为双侧脑室不对称扩张,T1和T2像通常呈与皮质信号强度相等或稍强,囊性变和钙化常见,并可见肿瘤血管流空影;增强后呈中等程度的强化。有文献认为血管流空影是脑室内中枢神经细胞瘤的一个较显著的特点[15]。Keerkovsky等[16, 17]认为CNC的出血与血管流空影具有特征性。Jaiswal等[18]报道13例CNC中,85%病例可见囊变,62%可见流空血管,69%可见钙化;本组中发现囊变15例(占71.4%);钙化12例(占57.1%);流空血管影11例(占52.3%),与文献报道相接近。由于其他的颅内肿瘤也常出现上述影像表现,因此我们认为中枢神经细胞瘤在影像学上缺乏特异性征象,钙化、囊变、瘤内出血、血管流空影等只是其影像学的常见表现,需要结合临床与病理进行正确的诊断。
3.4 病理分析应用免疫组化检测有助于中枢神经细胞瘤的确诊,Chen等[19]认为Syn、NSE在CNC的瘤细胞胞质及无核纤维岛区域均呈强阳性表达,尤其是Syn,GFAP反应性胶质细胞呈弱阳性表达。本组病例术后病理结果20例Syn(+),13例NSE(+),1例Oligo-2(+),6例GFAP(+),4例Neu-N (+),1例CgA (+),1例NF (+),1例S-100 (+),1例CD56 (+),对结果分析发现Syn、NSE阳性率高,而GFAP、Neu-N、CgA、NF、S-100、CD56阳性率低,表达与报道一致。我们认为免疫组化对明确诊断至关重要,中枢神经细胞瘤的特征性指标是Syn和NSE阳性。
3.5 手术治疗显微手术对于大多数脑室内中枢神经细胞瘤的患者,仍是最佳的治疗手段。手术治疗的首要目标是重建脑脊液通路,同时保证肿瘤安全切缘的最大化,为病理诊断提供组织。多数临床患者虽然合并阻塞性脑积水,并出现颅内高压的症状和体征,但极少数有必要进行术前分流[20]。本组患者术前均未行分流手术,手术全切除者恢复良好,仅有1例出现肿瘤复发,患者生活质量评分KPS>80分者17例,表明手术全切肿瘤效果好;4例次全切除患者术后予以放疗,随访结果示2例肿瘤影像学消失,2例残余肿瘤缩小,表明次全切除结合术后放疗的临床效果值得肯定。正如Tew等人[20]的研究指出,最优化的入路是通过垂直的术野到达病灶的最短距离,同时要求对脑组织最小的牵拉和避免穿过重要的结构。结合进一步的研究,我们认为:①我科自2013年开始运用Brainlab神经导航通过融合DTI(磁共振弥散张量成像),结合术中使用管状脑牵开器(VBAS)的手术方式,取得良好效果。本组有5例患者使用该手术方式,肿瘤均实现术中全切,术后未出现严重并发症,随访结果良好。结合目前我科对侧脑室脑膜瘤应用该手术方式的研究表明,有助于判断肿瘤和周围重要结构的位置关系,提高肿瘤的切除程度,有效减少手术创伤与围手术期并发症,改善患者术后生活质量。②侧脑室体部、第三脑室的CNC选用经纵裂经胼胝体入路,而经皮质造瘘经侧脑室入路适用于当肿瘤起源于一侧,尤其是位于侧脑室前部、体积巨大且伴有该侧脑室明显扩张时;③中枢神经细胞瘤生长位置常与丘脑、下丘脑、透明隔静脉及丘纹静脉等重要结构紧邻,常有粘连,术中为避免损伤这些重要结构,多采用显微镜下分块切除或分离肿瘤边界前,应用CUSA行囊内减压,再完整切除肿瘤。④术区需要反复冲洗,彻底止血,脑室内止血时,减少术中止血材料的放置,同时在脑室内留置引流管,进一步预防术后脑积水。
3.6 对术后放疗的评价与预后中枢神经细胞瘤生物学行为上属于良性肿瘤,Sharma等人[9, 10, 11, 12, 13, 22]的研究表明,MIB-1标记指数在具有坏死和异常核分裂的中枢神经细胞瘤中较高,中枢神经细胞瘤预后与MIB-1标记指数相关。CNC对放疗高度敏感,是术后有效的辅助治疗方法。多数文献认为MIB-LI>2%的患者术后应辅助行放射治疗[14, 22]。本组病例中,次全切除的4例患者术后辅助放疗,复查2例肿瘤消失,2例残余肿瘤缩小,显示了放射治疗的良好疗效。
4 结论我们认为:①CNC的临床表现和影像学缺乏特异性,确诊需依靠病理检查。②该病首选治疗方式为显微手术切除,手术的目标是最大限度的安全切除肿瘤,全切患者预后良好,次全切除患者术后应行辅助放疗;③ Brainlab神经导航结合术中使用管状脑牵开器(VBAS)的手术方式有助于判断肿瘤和周围重要结构的位置关系,提高肿瘤的切除程度,进而有效减少手术创伤与围手术期并发症,改善患者术后生活质量,具有广泛的应用空间。
| [1] | Hassoun J, Gambarelli D, Grisoli F, et al.Central neurocytoma.Anelectron-microscopic study of two cases.Acta Neuropathol, 1982, 56(2):151-156. |
| [2] | 张亚卓.脑室外科学.北京:人民卫生出版社, 2011:93-94. |
| [3] | Kim JW, Kim DG, Kim IK, et al.Central neurocytoma:long-term outcomes of multimodal treatments and management strategies based on 30 years' experience in a single institute.Neurosurgery, 2013, 72(3):407-414. |
| [4] | Vasiljevic A, François P, Loundou A, et al.Prognostic factors in central neurocytomas:a multicenter study of 71 cases.The American journal of surgical pathology, 2012, 36(2):220-227. |
| [5] | 王尔松, 高翔等.中枢神经细胞瘤的临床特征.中华神经外科杂志, 2008, 24(7):496-498. |
| [6] | Kim DG, Chi JG, Park SH, et al.Intraventricularneurocytoma:clinicopathological analysis of seven cases.J Neurosurg, 1992, 76(5):759-765. |
| [7] | Chen, M.C., Pan DH, Chung WY, et al.Gamma kniferadiosurgery for central neurocytoma:retrospective analysis of fourteen cases with a median follow-up period of sixty-five months. StereotactFunctNeurosurg, 2011, 89(3): 185-193. |
| [8] | Schmidt M.H., Gottfried ON, YonKoch CS, et al.Central neurocytoma:a review.J Neurooncol, 2004, 66(3):377-384. |
| [9] | Muzumdar D, Avinash K M, Ramdasi R.Cavernoma of the septum pellucidum in the region of foramen of Monro. Neurology India, 2015, (1):63-68. |
| [10] | Shin H Y, Kim J W, Paek S H, et al.The Characteristics of Neuronal Stem Cells of Central Neurocytoma.Neurosurgery clin of N Am, 2015, 26(1):31-36. |
| [11] | Peng P, Chen F, Zhou D, et al.Neurocytoma of the pituitary gland:A case report and literature review.Biomedical Reports, 2015, 3(3):301-303. |
| [12] | YangG.F., Wu SY, Zhang LJ, et al.Imaging findings of extraventricularneurocytoma:report of 3 cases and review of the literature. Am J Neuroradiol, 2009, 30(3): 581-585. |
| [13] | Xiong Z, Zhang J, Zhang T, et al.Treatment strategies for huge central neurocytomas.Journal of Huazhong University of Science and Technology [Medical Sciences], 2015, 35:105-110. |
| [14] | Ramsahye H, He H, Feng X, et al.Central neurocytoma:radiological and clinico-pathological findings in 18 patients and one additional MRS case.Journal of Neuroradiology, 2013, 40(2):101-111. |
| [15] | Zhang B, Luo B, Zhang B, et al.Central nurocytoma:a clinicopathological and neuroradiologial study.Neuroradiological, 2004, 46(11):888-895. |
| [16] | Kerkovsky M, Zitterbart K, Svobod A, et al.Central neurocytoma:the neuroradiological perspective.Childs NervSyst, 2008, 24(11):1361-1369. |
| [17] | Takahashi H, Hattori S, Iwamatsu A, et al.A novel snake venom vascular endothelial growth factor (VEGF) predominantly induces vascular permeability through preferential signaling via VEGF receptor-1.J BiolChem, 2004, 279 (44):46304-46314. |
| [18] | Jaiswal S, Vij M, Rajput D, et al.A clinicopathologicalimmunohistochemical and neuroradiological study of eight patients with central neurocytoma.J Clin Neurosci. 2011, 18(3):334-339. |
| [19] | Chen CL1, Shen CC, Wang J, et al.Central neurocytoma:A clinical radiological and pathological study of nine cases.Clinical Neurology and Neurosurgery, 2008, 110(2):129-136. |
| [20] | Tew JM Jr, lewis AI, Reichert KW.Management strategies and surgical techniques for deep-seated supratentorialarteriovenous malformations .Neurosurgery, 1995, 36(6):1065-1072. |
| [21] | Kar A, Poddar S, Das U, et al.Atypical central neurocytoma with biventricular involvement:a rare case report.International Journal of Biopharmaceutics, 2015, 6(1):1-4. |
| [22] | Kawakami F, Nambu J, Hirose T, et al.Central neurocytoma with ependymoma-like glial component.Brain tumor pathol, 2014, 32(2):119-123. |
 2015, Vol. 42
2015, Vol. 42

