扩展功能
文章信息
- 白杨, 雷晶, 马建华, 张小宁
- BAI Yang, LEI Jing, MA Jian-Hua, ANG Xiao-Ning
- 新疆地区脊髓小脑共济失调2型患者临床表型相关分析
- Analysis of clinical phenotypes in patients with spinocerebellar ataxia type 2 in Xinjiang, China
- 国际神经病学神经外科学杂志, 2015, 42(2): 105-108
- Disease Surveillance, 2015, 42(2): 105-108
-
文章历史
- 收稿日期:2015-01-14
- 修回日期:2015-03-24
遗传性共济失调(hereditary ataxia,HA)是神经系统遗传病,常染色体显性遗传为HA主要的遗传方式。HA中较为常见类型是遗传性小脑性共济失调(hereditary cerebellar ataxias,HCA)及遗传性痉挛性截瘫。HCA分为显性遗传及隐[JP2]性遗传。以往的研究将常染色体显性遗传性小脑共济失调分为I、II、II型(autosomal dominant cerebellar ataxia types I、II、III,ADCA I、ADCA II、ADCA III)[1, 2]。ADCAI型包括脊髓小脑共济失调(spinocerebellar ataxia,SCA)1-4、SCA8、SCA10、SCA12-23、SCA25、SCA27、SCA28和DRPLA,症状除共济失调外,还伴其他神经系统症状(如眼肌麻痹,认知功能障碍,锥体及锥体外系特征,延髓、脊髓及外周神经受累)。对16个国家HCA和遗传性痉挛性截瘫患者共14539例行系统回顾和荟萃分析显示[3],显性HCA的发病率是0.0~5.6/10万,脊髓小脑性共济失调3型(spinocerebellar ataxia type 3,SCA3)是最常见的显性HCA,其次是SCA2和SCA6。 1 资料与方法 1.1 一般资料
收集2010年至2013年就诊我院,根据Harding诊断标准考虑为SCAs的患者的外周血样3 ml。并进行神经系统查体,国际协作共济失调等级评分量表(International Cooperative Ataxia Rating Scale,ICARS)在不同神经内科医生评定过程中显示了其可靠性及有效性[4],评分值越大,临床症状越严重,故研究中以ICARS评分来评估患者临床症状的严重程度。ICARS评分分级:轻度共济失调:0~20分;中度共济失调:20~50分;重度共济失调:50~70分;特重度(生活完全不能自理):>70分。简易智力状态量表(mini-mental stale examination,MMSE)进行认知功能的初步评估。MMSE评分评定认知功能障碍:文盲≤17分、小学水平≤20、中学及以上文化程度≤24分为认知功能障碍。 1.2 研究方法
用酚氯仿法提取基因组DNA作为PCR模版。引物序列(上海生工合成):SCA2-U:5’-GCGTGCGAGCCGGTG TAT-3’; SCA2-D:5’-GGACGAGGACGGCGA AGG-3’[3]。PCR反应体系:扩增SCA2基因:反应总体积20 μl,DNA模版2 μl,引物各12 pmol,GC Buffer I 10 μl,dNTP终浓度200 μmol/L,TAq酶1 U(天根)。反应条件:选用TOUCH DOWN反应程序,94℃预变性3 min,94℃变性30 s,71℃退火45 s,72℃延伸45 s,退火温度以0.5℃为一个单位逐个循环下降,共14个循环;94℃变性30 s,64℃退火45 s,72℃延伸45 s,25个循环,最后延伸7 min。PCR产物电泳初步判断基因型。对62号异常等位基因PCR产物纯化回收、克隆,送北京博迈德公司测序。 2 结果 2.1 基因检测结果
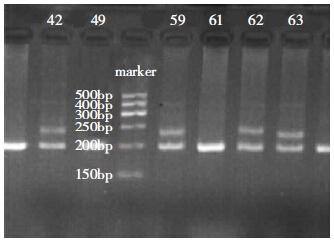
发现了9例SCA2型患者,PCR均可扩增出2条特异性条带,一条在200 bp处,另一条在250 bp处,均为杂合子。其中6人有家族史,3人否认家族史(图 1),在患者家系中未发现症状前患者。其余标本PCR结果均为1条在200 bp处单一特异性扩增条带,均为纯合子。对其中1位SCA2型患者(编号62)测序结果显示,CAG重复次数为47次,有CCG插入现象(图 2)。
|
| 图 1 SCA2基因PCR产物电泳图。marker:50 bp Ladder DNA。编号42、59、62、63有异常扩增条带,在接近250 bp处。 |

|
| 图 2 62号患者SCA2异常等位基因测序图。异常基因从第96位起至第240位,CAG重复次数为47次,233位后有CCG插入。 |
此次发现的9例SCA2患者发病年龄在12~48岁,平均发病年龄(33.3±13.4)岁。6名患者有家族史,3名患者否认家族史。有家族史的患者编号为:60、62、C01、C03、118、123。 62号患者于12岁发病,病程6年;其父亲22岁发病,41岁去世,病程19年,去世前长期卧床,有呛咳、营养差、消瘦、便血。
C01为C03母亲。C01患者48岁发病,其儿子C03患者27岁发病。
118号患者于39岁发病,病程3年;其母亲40岁发病,61岁去世,病程21年;二哥13岁发病,不能行动、卧床10年,去世前频繁呛咳明显,于37岁去世,病程24年。
123号患者于48岁发病,病程10年;其外公52岁发病,71岁去世,病程19年,去世前长期卧床;母亲49发病,66岁去世,病程17年,去世前长期卧床,极其消瘦;其哥哥35岁发病,病程15年。
观察先证者所在家系各代患病成员的发病年龄,发现每一代发病年龄较上一代提前,符合遗传早现现象。
一名散发患者未参与系统评估,患者为男性,43岁,发病年龄33岁,病程10年。
未参与系统评估的患者神经系统查体可见四肢腱反射减弱。余8名患者主要临床特点表现(见表 1),ICARS、MMSE量表评分(见表 2)。轻度共济失调3例,中度共济失调4例,重度共济失调1例。62号患者学历为初中,C01号患者学历为小学,根据上述评定标准提示62号患者及C01患者存在认知功能障碍。对认知功能障碍的患者行蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评分:C01患者MoCA量表评分:11分,其中视空间与执行功能0分,命名3分,注意3分,语言1分,抽象1分,延迟回忆0分,定向3分。62号患者MoCA量表评分:19分,其中视空间与执行功能3分,命名2分,注意3分,语言1分,抽象0分,延迟回忆4分,定向6分。62号患者帕金森综合评分量表 12分,其中精神、行为和情绪2分,日常活动2分,运动功能8分,治疗时的并发症0分。
| 编号 | 42 | 60 | 62 | 63 | C01 | C03 | 118 | 123 |
| 性别 | 男 | 男 | 女 | 女 | 女 | 男 | 男 | 男 |
| 发病年龄(年) | 21 | 27 | 12 | 44 | 48 | 27 | 39 | 48 |
| 病程(年) | 3 | 2 | 6 | 4 | 10 | 8 | 2 | 10 |
| 步态失调(年) | 3 | 2 | 2 | 4 | 10 | 8 | 2 | 10 |
| 站立不稳(年) | 0 | 0.5 | 0 | 4 | 5 | 0 | 1 | 0 |
| 言语障碍(年) | 2 | 2 | 0 | 0 | 3 | 1 | 1 | 0 |
| 声音嘶哑(年) | 0.5 | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| 腱反射 | + | + | + | +/- | +++ | ++ | + | + |
| 肢体震颤(年) | 1 | 0 | 6 | 0 | 3 | 1 | 0.5 | 0 |
| 病理征 | - | - | - | - | + | + | - | - |
| 自主神经功能紊乱 | 无 | 无 | 无 | 有 | 有 | 无 | 无 | 无 |
| 慢眼扫视 | 无 | 无 | 无 | 无 | 有 | 有 | 无 | 无 |
| 下肢痛性痉挛(年) | 0.5 | 0.5 | - | - | 2 | 3 | 0 | 0 |
| 编号 | 42 | 60 | 62 | 63 | C01 | C03 | 118 | 123 |
| 性别 | 男 | 男 | 女 | 女 | 女 | 男 | 男 | 男 |
| 病程(年) | 3 | 2 | 6 | 4 | 10 | 8 | 2 | 10 |
| 肢体震颤(年) | 1 | 0 | 6 | 0 | 3 | 1 | 0.5 | 0 |
| ICARS(分) | 26 | 15 | 10 | 20 | 59 | 23 | 21 | 28 |
| MMSE(分) | 30 | 30 | 19 | 28 | 15 | 26 | 27 | 26 |
SCA2的致病基因定位于染色体12q23-24.1[5]。该基因编码ataxin 2蛋白质。突变SCA基因的三核苷酸(CAG)重复扩增,CAG编码谷氨酰胺,致使突变ataxin蛋白中存在扩增的多聚谷氨酰胺(PolyQ)。在PolyQ疾病中,突变蛋白最终形成细胞核内包涵体,产生细胞的毒性,致使神经系统退行性改变。研究显示SCA2基因产物ataxin-2主要位于细胞质高尔基体。通过影响细胞质高尔基体功能导致细胞死亡[6]。中国人群SCA2基因CAG重复次数相关研究显示正常SCA2等位基因CAG重复数为13~30次,突变的SCA2基因CAG重复数为36~41次[7]。
本实验发现的SCA2患者的临床表现主要为步态失调、腱反射减弱和言语障碍,另外有肢体震颤、下肢痛性痉挛和认知功能障碍,这与其他研究相同[8, 9]。SCA2以下橄榄核、脑桥、小脑受损为主。可解释患者出现相应临床表现。SCA2型患者腱反射一般减弱[10],很少出现累及锥体束而出现锥体束征。但本实验中C01、C03患者临床表现以锥体束受损为主,出现腱反射活跃,病理征阳性,提示出现锥体束损伤。说明SCA2损伤也可累及锥体束,体现了SCA2患者临床表现的异质性。
62号患者的测序结果显示CAG重复序列为47次,为异常重复次数。有研究表明,在CAG重复序列中存在CAA片段插入,这种患者也会发病,但是这种患者的发病年龄晚而临床症状轻,可能因为CAA也编码产生谷氨酰胺,所以插入CAA的CAG重复序列仍然有致病性,但CAA的插入影响致病基因的发卡结构,使其翻译减少,所以致病性减弱[11, 12]。该患者CAG重复序列中有CCG插入,通过比较ICARS评分,可见该患者共济失调临床症状最轻,考虑为CCG插入重复序列至毒性蛋白翻译减少所致。但患者发病年龄早,该患者12岁时以肢体不自主抖动、静止性震颤起病,出现步态失调2年,而其余4名患者以步态失调起病,病程在2~4年,ICARS评分在15~26分,虽然病程短,但是临床症状明显重于62号患者。有学者总结SCA2所致的帕金森病(临床症状仅表现为帕金森症状)的特点为发病年龄较晚,运动迟缓、肌肉僵直,症状进展缓慢;左旋多巴治疗有效;发病率可能与种族有关[13]。可能是因为62号患者症状以帕金森综合征为主,而此类病人病程进展较慢。在对患者临床预后的判断时,不仅需要结合基因检测的结果,同时需要兼顾发病时的临床表现,比如以帕金森综合征表现为主的SCA2型患者疾病进展较以共济失调表现为主的患者发展缓慢。
在各型合并帕金森综合征的SCAs中,SCA2最常见到合并帕金森综合征的病例[14],甚至有临床表现仅为帕金森症状的患者[15]。通过MRI、PET、SPECT等影像学检查可发现SCA2型患者黑质纹状体容易受到累及。1名伴有帕金森综合征的SCA2患者尸检报告提示脑干有路易小体形成及沉积,从病理角度解释了SCA2型患者出现帕金森综合征的原因[16]。本实验在8例患者中有5例出现帕金森症状,出现帕金森症状的患者占多数。而Lu等[17]学者的研究发现来自SCA2型家族的患者占帕金森患者的7.69%,他们发现SCA2型患者帕金森综合征左旋多巴治疗有效,且临床症状不易与帕金森病相鉴别。故对SCA2型的明确诊断还是依赖于基因诊断。即使像SCA7这样具有鲜明临床特点的亚型,也需要与累及视神经的其他共济失调相鉴别,可见分子遗传学的检测是非常必要的[18]。
SCA为常染色体显性遗传病,在SCA家系中产前诊断是非常有必要的,可有助于优生优育,减轻家庭负担,提高生活质量。
| [1] | Harding AE. Clinical features and classification of inherited ataxias. Adv Neurol, 1993, 61: 1-14. |
| [2] | Fujioka S, Sundal C, Wszolek ZK. Autosomal dominant cerebellar ataxia type Ⅲ: a review of the phenotypic and genotypic characteristics. Orphanet J Rare Dis, 2013, 8: 14. |
| [3] | 张小宁, 雷晶, 马建华.脊髓小脑共济失调2型、3型患者10例基因突变与临床表型分析.中华神经科杂志, 2007, 40(4): 260-263. |
| [4] | Storey E, Tuck K, Hester R, et al. Inter-rater reliability of the International Cooperative Ataxia Rating Scale (ICARS). Mov Disord, 2004, 19(2): 190-192. |
| [5] | Gispert S, Twells R, Orozco G, et al. Chromosomal assignment of the second locus for autosomal dominant cerebellar ataxia (SCA2) to chromosome 12q23-24.1. Nat Genet, 1993, 4(3): 295-299. |
| [6] | Huynh DP, Yang HT, Vakharia H, et al. Expansion of the polyQ repeat in ataxin-2 alters its Golgi localization, disrupts the Golgi complex and causes cell death. Hum Mol Genet, 2003, 12(13): 1485-1496. |
| [7] | 陈朴, 马明义, 商慧芳, 等.常染色体显性小脑性共济失调致病基因动态突变位点三核苷酸重复变异的研究.中华医学遗传学杂志, 2009, 26(6): 626-633. |
| [8] | Jhunjhunwala K, Netravathi M, Purushottam M, et al .Profile of extrapyramidal manifestations in 85 patients with spinocerebellar ataxia type 1, 2 and 3. J Clin Neurosci, 2014, 21(6): 1002-1006. |
| [9] | Velázquez-Pérez L, Rodríguez-Labrada R, Cruz-Rivas EM, et al. Comprehensive study of early features in spinocerebellar ataxia 2: delineating the prodromal stage of the disease. Cerebellum, 2014, 13(5): 568-579. |
| [10] | Boonkongchuen P, Pongpakdee S, Jindahra P, et al. Clinical analysis of adult-onset spinocerebellar ataxias in Thailand. BMC Neurol, 2014, 14: 75. |
| [11] | Sobczak K, Krzyzosiak WJ. CAG repeats containing CAA interruptions form branched hairpin structures in spinocerebellar ataxia type 2 transcripts. J Biol Chem, 2005, 280(5): 3898-3910. |
| [12] | Rozanska M, Sobczak K, Jasinska A, et al. CAG and CTG repeat polymorphism in exons of human genes shows distinct features at the expandable loci. Hum Mutat, 2007, 28(5): 451-458. |
| [13] | Sun H, Satake W, Zhang C, et al. Genetic and clinical analysis in a Chinese parkinsonism-predominant spinocerebellar ataxia type 2 family. J Hum Genet, 2011, 56(4): 330-334. |
| [14] | Wang C, Xu Y, Feng X, et al. Linkage analysis and whole-exome sequencing exclude extra mutations responsible for the parkinsonian phenotype of spinocerebellar ataxia-2. Neurobiol Aging, 2015, 36(1): 545; e1-e7. |
| [15] | Charles P, Camuzat A, Benammar N, et al. Are interrupted SCA2 CAG repeat expansions responsible for parkinsonism? Neurology, 2007, 69(21): 1970-1975. |
| [16] | Takao M, Aoyama M, Ishikawa K, et al. Spinocerebellar ataxia type 2 is associated with Parkinsonism and Lewy body pathology. BMJ Case Rep, 2011, 2011. pii:bcr0120113685. |
| [17] | Lu CS, Wu Chou YH, Yen TC, et al. Dopa-responsive parkinsonism phenotype of spinocerebellar ataxia type 2. Mov Disord, 2002, 17(5): 1046-1051. |
| [18] | 江泓, 唐北沙, 李清华, 等.遗传性脊髓小脑型共济失调7型一家系的临床及基因突变分析.国际神经病学神经外科学杂志, 2005, 32(6): 495-497. |
 2015, Vol. 42
2015, Vol. 42


