扩展功能
文章信息
- 黄冠又, 曹楚南, 甘鸿川
- 颅底骨髓炎的研究进展
- 国际神经病学神经外科学杂志, 2015, 42(1): 66-69
- Disease Surveillance, 2015, 42(1): 66-69
-
文章历史
- 收稿日期:2014-10-03
- 修回日期:2014-01-28
颅骨骨髓炎是由需氧或厌氧菌,分岐杆菌或真菌引起的颅骨感染和破坏的疾病,以颅盖的额、顶骨最多见。颅底骨髓炎(Skull base osteomyelitis,SBO)较为少见,典型的SBO好发于老年糖尿病患者或有免疫功能低下的病人,多累及颞骨、颅底、脑神经和脑组织,临床表现多不典型,病情加重可威胁人类的生命[1]。现就该病的病因、发病过程、临床表现、影像学检查、诊断及治疗等综述如下。 1 病因及发病过程
SBO病因尚不完全清楚,但机体免疫力低下的患者、老年人、恶性肿瘤患者,糖尿病及营养不良的病人容易发生SBO[1]。SBO常继发于伴有侵袭性骨质破坏的恶性外耳道炎(MOE)[2],MOE病变起始于外耳道,外耳道底部可见肉芽组织和软骨发生坏死,坏死通常发生在外耳道软骨和软组织交界处,由此向周围扩散[3]。当病情进一步发展,急性或慢性炎症通过外耳道软骨裂隙和中耳鼓乳裂侵及茎乳孔和颈静脉孔,导致颞骨或颅底骨髓炎,引起多组颅神经功能麻痹,脑膜炎或脑脓肿等。慢性乳突炎、鼻窦炎也是SBO的诱发因素[4]。另外,医源性因素也可引起SBO,如上颌骨切除术、乳突切除术等[5]。SBO的主要致病菌是铜绿假单胞菌,其分泌的内外毒素可破坏周围组织,因其毒力强使感染不易控制,可造成严重致死性感染。其他致病菌还有表皮葡萄球菌、肺炎链球菌、曲霉菌等。Lee等[5]报道在乙状窦血栓形成和坏死性肺栓塞病例中产气肠杆菌感染致SBO的病例。 2 临床表现
典型的SBO通常和MOE具有类似的临床表现:患者起病较急,以耳痛为主要症状,逐渐加剧,常放射到额部,夜间疼痛加剧,一般局部治疗常无明确疗效。持续性外耳道流脓也较常见,但是鼓膜和听力可保持完好[1]。外耳道可见肿胀,微小脓肿形成,外耳道下壁骨与软骨交界处皮肤软组织肉芽增生。当病变累及颅神经,可引起多发性神经功能障碍,较少累及视神经,面神经受累多见,出现面瘫,若累及岩骨尖,则视神经、三叉神经、外展神经受损[6]。病变侵及颈静脉孔者,可使舌咽神经、迷走神经、副神经受损引起Vernet综合症[1]。累及枕骨髁、C1侧块、齿状突、舌下神经管等可引起Collect-Sicard综合征[7],导致后组颅神经(IX、X、XI、XII)麻痹,严重时可合并上颈椎骨髓炎和慢性脊髓型颈椎病[8]。出现相关颅神经症状提示预后较差。当SBO进一步侵及颅内脑组织,可引起脑膜炎、脑脓肿、海绵窦血栓形成甚至死亡[9]。非典型性SBO主要以头痛、颞下颌关节痛、颅神经受损为临床表现,较少表现为恶性外耳道炎,隐蔽性乳突炎可能是其发生诱因[5]。Singh等[10]报道3例非典型性SBO,1例表现为病变侵及对侧眶尖视神经导致失明,1例病变侵及第4颈椎,1例患者未表现颅神经麻痹症状,这3例患者均无恶性外耳道炎临床表现。 3 影像学检查
影像学检查对于SBO的诊断具有重要作用,CT可用于评估颞骨外软组织受累范围和颅底骨髓炎的严重程度,颞骨常常是SBO最先受累的骨质,受累的颞骨可出现膨出。CT扫描能够显示外耳道内和中耳软组织密度影填充,骨性外耳道壁骨质破坏,病变发展中可有颞骨、中耳乳突、枕骨斜坡和颈动脉管受侵蚀或破坏(图 1,Singh 等,2005),并且发现病变前期软组织炎症前骨中的矿物质至少缺失30%,在一些SBO中,甚至可以发现面神经入茎乳孔的颞下三角处脂肪层缺失[2]。值得注意的是,有时CT扫描也不能完全显示SBO中颅底骨质侵蚀或破坏的表现,无法鉴别MOE和恶性肿瘤[9]。当感染控制后,骨的影像学表现也将很长时间存在,不能显示受累骨质再矿化表现。在SBO诊断过程中,MRI在对软组织的显像检查中要优于CT,能够显示位于颅底、颞下窝、鼻咽腔、咽旁间隙等处的软组织病变[4],典型的SBO在MRI表现上一般为T1加权低信号,T2加权高信号(图 2,Yum等,2011),但在显示颞下间隙纤维化、坏死病变过程中T2加权像可以为低信号,病变侵及中耳乳突和中央颅底时为高信号[2]。放射性核素影像检查在诊断SBO中也起着重要作用。99m锝显像和镓-67显像较常用于诊断SBO[1]。99m锝-亚甲基二磷酸盐(MDP)可被成骨细胞吸收,该技术对感染非常敏感,其骨扫描可用于显示颅底骨髓炎病理过程,有助于对SBO早期局部诊断,然而其缺乏特异性,仅以放射性核素累积阳性或阴性,当骨髓炎治愈后,99m-锝显像仍可为阳性,对于判断SBO治疗效果并不明确[2]。 镓-67能与白细胞内的乳铁蛋白结合并随白细胞迁移到炎症部位,浓聚于病灶处,使病灶部位形成异常放射性显像,对于SBO的早期诊断较99m-锝更具特异性,能较好判断软组织和颅骨感染[1],不同于99m-锝,当感染趋于好转或终止时,镓-67的吸收亦能恢复正常,有助于评价抗生素的疗效和决定终止抗生素的治疗时间,以及对治疗后病人的随访[2, 6, 11]。
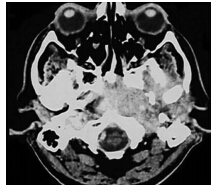 |
| 图 1 CT扫描示左侧岩尖及斜坡斑片状炎性病变,颅底骨质破坏,并侵犯鼻咽区 |
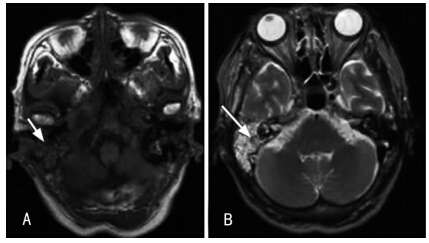 |
| 图 2 A:T1加权像显示右侧斜坡及颞骨乳突低信号;B:T2加权像显示右侧斜坡及颞骨乳突高信号 |
根据前述SBO临床表现的准确把握是诊断的第一步,但有时颅底骨髓炎的临床表现不具有特异性,可能表现为非特异性的SBO,初始症状可能仅有头痛和颅神经麻痹,而不伴有恶性外耳道炎表现[5],此时病变的影像学检查和病理检查显得尤为重要。在诊断过程中可参考Levenson诊断标准:发生于免疫力低下或高龄糖尿病患者中,临床表现有:难治性外耳道炎,外耳道进行性疼痛特别是夜间痛,外耳道底部肉芽组织、外耳溢脓、绿脓杆菌感染或伴有面神经麻痹、吞咽困难及声音嘶哑者应高度怀疑该病[12]。另外,在SBO中血沉往往增高,而且血沉也是治疗是否有效的预测指标[2, 10, 13],结合影像学表现和细菌培养结果可有助于SBO的诊断。与颅底骨髓炎相鉴别的主要疾病有鼻咽癌、外耳鳞状细胞癌、转移癌、多发骨髓瘤、Wegener肉芽肿、结节病及斜坡脊索瘤等[1, 10, 14]。 5 治疗 5.1 全身治疗
颅底骨髓炎的早期诊断及早期治疗很重要,对于老年糖尿病及免疫力低下的患者应注意控制血糖、改善机体免疫功能,进行全身治疗并辅以局部清洁治疗。 5.2 抗生素治疗
抗生素的治疗在治疗颅底骨髓炎上起着重要作用。SBO的常见致病菌主要是铜绿假单胞菌、金黄色葡萄球菌、肺炎链球菌等,自20世纪70年代以来,通常采用氨基糖苷类抗生素与抗铜绿假单胞菌的β-内酰胺药联合应用[15]。在抗绿脓杆菌治疗上,许多学者主张多种抗生素的联合应用治疗感染较重的患者,其疗效要好于一种抗生素治疗,可能是单种抗生素治疗容易产生耐药性,无法彻底治愈残余致病菌。在使用氨基糖苷类抗生素(庆大霉素、妥布霉素)时,应考虑该抗生素的肾毒性和耳毒性,尤其对于高龄糖尿病、肾功能不全及机体免疫力低下的患者,应密切监测患者血清中的肌酐水平[16]。也可采用氨基糖苷类抗生素与半合成青霉素联合治疗,较早期的文献报道采用半合成青霉素(如羧卞青霉素)和氨基糖苷类药物联合治疗6~8周就能控制整个病程,并且延长半合成青霉素的疗程也不会产生严重的副作用[17, 18]。
第三代头孢菌素头孢他啶在治疗SBO具有较好的疗效,第三代头孢菌素在疗效上可与经典的抗生素联合用药相媲美,同时避免潜在的耳毒性和肾毒性,用药时间通常是4~8周。有些患者在使用氨基糖苷类和半合成抗生素联合治疗效果不佳时单用头孢他啶也有较好的疗效。有报道头孢他啶与氨基糖苷类抗生素联合应用能扩大抗菌谱,减少抗药性并提高治疗效果。
第三代喹诺酮类抗生素环丙沙星目前已成为治疗颅底骨髓炎的一线用药[19]。喹诺酮具有较好的骨渗透性,对绿脓杆菌性骨髓炎抗菌能力强,可在组织中广泛聚集,副作用较小,口服吸收良好,推荐小剂量给药,一般给药2周左右。口服环丙沙星及碳青霉烯类抗生素的联合用药对革兰氏染色阴性厌氧菌具有较好的抗菌活性及协同抗菌作用,推荐治疗周期为4~8周[20]。
在抗生素治疗的同时,辅助以高压氧治疗可改善组织缺氧,对于抗菌素耐药及病变复发的患者能有效提高抗生素抗菌活性。在进行高压氧治疗过程中,应注意预防气压伤及氧中毒[2]。但是一项Cochrane系统评价指出随机对照实验没有足够证据表明与抗生素及手术治疗相比较,高压氧治疗在治疗颅底骨髓炎具有较好疗效,对于高压氧的疗效评价仍需进一步研究[21]。 5.3 手术治疗
手术的目的在于清除受累软组织和感染的软骨、软组织,进行较广泛的病灶清创术和脓液引流术,防止病情进展,从而控制感染进一步加重。对于并发面神经麻痹或面瘫的病人,必要时可行面神经减压[6]。当深部病变累及颅底时,因界线不清,进行完全性的手术切除是不可能的,应以保守的或较广泛的清创术为常规。 6 预后及并发症
有学者指出颅底骨髓炎的预后可能与患者的年龄、全身血管情况以及免疫学状态有关,并且正确诊断和及时的治疗是重要的[17]。早期诊断和早期治疗,包括手术清除感染组织,联合应用抗生素可有效改善患者预后。对于糖尿病及免疫力低下患者进行相关控制血糖、提高免疫力等针对性治疗也极为重要。颅底骨髓炎有较高的致死率和并发症,预后多不佳,容易复发,病程长,主要并发症有多组颅神经麻痹、海绵窦栓塞、脑膜炎和脑脓肿等,严重者可危及生命[9]。因此,提高对该病的认识,做到早期诊断及早期治疗极为重要,不及时控制病情将会导致严重后果。
| [1] | Adams A, Offiah C. Central skull base osteomyelitis as a complication of necrotizing otitis externa: Imaging findings, complications, and challenges of diagnosis. Clin Radiol, 2012, 67(10): e7-e16. |
| [2] | Sreepada GS, Kwartler JA. Skull base osteomyelitis secondary to malignant otitis externa. Curr Opin Otolaryngol Head Neck Surg, 2003, 11(5): 316-323. |
| [3] | 江远明,马志跃,肖红俊.坏死性外耳道炎. 临床耳鼻咽喉头颈外科杂志, 2007, 21(4): 185-187. |
| [4] | Barber AJ, Hanlon R, Rogers SN. Skull base osteomyelitis after maxillectomy:a rare complication. Br J Oral Maxillofac Surg, 2009, 47(4): 310-312. |
| [5] | Lee SJ, Weon YC, Cha HJ, et al. A case of atypical skull base osteomyelitis with septic pulmonary embolism. J Korean Med Sci, 2011, 26(7): 962-965. |
| [6] | Spielmann PM, Yu R, Neeff M. Skull base osteomyelitis: current microbiology and management. J Laryngol Otol, 2013, Jan; 127 Suppl 1: S8-S12. |
| [7] | Mani N, Sudhoff H, Rajagopal S, et al. Cranial nerve involvement in malignant external otitis: implications for clinical outcome. Laryngo scope, 2007, 117: 907-910. |
| [8] | Sibai TA, Ben-Galim PJ, Eicher SA, et al. Infectious collet-sicard syndrome in the differential diagnosis of cerebrovascular accident: a case of head-to-neck dissociation with skull-based osteomyelitis. Spine J, 2009, 9(4): e6-e10. |
| [9] | Clark MP, Pretorius PM, Byren I, et al. Central or atypical skull base osteomyelitis : diagnosis and treatment. Skull Base, 2009, 19(4):247-254. |
| [10] | Singh A, Al Khabori M, Hyder MJ. Skull base osteomyelitis: diagnostic and therapeutic challenges in atypical presentation.Otolaryngol Head Neck Surg, 2005, 133(1):121-125. |
| [11] | Djalilian HR, Shamloo B, Thakkar KH, et al. Treatment of culture-negative skull base osteomyelitis.Otol Neurotol, 2006, 27(2):250-255. |
| [12] | Llling E, Zolotar M, Ross E, et al.Malignant otitis externa with skull base osteomyelitis. J Surg Case Rep, 2011,2011(5):6. |
| [13] | Kim CW, Lee JJ, Kim HS, et al. Skull base osteomyelitis following a mastoidectomy, Auris Nasus Larynx, 2013, 40(6): 584-586. |
| [14] | Sharma A, Deshmukh S, Shaikh, A, et al. Wegener'granulomatosis mimicking skull base osteomyelitis. J Laryngol Otol, 2012, 126(2): 203-206. |
| [15] | Slattery WH, Brackmann DE. Skull base osteomyelitis: malignant external otitis. Otolaryngol Clin North Am,1996, 29(5):795-806. |
| [16] | Gonzalez LS, Spencer JP. Aminoglycosides: a practical review. Am Fam Physician, 1998, 58(8):1811-1820. |
| [17] | Babiatzki A, Sade J. Malignant external otitis. J Laryngol Otol, 1987, 101(3):205-210. |
| [18] | Tan JS, File TM Jr. Antipseudomonal penicillins. Med Clin North Am, 1995,79(4):679-693. |
| [19] | Cunha BA.Pseudomonas aeruginosa:resistance and therapy. Semin Respir Infect, 2002, 17(3): 231-239. |
| [20] | Yum G, Jun HS, Kwon SY, et al. Two cases of skull base osteomyelitis in elderly patients after mastoidectomy. Korean J Audiol, 2011, 15:37-40. |
| [21] | Phillips JS, Jones SE. Hyperbaric oxygen as an adjuvant treatment for malignant otitis externa.Cochrane Database Syst Rev, 2013,31(5):CD004617. |
 2015, Vol. 42
2015, Vol. 42

