扩展功能
文章信息
- 宋文明
- SONG Wen-Ming
- 糖皮质激素冲击治疗后重症肌无力早期一过性加重的机制研究
- Mechanism of early transient aggravation after glucocorticoid impact treatment in patients with myasthenia gravis
- 国际神经病学神经外科学杂志, 2015, 42(1): 22-25
- Disease Surveillance, 2015, 42(1): 22-25
-
文章历史
- 收稿日期:2014-10-10
- 修回日期:2014-12-24
重症肌无力(myasthenia gravis,MG)是累及神经肌接头的一种自身免疫性疾病,主要表现为全身肌肉无力且活动后加重,目前主要治疗方法为胆碱酯酶抑制剂和激素冲击治疗(glucocorticoids impact,GI)[1]。然而,有研究表明[2],大剂量激素冲击治疗后患者有出现呼吸肌麻痹和MG危象等一过性加重的的可能,目前其发生机制尚不清楚。本研究将探讨GI治疗后MG早期一过性加重的可能机制。 1 资料与方法 1.1 一般资料
收集我院2012年1月~2013年6月诊治的125例MG患者,所有患者表现为活动性肌无力,新斯的明试验阳性(且AchR抗体为阳性),并经肌电图检查确诊。所有患者均给予甲泼尼龙30 mg/kg/d冲击治疗,其中45例在治疗后出现肌无力一过性加重,男22例,女23例,年龄17~65岁,平均年龄(43.84±10.21)岁,病程1个月~1年,改良Osserman肌无力分型[3]:Ⅰ型16 例,Ⅱ型 20例,Ⅲ-Ⅳ型 9 例。 1.2 方法 1.2.1 治疗方法
所有患者入院后接受正规治疗,使用抗胆碱酯酶抑制剂改善神经递质的传递,口服溴化新斯的明片剂:15 mg/片,15 mg/次,3次/d;并给予大剂量甲泼尼龙30 mg/kg/d冲击治疗,第3天~第5天静脉滴注,最大剂量小于1000 mg/d,随后连续口服美卓乐80 mg/d,连续10 d后逐渐减量[4]。 1.2.2 AchR-Ab、IgG和C3检测
所有患者给予早晨空腹处理,通过左上臂抽取静脉血5 ml置入无菌抗凝试管中并放入冷藏库保存,次日对所有血液标本进行一次性解冻,解冻完毕后通过全自动离心分离机进行血清分离,采用双抗体夹心酶联免疫吸附法(ELISA法)检测血清中AchR-Ab、IgG和C3水平,试剂盒由深圳晶美生物技术开发公司提供,所有操作均由同一名高年资医师在无菌条件下依据说明书和相关规定进行[5]。 1.2.3 肌电图检测
所有患者通过肌电图/诱发电位仪将电极插入肌肉,并进行桡神经、腋神经低频重复电刺激检测,通过电刺激技术将肌肉在静息和收缩状态的生物电流放大,同时指导患者肌肉完全放松或作不同程度的用力,记录肌肉静止或收缩时的电活动情况。 1.3 观察指标和标准
治疗后次日开始评分,每天一次,早上九点开始进行临床绝对评分,临床绝对评分:总分60分。相对评分=(治疗前绝对评分-治疗后绝对评分)/治疗绝对前评分×100%,相对评分分值>80%为基本痊愈;50%~79%为显效;25%~49%为有效;小于25%为无效。MG加重程度分级:(治疗前绝对评分-治疗后最重时评分)/治疗前绝对评分×100%,小于-25%:轻度;-25%~-40%:中度;小于-40%:重度。所有结果或数据均由两名经验丰富医师采用双盲法进行读取和评估,意见不一时由另一名同等资格医师参与评判,最终结果遵从少数服从多数原则[6,7]。 1.4 统计学处理
采用SPSS 17.0统计学软件处理,对配对资料治疗前后的定量资料独立样本比较采用t检验,计数资料采用卡方检验,P<0.05为差异有统计学意义。 2 结果 2.1 GI治疗MG的不同时间段疗效观察
GI治疗后,7 d的临床有效率为57.78%,28 d后有效率为75.56%,两个时间段比较差异有统计学意义(P<0.05),见表 1。
开始治疗后肌无力一过性加重共45例,总发生率为36.0%(45/125),其中轻-中度80%(36/45),重度20%(9/45),平均出现时间为(3.21±0.32)d,持续时间为(4.84±0.63)d。 2.3 加重前后的临床评分和桡神经、腋神经低频重复电刺激波幅递减程度
肌无力加重后患者临床绝对评分明显高于加重前,桡神经和腋神经低频重复电刺激波幅递减程度均明显高于加重前,差异均具有统计学意义(P<0.05),见表 2、图 1。
| 时间 | 例数 | 临床绝对评分 | 低频重复电刺激波幅递减程度 | |
| 桡神经 | 腋神经 | |||
| 加重前 | 45 | 17.83±4.82 | 30.12±6.12 | 46.92±8.12 |
| 加重后 | 45 | 27.91±5.12 | 51.93±7.22 | 61.22±9.83 |
| t | 14.99 | 21.92 | 23.41 | |
| P | 0.001 | 0.001 | 0.001 | |
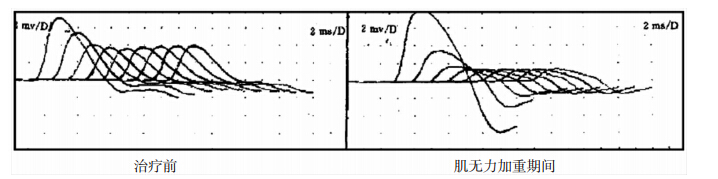 |
| 图 1 肌无力加重前后低频重复电刺激波幅的变化情况。 |
加重前后患者血清AchR-Ab、免疫球蛋白IgG和补体C3的水平比较,差异均无统计学意义(P>0.05),见表 3。
| 时间 | 例数 | AchR-Ab(nmol/L) | IgG(mg/ml) | C3(g/L) |
| 加重前 | 45 | 3.71±0.73 | 9.53±0.71 | 1.86±0.31 |
| 加重后 | 45 | 3.55±0.42 | 9.23±0.42 | 1.93±0.45 |
| t | 1.43 | 0.67 | 1.03 | |
| P | >0.05 | >0.05 | >0.05 |
MG患者神经肌接头处突触间隙增宽,突触后膜减少甚至崩解,电镜下可见特异性免疫复合物沉积,肌纤维无特异性变化,可表现肿胀、坏死或萎缩[8]。MG患者主要临床特点为晨轻暮重,肌无力在活动后加重,而休息后减轻,全身肌肉均可受累,以眼外肌受累为主,受累肌肉从一组肌群开始,范围逐步扩大[9,10]。目前临床上治疗MG的主要措施为免疫抑制剂治疗,其中主要以糖皮质激素为常用[11]。有研究表明,大剂量糖皮质激素不但可以调节细胞因子的表达,可以通过细胞膜的生化效应达快速起效的密度,并可直接诱导免疫细胞的凋亡及抑制淋巴细胞的增生和活化[12]。
本研究结果显示,GI治疗后1个月临床有效率达75.56%,其治愈和显效率明显高于治疗后1周。研究表明,大剂量GI治疗,可有效提高疗效并降低不良反应,激素冲击治疗的长期不良反应主要有糖尿病、骨质疏松、体重增加及消化性溃疡等,部分患者甚至出现股骨头坏死,且其不良反应的出现呈剂量和时间依赖性。研究发现,应用大剂量激素冲击治疗后,患者临床疗效显著,且起效快,其效果明显优于未用激素冲击治疗组。虽早期有国外学者认为,激素治疗应从小剂量开始,逐渐增大剂量,以减少或避免治疗后的早期一过性肌无力加重。
此外,本研究结果发现,部分患者在应用激素治疗后早期出现一过性肌无力加重的表现,其发生率约在6%~50%左右,本组研究纳入125例MG作为研究对象,所有患者在给药后45例出现一过性肌无力加重的现象,总发生率为36.0%(45/125),其中轻-中度80%,重度20%,平均出现时间为(3.21±0.32)d,持续时间为(4.84±0.63)d,且肌电图结果显示,患者加重后桡神经和腋神经低频重复电刺激波幅递减程度均明显高于加重前。表明大剂量GI治疗后,患者出现一过性肌无力加重症状,同时反映患者神经-肌接头处的神经传导功能减弱,提示其早期一过性肌无力加重可能与其神经-肌接头处的直接传递阻滞作用有关,患者症状加重。研究认为,其加重的可能机制是激素治疗后直接抑制了突触神经-肌接头的神经递质的传递,或者增强了胆碱酯酶抑制剂的活性,导致胆碱危象的出现,或者导致血清乙酰胆碱受体抗体滴度水平的升高等有关。本研究检测加重患者血清AchR-Ab、免疫球蛋白IgG和补体C3的水平等水平均与加重前差异无统计学意义,表明早期出现一过性肌无力加重与体内抗体和补体水平的变化无关。
综上所述,GI治疗后MG的疗效肯定,但治疗后的早期会出现一过性加重,可能与激素抑制神经递质的传递有关,但与体内抗体和补体水平的变化无关。
| [1] | Melbourne Chambers R, Forrester S, Gray R, et al. Myasthenia gravis in Jamaican children: a 12-year institutional review. Paediatr Int Child Health, 2012, 32(1): 47-50. |
| [2] | 李杰,刘丽华,张荟雪,等.雌激素与重症肌无力胸腺细胞增殖及凋亡的关系.临床神经病学杂志, 2013, 26(2): 150-151. |
| [3] | Lo HP, Bertini E, Mirabella M, et al. Mosaic caveolin-3 expression in acquired rippling muscle disease without evidence of myasthenia gravis or acetylcholine receptor autoantibodies. Neuromuscul Disord, 2011, 21(3): 194-203. |
| [4] | 管宇宙,崔丽英,刘明生,等.成人重症肌无力由眼外肌向全身型的演化.中华神经科杂志, 2012, 45(12): 866-868. |
| [5] | Ware TL, Ryan MM, Kornberg AJ, et al. Autoimmune myasthenia gravis, immunotherapy and thymectomy in children. Neuromuscul Disord, 2012, 22(2): 118-121. |
| [6] | 马金山,王小雷,陈康,等.重症肌无力病人胸腺切除术后危象发生的多因素分析.中华胸心血管外科杂志, 2011, 27(1): 27-29. |
| [7] | 景筠,张晓君,秦宁宁,等.眼肌型重症肌无力干预后状态.中华神经科杂志, 2011, 44(8): 558-562. |
| [8] | 黄志新,黄志.糖皮质激素对儿童重症肌无力Th1/Treg细胞转录因子表达的影响及机制研究.重庆医科大学学报, 2011, 36(3): 302-305. |
| [9] | 黄莹,赵重波,朱雯华,等.重症肌无力患者外周血细胞糖皮质激素受体α, β mRNA表达与激素治疗的关系.复旦学报(医学版),2012, 39(1): 31-35. |
| [10] | Feng HY, Liu WB, Huang X, et al. Efficacy and safety of low-dose cyclophosphamide plus corticosteroids for type I/lI myasthenia gravis. Zhonghua Yi Xue Za Zhi, 2012, 92(33): 2323-2326. |
| [11] | 王明光,高吉照,姚丹.激素联合丙种球蛋白治疗小儿重症肌无力的疗效及对患儿免疫球蛋白和补体的影响.现代生物医学进展, 2013, 13(33): 6505-6508. |
| [12] | ZHAO Chong-chong, WANG Huan, CAI Hong-bin, et al. Impact of glucocorticoid on immunology pathogenesis in patients with myasthenia gravis. Journal of Apoplexy and Nervous Diseases, 2012, 29(10): 907-909. |
 2015, Vol. 42
2015, Vol. 42

