扩展功能
文章信息
- 邓惠慧, 郭久晴, 杨晓苏, 李芳, 杨玲, 彭暮云
- DENG Hui-Hui, GUO Jiu-Qing, YANG Xiao-Su, LI Fang, YANG Lin, PENG Mu-Yun
- 头痛宁胶囊对偏头痛大鼠BDNF/TrkB信号通路表达的影响
- Effect of Toutongning Capsule on BDNF/TrkB signaling pathway in rats with migraine
- 国际神经病学神经外科学杂志, 2015, 42(1): 13-17
- Disease Surveillance, 2015, 42(1): 13-17
-
文章历史
- 收稿日期:2014-10-16
- 修回日期:2014-12-31
2. 中南大学湘雅医学院, 湖南省长沙市 410011;
3. 广东省佛山市顺德区龙江医院, 广东省佛山市 528318;
4. 河北医科大学第三医院神经内科, 河北省石家庄市 050000;
5. 中南大学湘雅二医院胸外科, 湖南省长沙市 410011
作为临床常见的慢性复发性头痛,偏头痛给病人带来不同程度的个人及家庭负担,使病人生活质量下降,因此,积极寻找防治偏头痛的药物或方法十分重要。目前在偏头痛的防治上,除使用国内外“偏头痛防治指南”中所推荐的药物外,一些具有中国特色的中成药也在临床中运用,其疗效得到一定程度的肯定。其中,不少临床研究显示,头痛宁胶囊(已上市)具有减少偏头痛发作频率、减轻疼痛程及缩短持续时间等良好的疗效,但其作用机制不清。
脑源性神经营养因子(brain derived neurotrophic factor,BDNF)是疼痛的重要调节因子,而BDNF/酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)信号通路是BDNF在机体疼痛的发生发展中的重要参与途径,触发该通路后引起细胞内的信号级联反应,导致中枢敏化[4],从而造成疼痛的发生。我们前期研究[5]提示偏头痛的发生发展中存在BDNF/TrkB信号通路的活化。本实验拟采用头痛宁胶囊对偏头痛模型大鼠进行干预,观察比较各组大鼠行为学改变,于第5次建模后运用ELISA法检测血清BDNF水平以及免疫组化法分别检测三叉神经组织中BDNF、TrkB、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、磷酸化cAMP反应结合蛋白(phosphorylated cAMP-response element binding protein,p-CREB)的表达变化及其定位,观察头痛宁胶囊对偏头痛大鼠模型中BDNF及其信号通路上TrkB受体、下游信号分子ERK、p-CREB表达的影响,探讨头痛宁胶囊治疗偏头痛的可能作用机制。 1 材料与方法 1.1 实验动物
清洁级Sprague-Dawley(SD)大鼠60只,雌雄各半,体重200±20 g,由湖南农业大学动物实验中心提供,分笼饲养。随机分为:正常对照组、模型组、头痛宁干预组,后两组再分为发作期组和间歇期组,每组12只,雌性各半。模型组大鼠依据Tassorelli[6]法,背部皮下注射硝酸甘油注射剂 10 mg(2 ml)/kg建模后,约3~5 min后出现双耳潮红,两前肢挠头频率增加,伴有躁动不安现象(如爬笼次数增多等),持续约3 h后逐渐出现倦怠、疲乏、活动度下降。上述注射每周 1 次,共5 周,以模拟偏头痛的反复发作。头痛宁干预组大鼠每天用头痛宁胶囊悬液0.38 g/kg(头痛宁药粉加生理盐水配置,0.38 g是指头痛宁胶囊中药粉的重量)灌胃1次,每隔7 d末次给药1 h后进行造模,共5次。对照组大鼠背部皮下注射 2 ml/kg生理盐水,每周注射1 次,共 5 周。对照组于第5次注射生理盐水后3 h取材,模型组及干预组大鼠在发作期(第5次造模后的3 h)或于间歇期(第5次造模后的第4天)取材。 1.2 主要仪器及试剂
YJ-875A医用超净工作台(吴江市净化设备总厂);烤箱(上海跃进机械厂);低温台式离心机(德国Zenterifu Gen CE);-80℃冰箱(美国Forma公司);±4℃冰箱(Electrolux BCD-218e);精密可调微量移液器(德国Eppemdrof公司);Syngene Bio Imaging检测系统(英国Syngene公司);冷冻切片机(德国Leica仪器有限公司);Leica DM4000 B LED生物医学常规及研究应用显微镜(德国Leica公司);生物光学显微镜照相机(德国Leica公司)。头痛宁胶囊(陕西步长制药有限公司生产,批号20110806);Rat BDNF ELISA Kit(武汉博士德生物公司);兔二步法免疫组化检测试剂(北京中杉金桥公司);DAB显色试剂盒(北京中杉金桥公司);兔抗鼠BDNF多克隆抗体(美国 Abcam 公司);兔抗鼠TrkB多克隆抗体(美国 Abcam 公司);兔抗鼠p-CREB单克隆抗体(美国Cell Signaling Technology公司);兔抗鼠p-ERK单克隆抗体(美国Cell Signaling Technology公司);10%水合氯醛(湘雅医院药剂科);中性树胶(上海懿洋仪器有限公司);二甲苯(湖南化学试剂厂);硝酸甘油针(广州白云山明兴制药有限公司);多聚甲醛(上海化学试剂公司)等。 1.3 ELISA法测定大鼠血清BDNF水平
在各组中随机抽取6只大鼠,心脏采血约3 ml,用干净试管收集血液,室温凝固30 min,离心1500×g 15 min,收集血清。分装后-20℃冷冻保存。血清BDNF水平的测定按ELISA试剂盒说明书进行。 1.4 免疫组织化学染色检测三叉神经节细胞内BDNF、TrkB、p-ERK和p-CREB蛋白表达
将上述采血后大鼠灌注后双侧三叉神经节取材,固定后梯度脱水,水平位连续切片,每片厚度为8 μm。采用SABC法进行免疫组织染色,BDNF多克隆抗体一抗浓度为1∶100,TrkB多克隆抗体一抗浓度为1∶2000,p-CREB单克隆抗体一抗浓度为1∶200,p-ERK单克隆抗体一抗浓度为1∶100,以PBS取代一抗作为阴性对照,均4℃过夜,其他步骤按试剂盒说明书进行。经染色后,棕褐色的细胞的出现即为阳性,滴加PBS(phosphate buffered saline)后仅呈现较淡背景色为阴性对照切片。拍照后用Image-Pro Plus半定量分析细胞中棕褐色范围内的光密度值,每张切片随机选取5个视野,取其平均值进行统计比较分析。 1.5 统计学处理
数据采用均数±标准差(x±s)表示,先行正态性及方差齐性检验。组间比较采用单因素方差分析,两组间均数比较采用LSD检验,检验水准α=0.05,P<0.05认为有统计学意义。纳入的数据采用SPSS 18.0统计分析软件进行处理。 2 结果 2.1 大鼠行为学改变
偏头痛模型组大鼠在硝酸甘油造模后3~30 min内,均出现了双侧耳发红,挠头次数增多,爬笼活动明显,这种行为持续2~3 h左右,在不同时间段内,均高于对照组,差异有统计学意义(P<0.05);随后大鼠出现活动行为减少,疲倦。模型成功率100%。干预组大鼠造模后亦出现上述行为学改变,但持续时间及挠头爬笼次数较模型组减少,有统计学意义的差异(P<0.05)。对照组大鼠在注射生理盐水后未出现上述行为学改变。各组大鼠行为学无雄雌性别差异(P>0.05)。 2.2 血清BDNF水平测定
方差分析表明,各组发作期及间歇期BDNF水平的表达存在显著差异,具有统计学意义(P<0.05)。进一步组间比较可见,模型组大鼠发作期及间歇期血清BDNF水平高于干预组相应期和对照组(P<0.05);模型组及干预组大鼠发作期血清BDNF水平又高于同组间歇期,差异有统计学意义(P<0.05);干预组大鼠间歇期血清BDNF水平与对照组相比,及各组雌、雄性别间比较,差异均无统计学意义(P>0.05)。见表 1。
| 组别 | 雌性 | 雄性 | |||
| 发作期 | 间歇期 | 发作期 | 间歇期 | ||
| 对照组 | 1.05±0.45* | 1.05±0.45* | 1.06±0.58* | 1.06±0.58* | |
| 模型组 | 4.59±1.49Δ | 2.11±0.26* | 4.36±1.48Δ | 1.84±0.32* | |
| 干预组 | 2.77±0.37*Δ | 1.28±0.38* | 2.74±0.21*Δ | 1.09±0.43* | |
| F | 22.067 | 13.475 | 19.016 | 7.197 | |
| P | 0.000 | 0.000 | 0.000 | 0.006 | |
| 注:*为与相应同组模型组发作期表达比较,P<0.05;Δ为与同组间歇期比较,P<0.05。 | |||||
各组大鼠三叉神经节细胞内表达的BDNF阳性蛋白定位于细胞浆,TrkB阳性蛋白定位于细胞浆及细胞膜,p-ERK阳性蛋白定位于细胞膜、细胞浆及核仁的p-CREB蛋白定位于细胞核,阳性着色为出现棕黄色颗粒。方差分析显示:各组发作期的BDNF、TrkB、p-ERK和p-CREB蛋白表达差异有统计学意义(P<0.05),但各组间歇期的表达差异无统计学意义(P>0.05)。进一步组间比较可见:模型组大鼠发作期的各蛋白表达高于其他各组(P<0.05);模型组及干预组发作期的各蛋白表达也高于对应的间歇期,差异有统计学意义(P<0.05);而干预组间歇期的各蛋白表达与对照组相比,以及各组雌、雄性别间比较,差异均无统计学意义(P>0.05)。见表 2、图 1和图 2。
| 组别 | 性别 | 发作期 | 间歇期 | |||||||
| BDNF | TrkB | ERK | p-CREB | BDNF | TrkB | ERK | p-CREB | |||
| 模型组 | 雌性 | 0.41±0.06*Δ | 0.48±0.06*Δ | 0.34±0.05*Δ | 0.45±0.04*Δ | 0.24±0.01 | 0.24±0.02 | 0.12±0.02 | 0.14±0.03 | |
| 雄性 | 0.47±0.07*Δ | 0.46±0.06*Δ | 0.37±0.06*Δ | 0.48±0.03*Δ | 0.22±0.01 | 0.24±0.03 | 0.12±0.01 | 0.15±0.03 | ||
| 干预组 | 雌性 | 0.33±0.03Δ | 0.32±0.04Δ | 0.20±0.04Δ | 0.25±0.02Δ | 0.22±0.03 | 0.21±0.04 | 0.11±0.01 | 0.13±0.02 | |
| 雄性 | 0.34±0.03Δ | 0.33±0.04Δ | 0.22±0.03Δ | 0.24±0.03Δ | 0.22±0.04 | 0.23±0.22 | 0.12±0.02 | 0.14±0.03 | ||
| 对照组 | 雌性 | 0.21±0.03 | 0.23±0.02 | 0.13±0.02 | 0.14±0.04 | 0.21±0.03 | 0.23±0.02 | 0.13±0.02 | 0.14±0.04 | |
| 雄性 | 0.23±0.03 | 0.22±0.02 | 0.12±0.03 | 0.13±0.03 | 0.23±0.03 | 0.22±0.02 | 0.12±0.03 | 0.13±0.03 | ||
| 注:*为模型组发作期与其他各组比较,P<0.05;Δ为与同组相应间歇期比较,P<0.05。 | ||||||||||
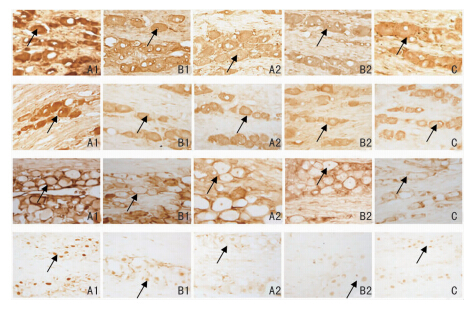 |
| 图 1 各组雌性大鼠三叉神经节细胞内BDNF、TrkB、p-ERK、p-CREB蛋白的表达(IHC×200)。从上到下依次为BDNF、TrkB、p-ERK、p-CREB。A:模型组;B:干预组;C:对照组。 1:发作期 2:间歇期。箭头所指处为阳性细胞。 |
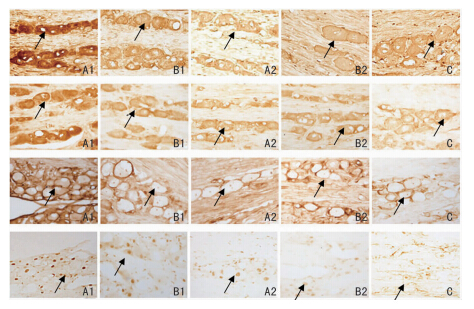 |
| 图 2 各组雄性大鼠三叉神经节细胞内BDNF、TrkB、p-ERK、p-CREB蛋白的表达(IHC×200)。从上到下依次为BDNF、TrkB、p-ERK、p-CREB。A:模型组;B:干预组;C:对照组。1:发作期 2:间歇期。箭头所指处为阳性细胞。 |
不少研究提示,BDNF是中枢神经系统疼痛产生途径中的一个重要神经传导因子[7],在多种不同形式痛觉的中枢敏化过程中起到关键作用[8,9]。Yajima等[10]的实验中通过反复注射全长型TrkB受体的特异性抗体能改善大鼠的热痛觉过敏情况,提示BDNF通过与fl-TrkB的结合参与疼痛的发生发展过程。在三叉神经血管学说中,三叉神经节内的神经元主要发挥疼痛信号初级传入的功能,而三叉神经节的损害可能是偏头痛发病的解剖学基础,也是目前研究的热点所在。目前关于BDNF与疼痛的研究主要是围绕脊髓水平的疼痛产生的过程,而关于头痛相关性的报道较少。有实验指出BDNF能够影响三叉神经痛觉产生过程中的突触可塑性,并且能够在三叉神经节神经元细胞中表达[11]。我们的前期研究也初步证实三叉神经节水平的BDNF/TrkB信号通路依赖于ERK-CREB通路的活化参与偏头痛的发生发展,这结果与既往BDNF与其他疼痛的研究结果一致。
作为一种中成药制剂的头痛宁胶囊,由天麻、土茯苓、何首乌、当归、防风、全蝎组成,具有平肝和络,祛风止痛之功效。其中天麻对动脉血管平滑肌有松弛解痉作用,可调节血管舒缩功能,达到有效缓解头痛等症状的目的,与土茯苓合用,具有活血化瘀,祛风止痛之功效;全蝎含蝎毒多肽,为小分子形式,且活性极强,能刺激血脑屏障开放,使药物直接作用于头痛的调控位点,有效止痛,这也是头痛减轻的原因[3];何首乌解毒消痈,润肠通便,滋补肾阴,填精益髓,与防风合用,养血润燥,祛风止痛,与当归合用补血滋阴;当归有促造血,抗凝,抗血栓,松弛血管平滑肌等功能,能抑制5-HT的释放,具有镇静镇痛抗炎及扩张血管作用,可提高体液免疫和非特异性免疫功能[12],改善脑缺血缺氧引起的偏头痛。
NO是偏头痛发生的启动因子,既可直接扩张血管,也可协同其他神经递质触发神经源性炎症、易化伤害痛觉冲动的中枢传递。因此,本实验使用硝酸甘油作为NO的供体用来制作偏头痛动物模型,模拟偏头痛发生发展的病理生理过程。目前不少研究指出,头痛宁可通过抑制三叉神经节P2X3 mRNA的过度表达[13]或拮抗G蛋白偶联受体来抑制信号传导[14]等途径达到防治偏头痛的作用。因此,头痛宁胶囊是否也可通过干扰BDNF信号通路参与对偏头痛防治,是本实验的研究目的,使其应用于临床疾病的防治的依据更加充分。我们研究结果显示,头痛宁治疗组大鼠发作期三叉神经节内BDNF、TrkB、p-ERK和p-CREB蛋白的表达水平以及血清BDNF的水平均低于模型组大鼠发作期的水平,提示头痛宁胶囊可以下调BDNF、TrkB、p-ERK和p-CREB蛋白的表达水平,而我们的前期研究提示BDNF及其通路中TrkB、ERK和p-CREB的表达上调参与了偏头痛的发生发展,可能与偏头痛发病机制中的中枢敏化有关,且BDNF/ TrkB信号通路依赖于ERK-CREB通路的活化,据此,结合本实验的结果,我们推测头痛宁胶囊防治偏头痛的机制可能与抑制三叉神经节处BDNF/TrkB信号通路的蛋白表达水平有关。
| [1] | 张光翠,姚永玲.步长头痛宁胶囊对偏头痛患者生存质量的影响.现代中西医结合杂志, 2011, 20(15): 1886. |
| [2] | 刘新英.步长头痛宁胶囊治疗偏头痛120例临床观察.山东医药, 2007, 47(35): 79-80. |
| [3] | 杨海霞,张玉芹,刘斌.头痛宁胶囊治疗偏头痛的疗效评价及其对血小板和血液流变学的影响.中国实验方剂学杂志, 2012, 18(5): 230-232. |
| [4] | 郁飞宇.中枢性敏化与偏头痛.国际神经病学神经外科学杂志, 2013, 40(4): 349-352. |
| [5] | 邓惠慧.BDNF在硝酸甘油致偏头痛大鼠发病机制中的作用探讨.长沙:中南大学, 2013. |
| [6] | Tassorelli C, Greco R, Wang D, et al. Nitroglycerin induces hyperalgesia in rats--a time-course study. Eur J Pharmacol, 2003, 464(2-3):159-162. |
| [7] | Pezet S, McMahon SB. Neurotrophins: mediators and modulators of pain. Annu Rev Neurosci, 2006, 29: 507-538. |
| [8] | Heppenstall PA, Lewin GR. BDNF but not NT-4 is required for normal flexion reflex plasticity and function. Roc Natl Acad Sci USA, 2001, 98(14): 8107-8112. |
| [9] | Ren K, Dubner R. Pain facilitation and activity-dependent plasticity in pain modulatory circuitry: role of BDNF-TrkB signaling and NMDA receptors. Mol Neurobiol, 2007, 35(3): 224-235. |
| [10] | Yajima Y, Narita M, Narita M, et al. Involvement of a spinal brain-derived neurotrophic factor/full-length TrkB pathway in the development of nerve injury-induced thermal hyperalgesia in mice. Brain Res, 2002, 958(2): 338-346. |
| [11] | Latremoliere A, Woolf CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity. J Pain, 2009, 10(9): 895-926. |
| [12] | 黄春林,朱晓新.中医药理与临床手册.北京:人民卫生出版社, 2006. |
| [13] | 刘斌,王彩霞,符艳松.头痛宁胶囊对偏头痛模型大鼠三叉神经节P2X3mRNA表达的影响.中国实验方剂学杂志, 2011, 17(19): 188-190. |
| [14] | 方莉,白金娟,连亚军,等.头痛宁对偏头痛模型大鼠硬脑膜、三叉神经节及脑干区JNK-1和PAR-2表达的影响.郑州大学学报(医学版), 2011, 46(3): 409-412. |
 2015, Vol. 42
2015, Vol. 42


