扩展功能
文章信息
- 王非一凡, 李学军
- miR221/222家族在胶质瘤中的研究进展
- 国际神经病学神经外科学杂志, 2014, 41(6): 565-570
- Disease Surveillance, 2014, 41(6): 565-570
-
文章历史
- 收稿日期:2014-09-05
- 修回日期:2014-11-25
MicroRNA是近年来发现的一类长度为19~25个核苷酸的非编码小分子RNA。MicroRNA通过和靶基因mRNA碱基配对引导沉默复合体(RISC)降解靶mRNA,而与靶mRNA不完全互补的MicroRNA则在蛋白质翻译水平上抑制其表达,从而参与调控个体发育、细胞凋亡、增殖及分化等生命活动[1,2,3,4]。根据2014年6月26日发布的第21版miRBase序列数据库资料显示,目前已经发现并证实的人类 MicroRNA已达到1881 种,已有诸多研究表明,MicroRNA 可通过调控其靶标基因参与的信号通路,影响肿瘤的发生和发展,发挥着类似于癌基因或抑癌基因的功能[5,6,7]。
胶质瘤是神经外科中具有高发病率、高致残率和高病死率等特征的一类肿瘤。由于肿瘤生长速度快且常为侵袭性生长,常规的手术切除与放化疗均难以达到令人满意的疗效。新近的国内外研究发现MicroRNA-221(miR221)和MicroRNA-222(miR222)在胶质瘤细胞中的表达显著高于正常细胞[8,9]。通过与PTEN mRNA 3’-UTR互补结合来抑制PTEN磷酸水解酶表达,miR221/222能够减弱抑癌基因PTEN在控制细胞增殖、凋亡、转移与侵袭中的效能[10]。除PTEN外,miR221/222还与p27kip1、PUMA、TIMP3、Cx43等多种癌症相关基因发生作用[11,12,13]。本文尝试对miR221/222 家族的最新研究进展进行论述,以揭示其在胶质瘤分子病理层面的重要作用。 1 miR221/222的基因结构及生物学特征
miR221和miR222是在人类X染色体上相距227bp的串联编码MicroRNA,由于miR221与miR222在核酸序列上非常接近,具有相同的“种子序列”,因此两者在调控机制上常出现同步变化,而生物学功能方面则表现为协同作用。
根据miRBase 序列数据库及NCBI数据库资料显示,hsa-mir-221定位于Xp11.3,其茎环结构序列位于X染色体第45746157位至第45746266位的负链上,共计110个核苷酸序列(见图 1、图 2);hsa-mir-222定位于Xp11.3,其茎环结构序列位于X染色体第45747015位至第45747124位的负链上,共计110个核苷酸序列(见图 3)。
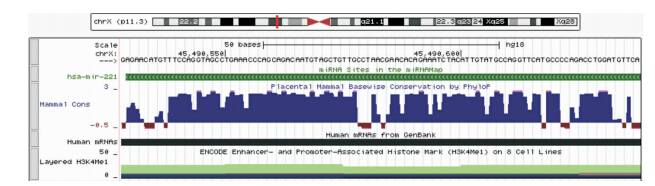 |
| 图 1 hsa-mir-221的基因定位图源于UCSC Genome Browser数据库 |
 |
| 图 2 hsa-miR-221的茎环结构序列 |
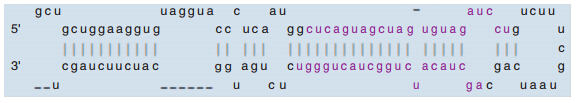 |
| 图 3 hsa-miR-221的茎环结构序列 hsa-miR-221 的成熟结构序列:AGCUACAUUGUCUGCUGGGUUUC hsa-miR-222 的成熟结构序列:AGCUACAUCUGGCUACUGGGU |
与其他MicroRNA一样,miR221和miR222是由其编码DNA转录生成含有一个发夹结构的初级转录产物,转录后即被RNaseⅢ酶Drosha在Pasha(也称DGCR8)的帮助下剪切成约80 bp大小的前体pre-microRNA。pre-microRNA再由Exportin 5蛋白转运进入细胞质,经过NaseⅢ酶Dicer进一步剪切后形成22 bp的双螺旋MicroRNA,双链中的一条与RNA沉默复合物(RNA-induced silencing complex,RISC)形成 RISC-miRNA复合物,从而对靶基因mRNA进行切割或者翻译抑制。 2 miR221/222 在胶质瘤中的表达
已有的研究发现miR221和miR222在人类多 种肿瘤中表达异常,如甲状腺癌、肝癌、胃肠间质 瘤和白血病等恶性肿瘤[9]。除此之外,miR221和miR222在恶性胶质瘤中的表达也明显上调。Ciafr等利用基因芯片技术检测了人恶性胶质瘤组织中245种microRNA的表达水平,发现与正常脑组织相比miR221的表达明显上调,而miR222亦同时上调[14]。Ie Sage等也发现同样的现象,恶性胶质瘤中miR221和miR222的表达水平明显高于瘤旁组织,并认为其高表达是促进肿瘤细胞增殖的重要因素[15]。赵鹏等通过收集不同病理级别胶质瘤标本,以荧光定量PCR法检测其中miR221及miR222的表达水平,结果显示miR221/222的过表达与胶质瘤,尤其是恶性胶质瘤的发生、发展密切相关[16]。 3 miR221/222 的激活与核转录因子NF-kB
核转录因子(nuclear factor k gene binding,NF-kB)是1986年Sen等首次在成熟的B细胞发现的能与免疫球蛋白k轻链基因的增强子kb序列特异结合的蛋白因子。NF-kB是由Rel蛋白家族成员以同源或异源二聚体形式组成。Rel蛋白包括Rel A(P65 NF-KB3)、Rel(c-Rel)、RelB、NF-kB1(P50)和NF-kB2(P52)。标准的NF-kB为p50和p65的二聚体.NF-kB依靠调控特定的序列转录来调控多种基因的表达,NF-kB参与免疫反应、炎症反应、细胞凋亡、肿瘤发生等多种生物进程[17]。随着对 MicroRNA 研究的兴起,NF-kB是否能够激活 MicroRNA,MicroRNA 是否参与了NF-kB调控网络的构成,极大的激发了人们的研究兴趣。
Galardi等[18] 对U87胶质瘤细胞系和PC3前列腺癌细胞系进行了miR221和miR222检测。通过qRT-PCR方法,他们发现miR221和miR222的表达水平与NF-kB信号通路的有密切的关系。通过建立LNCaP细胞系的NF-kB激活模型,他们发现在导入TNF-a激活NF-kB信号通路之后,miR221与miR222的表达增量超过了2倍(fold)。他们进一步在U87细胞系和PC3细胞系中研究发现,在原本NF-kB高激活和miR221/222高表达的细胞中导入pCMV-IkBaM(携带有IkBa的质粒载体)之后,通过阻断NF-kB的磷酸化而终止信号通路,此时U87和PC3细胞系中的miR221/222表达水平均下降了50%。随后,他们通过生物信息学模拟发现,与NF-kB经典靶基因结构域相比,mir221/222上游存在着与其类似的NF-kB结合区域,分别命名为Region A与Region B序列。通过cDNA 文库构建包含pRegA和pRegB的质粒,并转染进入U87和PC3细胞,Galardi等人检测出活化的Region A使miR221/222表达增强2倍(fold),而活化的Region B更是使miR221/222表达水平增强了6倍(fold)。这些研究为NF-kB直接作用并激miR221/222提供了证据;另外,它们还丰富了NF-kB调控网络的构成。通过激活 miR221/222 家族,NF-kB不但实现了对部分下游因子的调控,还形成了正反馈环路增强和放大自身的效应。 4 miR221/222 的下游途径
目前研究表明,miR221/222家族参与的细胞调亡和细胞周期调控主要通过以下几个靶基因途径产生。 4.1 miR221/222 与p27途径
p27 基因是1994年Polyak等发现的一种调控细胞周期并抑制细胞分裂的重要基因,定位于第12 号染色体短臂1区3带(12p13),其表达产物P27蛋白为细胞周期素(cyclin)依赖性蛋白激酶抑制因子(cyclin dependent kinase inhibitor,CDKI),含有 198 个氨基酸,相对分子质量约27×103,由2个外显子和2个内含子组成。p27蛋白具有限制性调节细胞周期进程的作用,这一作用主要通过抑制CDK复合物的功能来实现。虽然p27能广泛抑制各种周期素和CDK的活性,但主要抑制细胞周期蛋白E-CDK2和细胞周期蛋白D-CDK4等G1期激酶复合物,使细胞周期在G1期停顿。p27的这种负性调节细胞增生的生物学功能使它成为肿瘤抑制基因,而MicroRNA在p27调控通路中的角色,则成为了近期的研究热点[19]。
赵鹏等人收集不同病理级别胶质瘤标本,通过荧光定量PCR法和Western blotting检测其中miR-221及p27蛋白的表达,分析其与胶质瘤病理级别的关系。结果表明miR221的表达水平与肿瘤恶性程度呈正相关,而与p27的表达负相关[16]。这暗示miR221的表达强度增加和p27的表达下降或缺失与神经胶质瘤,特别是恶性胶质瘤的发生、发展有着密切的关系。张春智等人建立了G422胶质母细胞瘤瘤株标准化裸鼠荷瘤模型,并导入反义miR221/miR222治疗,结果发现经反义miR-221/222共转染组的裸鼠肿瘤生长速度明显低于其他各组。组织切片行免疫组化显示反义miR-221/222共转染治疗组的Ki67阳性率显著低于对照组,说明肿瘤生长减缓,而该组肿瘤细胞中的p27阳性表达又明显高于其他对照组[20]。通过以上研究,可以证实p27途径是一个确切的miR22下游信号通路,同时也是极有潜力的临床治疗靶点之一。 4.2 miR221/222 与PUMA途径
PUMA(p53 up-regulated modulator of apoptosis)是2001年由Yu等人发现的一个新Bcl-2家族成员。人类PUMA序列定位于19q13.3-13.4,其cDNA长度约为1900bp。转录生成四种不同的剪接体,其中PUMA-α和PUMA-β因含有BH3结构域而受到了广泛的研究。该结构域是PUMA蛋白与Bcl-2家族其它成员相互作用,发挥促凋亡作用的关键因素[21]。已有的研究表明,PUMA诱导细胞凋亡包括了p53依赖性凋亡通路和p53非依赖性凋亡通路,两条通路最终都通过诱导线粒体膜电位改变,引起细胞色素C等凋亡信号因子的释放,进而激活caspase3和caspase9最终导致细胞凋亡。
Zhang等人[22]通过对40份人类胶质瘤样本进行原位杂交与免疫组化检测,发现miR221/222高表达的样本中有81%出现了PUMA的表达水平降低(P<0.001),与此同时在miR221/222下调的样本中,其中有79%检测出了PUMA的高水平表达。在进一步的实验中,他们还发现与低级别的胶质瘤相比,高级别胶质瘤中miR221/222的表达水平上升更加显著。在该研究组的另一个实验中,通过建立U251恶性胶质瘤体外细胞系,并向其中转染反义miR-221/222,发现AS-miR221/222同时转染组U251细胞中PUMA的表达明显上调。而AS-miR221组和AS-miR-222单独转染组也可上调胶质瘤细胞的PUMA表达,单独转染组较空白对照组的PUMA表达增强,但较AS-miR221/222组弱。进一步的Western blot结果显示促凋亡蛋白Bax和caspase3表达与PUMA表达成正相关,在AS-miR221/222组中表达最高。由此可见,miR221/222通过下调PUMA从而关闭肿瘤细胞的凋亡机制。 4.3 miR221/222 与TIMP3途径
TIMPs 家族有4个成员(TIMP1,2,3,4),其中TIMP1、2、4为可溶性分泌蛋白,TIMP3是与细胞外基质(ECM)结合的非可溶性蛋白,位于细胞外膜上,并能紧密连结基底膜,它可有效抑制基质金属蛋白酶的活性,并控制着多种细胞因子、生长因子、细胞黏附分子和受体的释放。通过抑制TNF-α转换酶以及稳定细胞膜表面的TNF-α受体,TIMP3可以诱导程序性细胞死亡[23,24]。
翟博智等人采用MicroRNA靶基因预测软件Target Scan分析发现TIMP3的mRNA3’UTR存在潜在的miR221/222结台位点。他们通过建立U251裸鼠皮下胶质瘤模型,使用寡聚核苷酸反义miR221和miR222转染实验组小鼠,Western blot显示,下调miR221/222表达,能上调TIMP3表达水平,同时侵袭相关蛋白MMP2和MMP9表达水平也出现了明显的下降。转染后第28天的肿瘤切片免疫组化染色分析也显示,TIMP3表达上调,MMP2和MMP9表达下调。形态学的观察结果,与空白对照组相比,形态学的观察发现反义miR221/222组第8天时肿瘤体积出现显著性减小(P<0.05),此后瘤体缩小更加明显[25]。该项研究结果表明,miR221与miR222是通过TIMP3,来调节MMP2和MMP9表达,从而调控胶质瘤细胞的侵袭能力。 4.4 miR221/222 与PTEN途径
抑癌基因PTEN(Phosphatase and tensin homolog磷酸酯酶与张力蛋白同源物基因)于1997年首次被报道之后即成为研究热点。磷酸酶基因(PTEN)是迄今发现的第一个具有双特异磷酸酶活性的抑癌基因,也是继p53基因后发现的另一个较为广泛地与肿瘤发生关系密切的基因,定位于10q23.3,转录产物为515kb mRNA,属于PTP(Protein Tyrosine Phosphatases)基因家族成员,其对应的蛋白能通过有效拮抗PI3K-AKT信号传导通路阻止肿瘤的发生发展[26]。作为脂类磷酸酶,PTEN能将细胞膜上的PIP3去磷酸化生成PIP2,进而拮抗PI3K介导的细胞生长、代谢、增殖和存活信号。
谢强、黄作平等人的研究首次证实miR-221在人胶质瘤耐化疗药物细胞株中表达明显高于人胶质瘤药物敏感细胞株。同时,Western blotting结果显示,PTEN在人胶质瘤药物敏感细胞株中蛋白表达含量明显高于miR221高表达的人胶质瘤耐药细胞株[27]。这提示到,miR221可能通过影响PTEN蛋白水平从而介导其下调,而PTEN基因则为miR221调控网络中的一个潜在控制靶点。
Xie等在实验中,将miR221模拟物注入人脑胶质瘤卡莫司汀敏感细胞株(SWOZ2),发现在未影响PTEN基因mRNA表达水平的同时,PTEN蛋白水平出现了明显的下调。而进一步实验中,他们将miR221抑制剂和竞争性反义核苷酸转入人脑胶质瘤卡莫司汀耐药细胞株(SWOZ2-BCNU),结果同样显示了在未改变PTEN mRNA转录水平的情况下,PTEN蛋白的表达明显上升,细胞出现卡莫司汀药物敏感反应。此外,PTEN的关键下游靶标Phospho-Akt(Ser473)也在miR221的影响下出现了表达下降[28]。这些结果都提示到miR221/222 是调控PTEN/Akt信号轴的关键环节。 5 miR221/222 的调节通路
作为一类保守的、非编码MicroRNA,miR221/222 通过被NF-kB激活,抑制p27kip1、PUMA、TIMP3、PTEN等抑癌基因的表达,从而调控胶质瘤细胞的生长,增强肿瘤细胞的侵袭能力,并通过与NF-kB形成正反馈环路,不断增强其自身的作用[29,30,31](见图 4)。
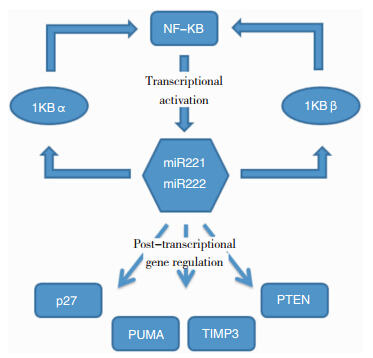 |
| 图 4 miR221/222 的调节通路 |
NF-kB基因通过识别特异性序列激活miR221/222。miR221/222 则通过识别p27kip1、PUMA、TIMP3、PTEN的3’非编码区结构抑制它们的表达。miR221/222 能够与IkBα、IkBβ形成正反馈环路,通过抑制IkBα、IkBβ与NF-kB的结合,降低它们对NF-kB的抑制。 6 miR221/222 在胶质瘤研究展望
上述的一系列研究为我们认识miR221/222家族在胶质瘤生长侵袭中的作用提供了良好的基础。同时纵观以上研究,不难发现寻找生物体内具有特殊调控功能的MicroRNA及其调控的靶点正成为胶质瘤研究领域的一大热点。miR221/222家族在血管生成、肝癌、乳腺癌、甲状腺癌、胰腺癌以及恶性胶质瘤等疾病的发展过程中都发挥了关键性作用,其靶基因和下游信号通路涵括了p27kip1、PUMA、TIMP3、PTEN、Cx43等。
然而,人们对于miR221/222家族的研究仍处于探索阶段,目前对miR221/222家族的研究大多是针对其作用靶点和下游信号通路开展,而上游的NF-kB调控机制及其他潜在的启动机制都还未研究透彻。miR221/222对细胞周期及细胞分化的调控是一个精细而复杂的过程,与绝大多数MicroRNA一样,miR221/222不仅调控细胞中多个信号转导途径相关的mRNA,还受到上游数个核转录因子的调节,也既miR221/222家族的调控一方面是“一对多”的,另一方面则是“多对一”的。从mRNA角度来观察,一个基因的3’非翻译区往往有着多个MicroRNA结合位点,这意味着一个mRNA可以同时被数个MicroRNA所调控。随着该领域研究的深入,以及生物信息学技术的不断发展,对于MicroRNA信号通路的研究必然会走向全局整合水平。相信在不远的将来,人们将以miR221/222家族和其他MicroRNA为基础,阐明胶质瘤细胞信号调控网络的机制,寻找出药物靶点,为胶质瘤的治疗提供新型基因药物。
| [1] | Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med, 2012, 4(3): 143-159. |
| [2] | Croce CM. Causes and consequences of microRNA dysregulation in cancer. Nat Rev Genet, 2009, 10(10): 704-714. |
| [3] | Winter J, Jung S, Keller S, et al. Many roads to maturity: microRNA biogenesis pathways and their regulation. Nat Cell Biol, 2009, 11(3): 228-234. |
| [4] | Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay. Nat Rev Genet, 2010, 11(9): 597-610. |
| [5] | Farazi TA, Spitzer JI, Morozov P, et al. miRNAs in human cancer. The Journal of pathology, 2011, 223(2): 102-115. |
| [6] | Guessous F, Zhang Y, Kofman A, et al. microRNA-34a is tumor suppressive in brain tumors and glioma stem cells. Cell cycle, 2010, 9(6): 1031. |
| [7] | Silber J, James CD, Hodgson JG. microRNAs in gliomas: small regulators of a big problem. Neuromolecular Med, 2009, 11(3): 208-222. |
| [8] | Novakova J, Slaby O, Vyzula R, et al. MicroRNA involvement in glioblastoma pathogenesis. Biochem Biophys Res Commun, 2009, 386(1): 1-5. |
| [9] | Garofalo M, Quintavalle C, Romano G, et al. miR221/222 in cancer: their role in tumor progression and response to therapy. Curr Mol Med, 2012, 12(1): 27-33. |
| [10] | Ye X, Bai W, Zhu H, et al. MiR-221 promotes trastuzumab-resistance and metastasis in HER2-positive breast cancers by targeting PTEN. BMB Rep, 2014. 47(5):268-273. |
| [11] | Castagnino P, Kothapalli D, Hawthorne E A, et al. miR-221/222 compensates for Skp2-mediated p27 degradation and is a primary target of cell cycle regulation by prostacyclin and cAMP. PloS One, 2013, 8(2): e56140. |
| [12] | Hao J, Zhang C, Zhang A, et al. miR-221/222 is the regulator of Cx43 expression in human glioblastoma cells. Oncol Rep, 2012, 27(5): 1504-1510. |
| [13] | Sarkar S, Dubaybo H, Ali S, et al. Down-regulation of miR-221 inhibits proliferation of pancreatic cancer cells through up-regulation of PTEN, p27kip1, p57kip2, and PUMA. Am J Cancer Res, 2013, 3(5): 465-477. |
| [14] | Ciafre SA, Galardi S, Mangiola A, et al. Extensive modulation of a set of microRNAs in primary glioblastoma. Biochem Biophysical Res Commun, 2005, 334(4): 1351-1358. |
| [15] | le Sage C, Nagel R, Egan DA, et al. Regulation of the p27Kip1 tumor suppressor by miR-221 and miR-222 promotes cancer cell proliferation. EMBO J, 2007, 26(15): 3699-3708. |
| [16] | 赵鹏,陆小明,傅震. 人脑胶质瘤中miR221和p27的表达及临床意义.江苏医药,2009,(11):1249-1251. |
| [17] | Dolcet X, Llobet D, Pallares J, et al. NF-kB in development and progression of human cancer. Virchows archiv, 2005, 446(5): 475-482. |
| [18] | Galardi S, Mercatelli N, Farace MG, et al. NF-kB and c-Jun induce the expression of the oncogenic miR-221 and miR-222 in prostate carcinoma and glioblastoma cells. Nucleic Acids Res, 2011, 39(9): 3892-3902. |
| [19] | Kedde M, van Kouwenhove M, Zwart W, et al. A Pumilio-induced RNA structure switch in p27-3 [prime]UTR controls miR-221 and miR-222 accessibility. Nat Cell Biol, 2010, 12(10): 1014-1020. |
| [20] | 张春智,康春生,浦佩玉. 反义-miR221/222上调p27Kipl抑制胶质瘤生长的研究.中华实验外科杂志,2009,(12):1744. |
| [21] | Yu J, Zhang L, Hwang PM, et al. PUMA induces the rapid apoptosis of colorectal cancer cells. Mol cell, 2001, 7(3): 673-682. |
| [22] | Zhang JX, Zhang CZ, Zhang AL, et al. MiR-221 and miR-222 target PUMA to induce cell survival in glioblastoma. Mol Cancer, 2010, 9(1): 229. |
| [23] | Lu Y, Roy S, Nuovo G, et al. Anti-microRNA-222 (anti-miR-222) and-181B suppress growth of tamoxifen-resistant xenografts in mouse by targeting TIMP3 protein and modulating mitogenic signal. J Biol Chem, 2011, 286(49): 42292-42302. |
| [24] | Destouches D, Huet E, Sader M, et al. Multivalent pseudopeptides targeting cell surface nucleoproteins inhibit cancer cell invasion through tissue inhibitor of metalloproteinases 3 (TIMP-3) release. J Biol Chem, 2012, 287(52): 43685-43693. |
| [25] | 翟博智,张春智,韩磊等.miR-221与miR-222通过靶基因TIMP3调控胶质瘤细胞侵袭能力.中华神经外科杂志,2011,27(7):701-704. |
| [26] | Mueller S, Phillips J, Onar-Thomas A, et al. PTEN promoter methylation and activation of the PI3K/Akt/mTOR pathway in pediatric gliomas and influence on clinical outcome. Neuro-oncology, 2012, 14(9): 1146-1152. |
| [27] | 谢强,黄作平,闫雍容等.miR-221调控PTEN/Akt信号介导人胶质瘤耐药细胞上皮间质转化相关基因的表达.南方医科大学学报,2014,(2):218-222. |
| [28] | Xie Q, Yan Y, Huang Z, et al. MicroRNA-221 targeting PI3-K/Akt signaling axis induces cell proliferation and BCNU resistance in human glioblastoma. Neuropathology, 2014,34(5):455-464. |
| [29] | Quintavalle C, Garofalo M, Zanca C, et al. miR-221/222 overexpession in human glioblastoma increases invasiveness by targeting the protein phosphate PTPμ. Oncogene, 2011, 31(7): 858-868. |
| [30] | Li W, Guo F, Wang P, et al. MiR-221/222 confers radioresistance in glioblastoma cells through activating Akt independent of PTEN status. Curr Mol Med, 2014, 14(1): 185-195. |
| [31] | Bhat K P L, Balasubramaniyan V, Vaillant B, et al. Mesenchymal differentiation mediated by NF-κB promotes radiation resistance in glioblastoma. Cancer cell, 2013, 24(3): 331-346. |
 2014, Vol. 41
2014, Vol. 41


