扩展功能
文章信息
- 孙飞一, 王馥丽, 庆宏, 邓玉林, 马宏
- 神经免疫相互作用对帕金森病发病机制的影响研究
- 国际神经病学神经外科学杂志, 2014, 41(6): 537-540
- Disease Surveillance, 2014, 41(6): 537-540
-
文章历史
- 收稿日期:2014-9-26
- 修回日期:2014-12-08
帕金森病(Parkinson disease,PD)是以黑质纹状体通路的退变为主要特征的神经系统变性疾病。临床表现为静止震颤、肌肉僵直、运动迟缓和姿势反射受损等典型症状,严重限制病人的活动能力,晚期并发感染,极度影响病人的生活质量,至今无有效的治疗措施,因此,开发防治帕金森病药物的研究既是重点也是难点。目前已知纹状体通路的退变与脑神经胶质细胞和免疫细胞参与有关,相关神经及免疫蛋白分子研究报道较多,但具体发病机制尚未明确,一般认为是多因素多机制协同作用的结果。 1 影响神经免疫相互作用的主要因素 1.1 α-突触核蛋白
在帕金森病发生发展过程中,α-突触核蛋白(α-synuclein,α-syn)异常表达和聚集起重要作用[1]。研究表明,在体内α-synuclein的过表达可引起主要组织相容性复合体Ⅱ(MHCII)的表达上升,促进抗原的加工提呈,增加CD4+ T细胞的增殖,增强细胞因子和趋化因子的表达[2]。同时α-synuclein基因的表达上调,可增强黑质区神经元和淋巴细胞的凋亡敏感性[3],这说明α-synuclein可能作为一种抗原引起了免疫应答。但是仅提高单体α-synuclein表达并不会引起免疫应答,实验表明免疫应答只对聚集的α-synuclein发挥作用。而且当α-synuclein与小胶质细胞作用并内化迁移至自噬小体时,单独使用α-synuclein并不能激活小胶质细胞或者引起促炎反应,必须在α-synuclein处理过的小胶质细胞中添加CD4+ T细胞,才引起很强的免疫应答,说明α-synuclein引发免疫应答过程中小胶质细胞和CD4+ T细胞的协同作用十分关键[2]。 1.2 组织相容性复合体Ⅱ
MHCII分子在α-synuclein引起的神经退行性疾病和在体内α-synuclein引起的小胶质细胞的活化及IgG抗体的沉积中起到了关键作用。HLA-DR,是MHCII的组成成分,高表达于所有的抗原递呈细胞,特别是在PD脑组织中反应性小胶质细胞表面[2]。目前在PD病人中已经观察到黑质区HLA-DR阳性的小神经胶质细胞活化、抗神经元抗体增加和脑脊液中单核细胞HLA-DR的表达量增高等相应免疫异常[4]。虽然已有研究表明MHCII参与了α-synuclein引起的免疫应答,但是MHCII提呈抗原的形式、由其介导的体液免疫应答或B细胞的活化在其中的作用不得而知[5],一般认为MHCII可能提呈的是α-synuclein或者是由α-synuclein诱导形成的蛋白[2]。 1.3 小胶质细胞
神经细胞出现衰老或退行性病变时,小胶质细胞可通过ATP、细胞因子和神经递质释放或周围环境离子变化来实现功能上可塑[6,7,8,9]。研究得出小胶质细胞是大脑损伤和衰老的传感器,可分为M1和M2两类,其中M1型的细胞分泌促炎因子(如TNF-α和IL-1β)和强力的ROS(如超氧自由基和NO),但神经营养因子的分泌减少。而M2型细胞恰恰相反,它会提高神经营养因子释放,减少促炎因子的产生,参与炎症消退反应。此外,现有研究发现不同类型小胶质细胞活化会招募不同亚群T细胞[8]。至今在MPTP模型中,究竟是小胶质细胞决定特异性T细胞的表型还是T细胞决定特异性的小胶质细胞表型未有定论[8]。不同刺激条件下,小胶质细胞被活化,该过程受神经元控制,而PD发病过程中神经元受损,控制小胶质细胞活化的功能下降,最终结果是小胶质细胞过度活化,进一步导致神经细胞恶性病变[10]。 1.4 T淋巴细胞
原始未激活的CD4+ T细胞(TH0)根据不同的刺激和APC信号可以分化成不同的亚型和由不同的细胞因子和效应器功能进行分类概括为3类:①TH1细胞:分泌IL-2、IFN-γ和TNF-α;②TH2细胞:分泌IL-4、IL-5和IL-13;③TH17细胞:分泌IL-17和IL-22等[11]。通常体内CD4+和CD8+ T细胞的数量会在一些特异性的病毒感染情况下增加,但是在慢性、多因素条件引起的神经退行性疾病中,CD4强+和CD8弱+ T细胞也出现了持续性增长[4]。目前,确凿证据表明淋巴细胞可通过血脑屏障进入到脑中[12]。PD患者尸检标本和MPTP鼠模型的脑组织样本中均检测到CD8+和CD4+的T细胞而不是B细胞的浸润。在MPTP的PD小鼠模型中,CD4+ T细胞浸润到黑质致密区,并通过Fas/FasL依赖机制介导了神经毒性作用[2]。针对CD8+和CD4+是否都对神经产生毒性作用,有研究表明,虽然在PD病人和MPTP小鼠模型中观察到CD8+ T细胞浸润强于CD4+ T细胞,但是,移除CD8+ T细胞鼠模型中MPTP的损伤并没有消失,相反缺乏Th的CD4-/-小鼠被赋予了神经保护功能,说明在神经元损伤机制中CD4+ T细胞发挥主要的毒性调节作用[5]。调节T细胞(regulatory T cell,Treg)在控制外周CD4+ T细胞的免疫应答和在生理条件下维持耐受起到至关重要的作用。研究发现,MPTP处理的小鼠模型中Treg细胞会通过抑制小神经胶质细胞的激活和减弱神经炎性应答来阻止多巴胺能神经元的退化,而且近期研究发现,Treg通过与TH17发生拮抗作用来缓解神经炎症,减轻MPTP对黑质区多巴胺能神经元的损伤[13]。此外,单光子发射计算机断层扫描(SPECT)也证实在MPTP中毒条件下发现黑质区存在Treg的浸润[14]。近年来,Treg细胞在PD疾病中的作用研究较多,主要概括为:①上调脑源性神经营养因子(brain-derived neurotrophic factor,BDNF);②下调活性氧(ROS)的产生;③下调促炎因子的表达;④上调胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF);⑤抑制效应T细胞活化并使其凋亡;⑥直接引起α-synuclein激活的小神经胶质细胞凋亡;⑦通过Fas/FasL通路或穿孔素/颗粒酶通路杀伤靶细胞。基于以上Treg细胞功能的分析,学者们对Treg细胞在PD早期和晚期可能的作用提出假设[6],即在PD早期,Treg调节适应性免疫应答,减弱小胶质细胞的活化和神经炎性反应,控制ROS以维持中枢神经系统(CNS)内环境稳定,同时限制α-synuclein的聚集,减缓疾病进程;在PD症状显现阶段,Treg调节适应性免疫应答受损,导致效应T细胞的过度活化,优先引起小胶质细胞的程序性死亡而不是分泌抗炎因子。目前,在MPTP模型中Treg细胞介导的神经保护功能尚不清楚,可能一方面通过抑制细胞毒性T细胞(如Th1和Th17),另一方面使促炎反应的M1型胶质细胞转化为抗炎反应的M2型细胞,或者是直接通过神经营养因子发挥作用[8]。 2 神经免疫相互作用调控网络
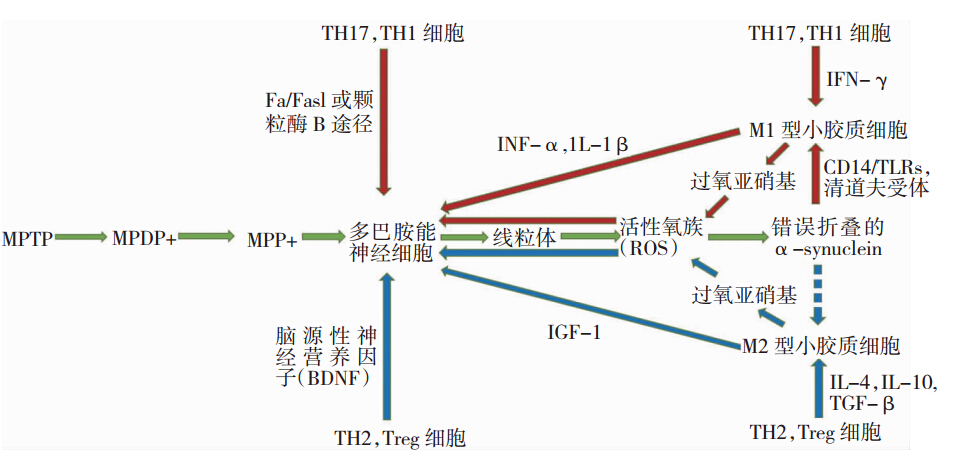
我们说神经退行性疾病是多因素多机制协同作用的结果,从以上的叙述可以看出这些细胞和分子之间并不是相互孤立而是有所联系(见图 1)。例如,在MPTP模型中(见图 1)[8],神经毒素MPTP会首先转换成MPDP+,通过非多巴胺细胞(如胶质细胞,血清素神经元)转变成MPP+,MPP+通过神经突触前多巴胺转运子集中在多巴胺能细胞中,当MPP+出现后,损伤了黑质区神经元内的线粒体而产生ROS,ROS的产生引起了α-synuclein的错误折叠,并在突触前末端通过囊泡释放出来。这种错误折叠的α-synuclein进而可能通过某个受体(可能是CD14/TLRs和清道夫受体)激活小胶质细胞,其中M1型小胶质细胞可能作用到TH1和TH17细胞,活化的TH1和TH17细胞通过IFN-γ的产生反过来使小胶质细胞保持M1型,M1型的小胶质细胞释放NO和O2,形成高反应性和毒性的过氧亚硝基,这些ROS化合物会损伤多巴胺能神经元,M1型小胶质细胞还会释放促炎症因子(如INF-α和IL-1β)放大毒性炎症反应。相反,在MPTP引起的PD免疫保护模型中,首先TH2和Treg细胞释放IL-4,IL-10和TGF-β来维持小胶质细胞处于神经保护的M2型,其次Treg细胞抑制由错误折叠的α-synuclein引起的小胶质细胞合成和释放ROS。因此,TH2和Treg细胞可能通过细胞接触机制或BDNF等神经营养因子释放作用来保护神经元,M2型的小胶质细胞会释放IGF-1和其他神经营养因子来保护黑质区神经元,同时也可能积极的作用于TH2和Treg细胞。而受损的神经元自身也存在可能引起M2型小胶质细胞出现或者释放趋化因子招募更多TH2和Treg细胞的机制。
|
| 图 1 免疫细胞、小胶质细胞与神经元之间的相互作用。绿色箭头、红色箭头和蓝色箭头分别表示MPTP、M1型小胶质细胞和M2型小胶质细胞的作用途径,虚线表示这一途径还未证实。 |
根据PD相关神经免疫相互作用的关系,很多研究者试图来寻找治疗PD的新方案。免疫学方面,首先,动物实验和临床试验证据表明[6],对免疫应答各个方面的控制可能提供大量的神经保护,这些可能的途径包括降低小胶质细胞的活化,提高神经营养因子的支持,抑制促炎症T细胞应答,提高异常蛋白的清除等;其次,采用疫苗引起的抗体或者细胞内产生的单链抗体可以直接抵抗错误折叠蛋白,使用药物(如雷帕霉素)刺激单核吞噬细胞的吞噬作用来清除异常蛋白或激活清除细胞内外聚集蛋白的溶酶体降解通路。神经学方面,首先通过探索中一系列诊断标准来判断筛查神经退行性疾病[15],之后根据建立对应疾病的动物模型,寻找能影响炎性应答,直接抑制神经毒素或者提高神经元保护功能(如胶质细胞源性神经营养因子)效果明显的药物;其次,研究者们正在努力通过免疫调节剂或者是抗氧化剂来减弱小胶质细胞活化,从而调节对聚集蛋白的免疫应答,已观察到PD发病状况既可以因为神经抗原表位特异性的效应T细胞而恶化,也可以因为T调节细胞而改善,因此,通过免疫调节剂或辅助剂的介入性治疗来激发或上调Treg细胞,通过Treg细胞来抑制持续的免疫应答,保护神经元不会进一步退化是一个新的治疗方向。
| [1] | Liu YY, Qiang M, Wei Y, et al. A novel molecular mechanism for nitrated a-synuclein-induced cell death. J Mol Cell Biol, 2011, 6(7): 1-11. |
| [2] | Harms AS, Cao SW, Rowse AL, et al. MHCII is required for α-synuclein-induced activation of microglia, CD4 T cell proliferation, and dopaminergic neurodegeneration. J Neurosci, 2013, 33(23): 9592-9600. |
| [3] | Calopaa M, Bas J, Callén A, et al. Apoptosis of peripheral blood lymphocytes in Parkinson patients. Neurobiol Dis, 2010, 38: 1-7. |
| [4] | Hisanaga K, Asagi M, Itoyama Y, et al. Increase in peripheral CD4bright+ CD8 dull+ T cells in Parkinson disease. Arch Neurol, 2001, 58: 1580-1583. |
| [5] | Brochard V, Combadière B, Prigent A, et al. Infiltration of CD4+ lymphocytes into the brain contributes to neurodegeneration in a mouse model of Parkinson disease. J Clin Investig, 2009, 25(3): 182-192. |
| [6] | Stone DK, Reynolds AD, Mosley RL, et al. Innate and adaptive immunity for the pathobiology of Parkinson’s disease. Antioxid Redox Signal, 2009, 11(9): 2151-2166. |
| [7] | Huang XY, Reynolds AD, Mosley RL, et al. CD 4+ T cells in the pathobiology of neurodegenerative disorders. J Neuroimmunol, 2009, 211: 3-15. |
| [8] | Appel SH, Beers DR, Henkel JS. T cell-microglial dialogue in Parkinson’s disease and amyotrophic lateral sclerosis: are we listening? Trends Immunol, 2009, 31(1): 7-17. |
| [9] | Hanisch UK, Kettenmann H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nat Neurosci, 2007, 10(11): 1387-1394. |
| [10] | Lucin KM, Wyss-Coray T. Immune activation in brain aging and neurodegeneration: too much or too little? Neuron, 2009, 15(10): 110-122. |
| [11] | Korn T, Bettelli E, Oukka M, et al. IL-17 and Th17 cells. Ann Rev Immunol, 2009, 27: 485-517. |
| [12] | Wilson EH, Weninger W, Hunter CA. Trafficking of immune cells in the central nervous system. J Clini Investig, 2010, 120(5): 1368-1379. |
| [13] | 毕涌,洪娟,李佳.调节性T细胞缓解帕金森病中多巴胺神经元炎性损伤.国际神经病学神经外科学杂志, 2013, 40(4): 341-345. |
| [14] | Chung ES, Kim H, Lee G, et al. Neuro-protective effects of bee venom by suppression of neuroinflammatory responses in a mouse model of Parkinson’s disease: Role of regulatory T cells. Brain Behav Immun, 2012, 26: 1322-1330. |
| [15] | 王立安,庞爱兰,张林明,等.蒙特利尔认知评估量表和简易精神状态量表在帕金森病轻度认知功能障碍筛查中的应用.国际神经病学神经外科学杂志, 2014, 41(1): 16-19. |
 2014, Vol. 41
2014, Vol. 41


