扩展功能
文章信息
- 陶超, 徐佳, 程刚, 耿晓增, 陈云祥
- TAO Chao, XU Jia, CHENG Gang, GENG Xiao-Zeng, CHEN Yun-Xiang
- 中枢神经细胞瘤18例诊断与治疗回顾性分析
- Diagnosis and treatment of central neurocytoma: a retrospective analysis of 18 cases
- 国际神经病学神经外科学杂志, 2014, 41(6): 517-521
- Disease Surveillance, 2014, 41(6): 517-521
-
文章历史
- 收稿日期:2014-07-04
- 修回日期:2014-10-11
中枢神经细胞瘤(Central Neurocytoma)是一种少见的颅内原发肿瘤,在全部颅内原发肿瘤中所占比例约0.1%~0.5%。[1, 2, 3, 4]南京医科大学第一附属医院神经外科2006年6月至2013年4月共手术治疗并经病理确诊中枢神经细胞瘤18例,占科室同期全部颅内原发肿瘤的0.37%。现总结本组资料的临床、影像、病理及手术治疗特点报道如下。 1 资料与方法 1.1 一般资料
本组18例中,男性13例,女性5例。年龄9~57岁,平均年龄31.72±14.30岁。病程10天~1年,平均2.86±3.49个月。主诉头痛、头晕15例,恶心、呕吐6例,肌力下降3例,视物模糊2例,耳鸣2例,有1例患者无明显不适,系外伤后头颅CT检查偶然发现。有2例患者因病情进展,分别在入院当天和手术前一天出现意识障碍。 1.2 影像学检查
术前均行头颅MRI检查,(见图 1,图 2,图 3)。肿瘤位于第四脑室者2例,位于侧脑室者16例。位于侧脑室内的肿瘤基底均在透明隔、室间孔周围,肿瘤可累及第三脑室,挤压透明隔至对侧侧脑室,通常仍可分辨被挤压移位的透明隔。肿瘤主体在侧脑室前中部的13例(左侧7例,右侧6例),完全位于侧脑室后角的3例(均在右侧)。T1WI呈略低至等信号,T2WI呈等至略高信号,肿瘤信号不均匀,增强扫描时肿瘤实质部分有不同程度的强化。肿瘤表面可呈不同程度的分叶状,基底部界限不清,周围水肿不明显。18例中有14例见不同程度的囊性变,有的肿瘤内可见许多小囊,呈“丝瓜瓤”样改变。有7例曾行头颅CT检查,其中2例见不同程度的钙化,1例见肿瘤内出血。肿瘤最大直径3~6.5 cm,平均4.2 cm。18例中有13例伴有不同程度的脑室系统扩张。
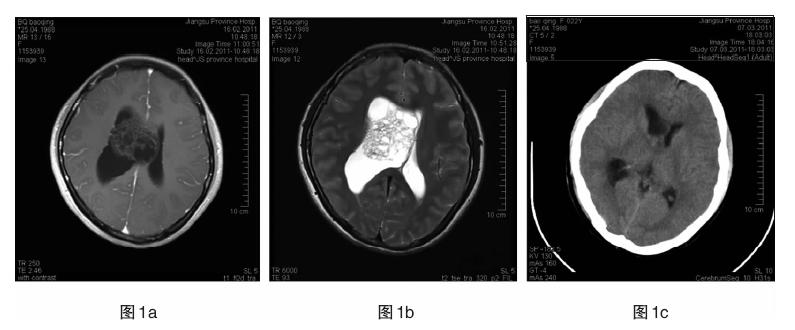 |
| 图 1a 患者1,女,22岁。右侧侧脑室内中枢神经细胞瘤,T1WI增强扫描肿瘤内可见许多小囊,呈“丝瓜瓤”样改变。图 1b T2WI可见被推挤移位的透明隔,脑室扩张。图 1c 术后复查。 |
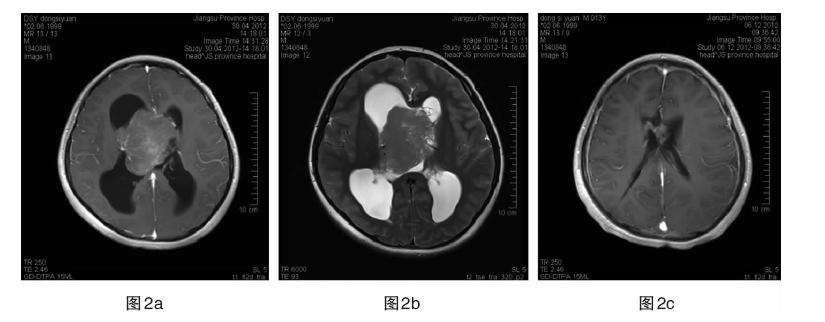 |
| 图 2a 患者2,男,12岁。右侧侧脑室中枢神经细胞瘤,T1WI增强扫描。图 2b T2WI。图 2c 术后复查,T1WI增强扫描。该患者术中次全切除肿瘤,术后放疗,随访两年未见残余肿瘤继续生长。 |
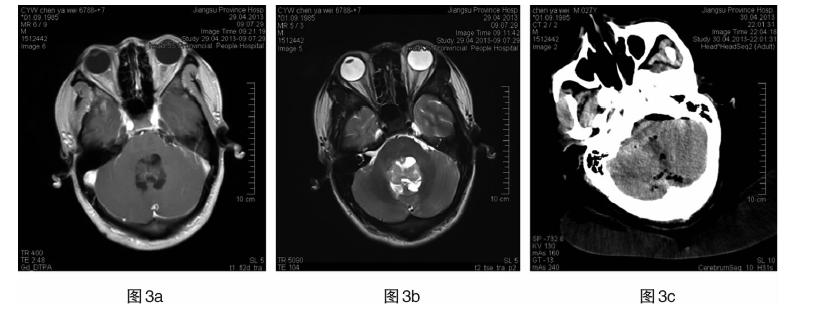 |
| 图 3a 患者3,男,27岁。第四脑室内中枢神经细胞瘤,T1WI增强扫描。图 3b T2WI可见肿瘤内有多个小囊。图 3c 术后复查。 |
术中见肿瘤组织实质部分质地较软,伴有钙化者质地硬,基底部界限不清,需在显微镜下由术者主观判断肿瘤边界。2例位于第四脑室内的肿瘤采用枕下正中入路经小脑蚓部进入第四脑室,术中见肿瘤基底位于小脑蚓部及其两侧的小脑半球,第四脑室底均未受侵犯,在切开小脑蚓部见到肿瘤后,向两侧沿肿瘤与小脑半球间的胶质增生带分离肿瘤,同时阻断其基底血供,将肿瘤分块切除或吸除。肿瘤切除后探查确认脑脊液通路通畅。13例位于侧脑室前中部者,有5例经纵裂-胼胝体-侧脑室入路,8例经额叶皮层-侧脑室入路。3例位于侧脑室后角者经颞枕叶皮层-侧脑室入路。此16例位于侧脑室的肿瘤,术中见基底均在中线部位、室间孔周围,部分累及第三脑室,肿瘤可向对侧推挤透明隔,但均未突破透明隔直接长入对侧侧脑室,予以分块切除或吸除,基底部阻断肿瘤血供。长入第三脑室内的肿瘤阻断血供后予以清除。在分块切除肿瘤时,有3例可见瘤内有部分砂粒样质硬成份,考虑为钙化。 2 结果
13例肿瘤全切,5例次全切。1例患者术前即有严重脑积水,先行侧脑室外引流后手术次全切肿瘤,术后1个月行侧脑室-腹腔分流。1例患者术后4个月出现脑积水,遂行侧脑室-腹腔分流。3例患者术后发生颅内感染,经抗感染治疗治愈。2例患者术后肌力下降,术后1个月均基本恢复。术后常规病理检查,可见肿瘤细胞呈巢状分布,细胞大小较一致,呈圆形或卵圆形,常可见核周空晕(见图 4)。细胞巢间可有散在分布的无细胞区,形成“神经毡”样结构,有时可见分枝状的毛细血管(见图 5)。常规病理检查有时需与少突胶质细胞瘤和室管膜瘤等鉴别。15例行免疫组化检查。免疫组化结果见表 1。Ki-67检查10例,9例在10%以下,1例为20%,该患者常规病理检查诊断为“非典型”中枢神经细胞瘤。1例病变位于侧脑室内的患者,经纵裂-胼胝体-侧脑室入路手术,术后昏迷、严重脑水肿,术后第2天死亡。1例患者诊断为“非典型”中枢神经细胞瘤,次全切后放疗,术后4个月肿瘤进一步生长,并出现脑积水、脑肿胀,家属放弃治疗。1例患者失访。其余15例患者随访14~96个月。15例随访患者中11例肿瘤全切。4例次全切。全切的有5例术后放疗,次全切的4例全部术后放疗,随访期间均未见肿瘤复发或残余肿瘤进一步生长。
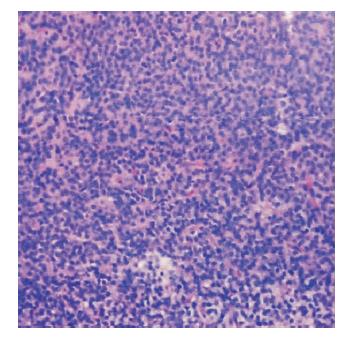 |
| 图 4 肿瘤细胞大小较一致,呈圆形或卵圆形常可见核周空晕。 |
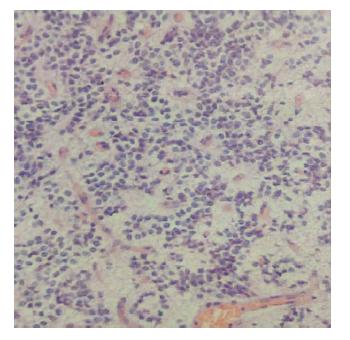 |
| 图 5 肿瘤细胞巢间有无细胞 区,形成“神经毡”样结构。 |
| 患者 | Syn | CgA | Neu-N | NF | GFAP | Olig-2 | S100 | EMA | cd56 | NSE | Ki-67 |
| 1 | + | - | + | - | ± | + | ++ | - | 10%以下 | ||
| 2 | ++ | ++ | - | ± | - | ||||||
| 3 | + | +++ | - | - | 5% | ||||||
| 4 | ++ | + | - | - | ++ | 2% | |||||
| 5 | ++ | - | + | - | - | + | - | ++ | 10% | ||
| 6 | + | - | - | - | - | + | + | - | + | 20% | |
| 7 | + | + | - | ± | + | - | + | 2%以下 | |||
| 8 | + | - | + | + | ± | - | 5%-10% | ||||
| 9 | ++ | - | ++ | - | + | ++ | ++ | 5% | |||
| 10 | + | - | + | - | - | + | - | - | + | ||
| 11 | + | - | - | + | + | + | 5% | ||||
| 12 | + | + | ± | - | - | 2%-5% | |||||
| 13 | + | + | - | + | |||||||
| 14 | + | - | ± | + | + | ||||||
| 15 | + | - | + | - | + | ||||||
| 阳性 | 15/15 | 0/8 | 11/13 | 0/5 | 2/15 | 4/8 | 7/10 | 0/8 | 6/6 | 5/5 |
有关中枢神经细胞瘤的现有文献多数是病例报道和回顾性分析,所以尚无十分明确的最佳治疗策略。考虑到该病的发病率很低,且随访需要较长时间,很难在单个中心进行大样本前瞻性随机对照研究[4]。但本病经综合治疗后似乎总体预后较好,5年生存率较高,可达90%以上[5, 6]。
MRI检查有一定特点,中枢神经细胞瘤多数位于侧脑室,且大多在侧脑室前中部,位于后角者少见,还有小部分可生长于第四脑室。位于侧脑室内的肿瘤可挤压透明隔至对侧侧脑室,通常仍可分辨被挤压移位的透明隔,特别是T2WI上更明显,据此可以判断肿瘤起源于哪一侧侧脑室,本组病例中的分类即以此为依据。近来发现中枢神经细胞瘤的MRS有特征表现,胆碱峰升高,肌酸和NAA峰下降。[7, 8]病理上特别需要与少突胶质细胞瘤鉴别,本组中有2例常规病理报告未排除少突胶质细胞瘤,待免疫组化检查后方确认。常规病理检查可以对肿瘤做出“非典型”诊断,但是随访观察发现,是否诊断为“非典型”与预后无直接相关性[9, 10]。
本组15例行免疫组化检查,Syn弥漫而强阳性,NSE、Neu-N、S100大多阳性,GFAP仅少数病例阳性(见表 1)。中枢神经细胞瘤的起源有争议,体外实验显示了瘤细胞从表达Syn向GFAP过渡的过程,说明中枢神经细胞瘤可能起源于脑室周围的双向潜能祖细胞,而不是来自神经元细胞[11]。以往认为MIB-1 LI大于2%提示复发可能大[12]。而最近的研究认为肿瘤复发率、总的生存率与MIB-1 LI无明显关系[6, 13]。笔者认为MIB-1 LI在判断中枢神经细胞瘤侵袭性上的价值,需要大样本的随访数据来确定,现在不宜轻易肯定或否定。术后病理在判断肿瘤复发的可能性上,目前尚缺乏确切可靠的手段和指标。
以往的经验和随访资料表明,手术是治疗中枢神经细胞瘤的最佳选择。Alexandre等[9]对多中心71例中枢神经细胞瘤病例进行回顾分析认为,手术切除程度是预后唯一相关因素。Kim等[6] 58例中枢神经细胞瘤,单纯手术(34例)、手术后普通放射治疗(7例)或伽玛刀治疗(7例)、活检后单纯伽玛刀治疗(10例),四种治疗方案总生存率和复发率没有显著差异。但该组资料中单纯手术的34例患者大多是实现了全切或近全切的,次全切除的患者手术后多数均接受了普通放疗或伽玛刀治疗,且未能全切的患者,术后放疗比不放疗的患者复发率低。
手术入路的选择主要取决于肿瘤的具体部位和术者熟悉哪种入路。第四脑室内的肿瘤,通常采用枕下正中入路。侧脑室内的肿瘤,可以经皮层或经胼胝体。Kim等[6]比较经皮层和经胼胝体两种入路,发现肿瘤切除率无差异,术后癫痫的发生率经皮层组明显高于经胼胝体组。其他术后并发症和各种功能障碍(如肌力减退、意识障碍、失语、记忆力减退等),术后数日内经胼胝体组略高于经皮层组,但长期随访两组无差异,Karnofsky评分也无差异。Lubrano等[5]回顾分析的82例中枢神经细胞瘤术后并发症的发生率为66%,主要有肢体麻痹和/或失语(39%),记忆力下降(29%)和脑积水(26%)。术后出现的并发症和神经功能障碍大多不是永久的,多数在一个月后可以恢复。在最后一次随访,Karnofsky评分为至少等于80的患者达90.6%。
笔者的手术体会:①经皮层入路者常规额角或枕角穿刺,再沿穿刺道进入脑室内。②侧脑室内的肿瘤多数由脉络膜动脉或大脑中动脉的分支供血。③侧脑室内肿瘤术中要保护好大脑内静脉、丘纹静脉、丘脑、穹窿。第四脑室内肿瘤要注意避免损伤第四脑室底。④经胼胝体入路要保护好胼周动脉、胼缘动脉和矢状窦旁的静脉。⑤手术的关键在于处理基底,理论上讲基底阻断后肿瘤实际已经游离下来,但是因为肿瘤通常巨大,实际手术时仍应分块切除。⑥术中注意止血,保持术野清晰干净,术后仔细冲洗脑室,避免脑室内积血造成迟发性的脑积水。⑦切除肿瘤要把握“度”,要尽量避免术后造成患者严重的功能障碍。⑧肿瘤严重钙化、基底粘连紧密、侵犯丘脑等重要结构、与重要血管粘连紧密的,不要强求全切。⑨术毕要检查脑脊液循环通路是否通畅,可常规行透明隔造瘘,可烧灼脉络膜丛,经额入路可行终板造瘘。必要时需放置脑室外引流管或术前先解决脑积水问题。
中枢神经细胞瘤术后是否放疗仍有争议。Kim等[6]报道的58例中枢神经细胞瘤,实现了全切或近全切的大都不放疗,次全切除的患者多数放疗,实现了相近的远期生存率和复发率。Rades等[14]回顾性分析认为对于实现肿瘤全切的患者,放疗并不提高生存率和肿瘤局部控制率。最近的研究认为,伽玛刀治疗可以作为手术后的一种安全有效的辅助治疗,或者活检明确病理后单独采用,可使肿瘤获得长期控制。Kim等[6]对小的无症状的中枢神经细胞瘤只进行伽玛刀治疗,效果良好。Chen 等[15]对14例经病理活检确诊的中枢神经细胞瘤患者采用伽玛刀治疗,肿瘤平均体积为19.6 cm3(3.5 cm3~48.9 cm3),平均随访时间70个月。发现所有患者肿瘤体积均缩小,在最后一次MRI复查中,肿瘤体积平均减少69%(47%~87%),无肿瘤进展,所有患者的Karnofsky评分均未降低或有所增加,神经功能无恶化。
分析现有的文献资料并结合我们的经验,总结中枢神经细胞瘤的治疗策略:首选手术治疗。应尽量争取全切肿瘤,但是必须在避免重要血管和脑组织严重损伤的前提下进行,全切有困难的,允许残留。治疗应着眼于患者的生活质量,以及对肿瘤的控制[4]。手术要尽量保持脑脊液循环通畅。实现全切的患者可不放疗,但要定期随访。未能全切的患者术后应放疗,能够使残余肿瘤缩小并长期控制,可获得基本相同的总生存率。复发的患者可二次手术或放疗。MIB-1 LI和Ki-67提示高增殖性的肿瘤仍可建议术后放疗。放疗可采用伽玛刀。肿瘤小且患者不愿手术的,活检后也可仅行伽玛刀治疗。
| [1] | Niiro T, Tokimura H, Hanaya R, et al. MRI findings in patients with central neurocytomas with special reference to differential diagnosis from other ventricular tumours near the foramen of Monro. J Clin Neurosci,2012,19(5):681-686. |
| [2] | Sharma MC, Deb P, Sharma S, et al. Neurocytoma: a comprehensive review. Neurosurg Rev,2006,29(4):270-285. |
| [3] | Leenstra JL, Rodriguez FJ, Frechette CM, et al. Central neurocytoma: management recommendations based on a 35-year experience. Int J Radiat Oncol Biol Phys,2007,67(4):1145-1154. |
| [4] | Choudhari KA, Kaliaperumal C, Jain A, et al. Central neurocytoma: a multi-disciplinary review. Br J Neurosurg, 2009,23(6):585-595. |
| [5] | Lubrano V, François P, Loundou A,et al. Outcomes after surgery for central neurocytoma: results of a French multicentre retrospective study. Acta Neurochir (Wien), 2013,155(7):1261-12699. |
| [6] | Kim JW, Kim DG, Kim IK,et al.Central neurocytoma: long-term outcomes of multimodal treatments and management strategies based on 30 years' experience in a single institute. Neurosurgery, 2013,72(3):407-413. |
| [7] | Kim DG, Choe WJ, Chang KH et al. In vivo proton magnetic resonance spectroscopy of central neurocytomas. Neurosurgery,2000,46(2): 329-333. |
| [8] | Jayasundar R, Shah T, Vaishya S et al. In vivo and in vitro MR spectroscopic profile of central neurocytomas. J Magn Reson Imaging,2003,17(2): 256-260. |
| [9] | Vasiljevic A, Francois P,Loundou A, et al. Prognostic factors in central neurocytomas: a multicenter study of 71 cases.Am J Surg Pathol, 2012,36(2):220-227. |
| [10] | Meic HS,Gottfried ON,Von Koch CS, et al.Central neurocytoma:a review.J Neurooncol,2004, 66(3):377-384. |
| [11] | Daniel JB,Bernd WS,Charles GE,et al.Extraventricular neurocytoma pathologic features and clinical outcome.Am J Surg Pathol,2002,25(10):1252-1260. |
| [12] | Söylemezoglu F, Scheithauer BW, Esteve J, et al.Atypical central neurocytoma. J Neuropathol Exp Neurol,1997,56(5): 551-556. |
| [13] | Rades D, Schild SE, Fehlauer F. Prognostic value of the MIB-1 labeling index for central neurocytomas. Neurology,2004,62(6):987-989. |
| [14] | Rades D,Fehlauer F.Treatment options for central neurocytoma.Neurology,2002,59(8):1268-1270. |
| [15] | Chen MC, Pan DH, Chung WY, et al.Gamma knife radiosurgery for central neurocytoma: retrospective analysis of fourteen cases with a median follow-up period of sixty-five months. Stereotact Funct Neurosurg,2011,89(3):185-193. |
 2014, Vol. 41
2014, Vol. 41

