扩展功能
文章信息
- 王倩, 宋治, 胡中扬, 杨锡荣, 邱玲玲
- WANG Qian, SONG Zhi, HU Zhong-Yang, YANG Xi-Rong, QIU Ling-Ling
- 凝血因子Ⅱ、Ⅴ基因多态性与脑梗死的关联研究
- Relationship between gene polymorphisms of blood coagulation factors (II and V) and cerebral infarction
- 国际神经病学神经外科学杂志, 2014, 41(5): 407-411
- Disease Surveillance, 2014, 41(5): 407-411
-
文章历史
- 收稿日期:2014-07-31
- 修回日期:2014-09-09
2. 中南大学湘雅三医院神经内科, 湖南省长沙市 410013
脑梗死(cerebral infarction,CI)是神经科常见疾病。据世界卫生组织统计数据,卒中的发病率和患病率分别为90/10万人和307/10万人,尤以东太平洋、欧洲、东南亚发病率居高[1],其中85%的卒中为缺血性卒中。脑梗死的最常见类型为脑血栓形成,而凝血与抗凝系统失平衡为血栓形成的重要环节。目前对于是否存在凝血因子基因突变导致体内凝血因子的异常表达与代谢改变成为人们关注的焦点。鉴于凝血因子Ⅱ(blood coagulation factor Ⅱ,FⅡ)和凝血因子Ⅴ(blood coagulation factor Ⅴ,FⅤ)是凝血途径中的重要因子,FⅡ基因rs1799963和FⅤ基因rs6025位点多态性可能参与血栓形成,与传统的心脑血管危险因素相互作用,导致临床脑血管疾病的发生[2],因此有必要对其与脑梗死的关系进行探讨。
1 材料与方法 1.1 研究对象 1.1.1 病例组收集从2011年6月1日到2012年7月31日就诊于中南大学湘雅三医院神经内科,并住院被确诊为脑梗死的汉族患者共351例,男性217例,女性134例,年龄36~85岁。所有病例均完善头颅CT和/或头颅MRI等影像学检查,符合第四届全国脑血管病学术会议修订的脑梗死诊断标准。排除以下疾病:由动脉炎、外伤、血液病、肿瘤、药物、脑血管畸形或动脉瘤引起的脑梗死;脑梗死合并出血;严重肝肾功能损害、血液病、自身免疫性疾病、合并甲状腺疾病、妊娠妇女。 1.1.2 对照组
收集2011年6月1日至2012年7月31日在中南大学湘雅三医院健康管理中心体检的汉族人员,共有417例,其中男性234例,女性183例,年龄37~83岁。除外脑血管疾病、有脑血管疾病家族史者、肝、肾功能损害、血液系统疾病、自身免疫性疾病、甲状腺疾患、妊娠妇女。 1.2 实验方法
两组患者均常规禁食12 h后于次日清晨7时至8时抽取患者外周静脉血2 ml置于EDTA-K抗凝管,保存在-20摄氏度冰箱中。用北京鼎国昌盛生物技术公司DNA试剂盒提取DNA。采用PCR及飞行时间质谱技术对FⅡ基因rs1799963位点、FⅤ基因rs6025位点进行基因分型。具体方法如下:FⅡ基因rs1799963位点PCR引物序列:上游引物5’-ACGTTGGATGTGGTTCCCAATAAAAGTGAC-3’,下游引物5’- ACGTTGGATGAGAGAGCTGCCCATGAATAG-3’;FⅤ基因rs6025位点PCR引物序列:上游引物5’- ACGTTGGATGCTCTGGGCTAATAGGACTAC-3’,下游引物5’-ACGTTGGATGCTTCAAGGACAAAATACCTG -3’。PCR反应体系组成:10x PCR缓冲液0.5 μl,25 mmol/L MgCl2 0.4 μl,dNTP 0.1 μl,上下游引物1 μl,5 U/μl Taq酶0.2 μl,DNA模板1 μl,HPLC级超纯水1.8 μl,总体积5 μl。PCR扩增反应程序:先在94℃变性15 min,然后94℃ 20 s,56℃ 30 s,72℃ 1 min,45个循环,最后72℃延伸3 min。在1%琼脂糖凝胶在电泳。选取结果良好的样本继续进行SAP及延伸反应。SAP相关反应试剂配置:SAP Buffer 0.17 μl,生化分析级超纯水1.53 μl,PCR产物5 μl,1.7 U/μl SAP酶0.3 μl,总体积7μl。SAP反应程序:37℃ 40 min→85℃ 5 min→4℃ ∞。延伸相关反应试剂配置:iPLEX缓冲液0.2 μl,生化分析级超纯水0.619 μl,iPLEX引物Mix 0.94 μl,iPLEX mix 0.2 μl,SAP+PCR reaction 7 μl,iPLEX酶0.041 μl,总体积9 μl。延伸反应程序如下图 1。然后进行树脂纯化、建板点样,导入Mass ARRAY系统上机检测,收集数据。
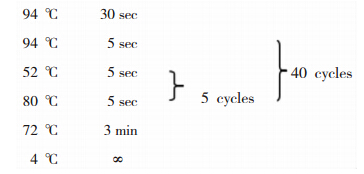 |
| 图 1 延伸反应程序条件 |
所有试验数据采用SPSS 18.0统计软件进行统计分析。对病例组与对照组一般临床资料进行对比研究采用t检验及χ2检验。采用SHE sis分析软件进行Hardy-Weinberg平衡检验。对于各位点单核苷酸多态性(Single nucleotide polymorphism,SNP)的基因型及等位基因频率的分布情况进行χ2检验。对于所筛选的SNPs与脑梗死的关联使用logistic回归模型进行分析,对脑梗死相关危险因素进行校正。 2 结果 2.1 研究对象的一般特征的比较
本研究共纳入768名患者,病例组351人,平均年龄为(63.09±10.7)岁,对照组417人,平均年龄为(61.87±10.1)岁。病例组与对照组在年龄、性别上差异无统计学意义(P>0.05)。 2.2 各SNPs的质谱特征基因型峰图 2.2.1 rs1799963质谱特征基因型峰图
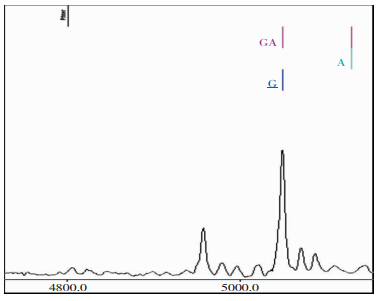 |
| 图 2 FⅡ基因rs1799963位点G/G基因型 |
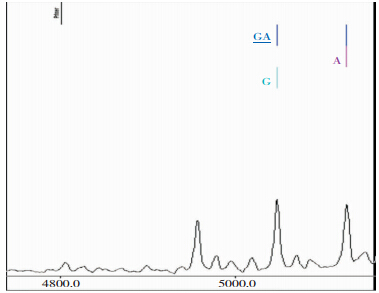 |
| 图 3 FⅡ基因rs1799963位点G/A基因型 |
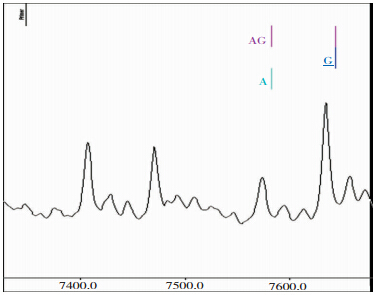 |
| 图 4 FⅤ基因rs6025位点G/G基因型 |
病例组基因型均为G/G,对照组中基因型为G/G和A/G,见表 1。经过Hardy-Weinberg遗传平衡检测,病例组与对照组基因型及等位基因频率达到遗传平衡(P>0.05),所选群体具有代表性。经过校正,脑梗死组的基因型分布与对照组相比差异无统计学意义(P>0.05),脑梗死组的等位基因频率与对照组相比差异无统计学意义(P>0.05)。
| 组别 | 例数 | 基因型(例数%) | 等位基因频率(例数%) | |||
| A/A | A/G | G/G | A(freq) | G(freq) | ||
| 病例组 | 351 | 0 | 0 | 351 | 0 | 1 |
| 对照组 | 417 | 0 | 3 | 409 | 0.004 | 0.996 |
病例组与对照组FⅤ rs6025位点的基因型均为G/G,未见其他类型的基因型。 2.5 SNPs位点多态性分布与脑梗死的logistic回归模型
对脑梗死相关危险因素进行变量变换,有关变量的转换(见表 2)。进行logistic回归,分析如下:体重指数、甘油三酯、低密度脂蛋白、高血压、冠心病与脑梗死差异有统计学意义(P>0.05)。总胆固醇、高密度脂蛋白、糖尿病、FⅡ基因rs1799963位点多态性与脑梗死差异无统计学意义(P>0.05),见表 3。
| 变量 | 暴露(1) | 非暴露(0) |
| 体重指数(kg/m2) | >=25 | <25 |
| 空腹血糖(mmol/L) | >=7.0 | <7.0 |
| 甘油三脂(mmol/L) | >=1.7 | <1.7 |
| 血胆固醇(mmol/L) | >5.7 | <=5.7 |
| 低密度脂蛋白(mmol/L) | >=3.2 | <3.2 |
| 高密度脂蛋白(mmol/L) | <1.16 | >=1.16 |
| 收缩压(mmHg) | >=140 | <140 |
| 舒张压(mmHg) | >=90 | <90 |
| 冠心病史 | 有 | 无 |
| 糖尿病史 | 有 | 无 |
| rs1799963 | G/A+A/A | G/G |
| 变量 | P值 | OR值 | OR值的95%可信区间 |
| 体重指数(kg/m2) | 0.011 | 0.602 | (0.407,0.890) |
| 甘油三脂(mmol/L) | 0.047 | 1.442 | (1.005,2.069) |
| 血胆固醇(mmol/L) | 0.055 | 0.561 | (0.311,1.013) |
| 低密度脂蛋白(mmol/L) | 0.002 | 2.191 | (1.338,3.585) |
| 高密度脂蛋白(mmol/L) | 0.769 | 1.055 | (0.738,1.508) |
| 高血压 | 0.000 | 4.228 | (2.996,5.967) |
| 糖尿病 | 0.090 | 1.387 | (0.951,2.023) |
| 冠心病 | 0.000 | 2.795 | (1.679,4.654) |
| rs1799963 | 0.999 | 0.000 | 0.000 |
凝血因子Ⅱ,又称为凝血酶原,是凝血途径中的关键因子,在凝血因子Ⅴa、Ca2+、Ⅹa等作用下,形成有活性的凝血酶,水解纤维蛋白原,参与血凝块的形成。FⅡ基因定位于11号染色体,长度约为21 kb,包括5’与3’非编码区、14个外显子及13个内含子。FⅡ基因3’非编码区的20210位核苷酸由G→A的错义突变,可使其翻译合成的凝血酶原水平增加,导致血浆中凝血酶增多,增加了血栓形成的风险。国外学者对FⅡ基因rs1799963位点多态性与血栓性疾病的关系做了研究。Weischer等[3]发现,FⅡ基因rs1799963G/A杂合子对比非携带者,增加1.5倍缺血性心血管疾病风险(95% CI: 1.1-2.1)。鉴于心脑血管疾病有着相似的发病机制和危险因素,FⅡ基因rs1799963位点可能为脑梗死重要的候选基因位点。国外学者对FⅡ基因rs1799963位点多态性与脑梗死之间的关联进行研究。They-They等[4]实验发现凝血酶基因突变与脑梗死之间无显著关联,对危险因素进行校正后,发现FⅡ基因rs1799963位点多态性与大动脉型脑梗死之间有相关性。Favaretto等[5]研究发现FⅡ基因rs1799963位点多态性可能与不明原因卒中有相关性。FⅡ基因rs1799963位点多态性引发的血液高凝状态可能对脑梗死的发病与发展起推动作用。本实验发现仅对照组有3例为G/A基因型,其余均为G/G基因型,考虑原因可能与FⅡ基因rs1799963 G到A的突变率较低有关。文献报道,FⅡ基因rs1799963 G到A突变在不同人种中的发生频率不同,北欧为1.7%,南欧为4%,而在非白人人群中少见[5]。我国学者也做了一些研究,孟强等[6]对40例青年脑梗死与38例对照组研究,受检人群中并未发现rs1799963位点突变类型。考虑FⅡ基因rs1799963 G到A突变可能在我国发生率较低,中国湖南长沙地区脑梗死发病的遗传学原因与欧美等国家可能因种族、地域的不同存在差异,这需要扩大样本量进一步分析。目前国外研究发现FⅡ基因rs1799963位点多态性与青年脑梗死[7]可能相关,本实验40岁以下的青年卒中患者仅占总研究人数的2.1%。虽然本次研究未发现FⅡ基因rs1799963位点多态性与脑梗死的关联性,但为今后的研究指出了方向,可以进一步扩大样本量、进行多中心的临床研究,对不同种族各个年龄阶段人群分亚组进行研究,重点观察FⅡ基因rs1799963位点多态性与中青年脑梗死的关系。
凝血因子Ⅴ,又称为前加速素,其基因定位于染色体1q23,长约80kb,包含25个外显子和24个内含子。FⅤ基因rs6025 G到A突变是在其基因10号外显子1691位核苷酸碱基G突变为A,导致506裂解位点相应氨基酸的改变,无法与活化蛋白C(activated protein C,APC)结合,导致血液的高凝状态。FⅤ基因rs6025位点G→A突变是引起APC抵抗最常见的遗传性原因,约90%到95%携带杂合子类型的病例都合并有APC抵抗[8]。而APC抵抗为血栓性疾病的主要危险因素之一。国外学者对FⅤ基因rs6025位点多态性与血栓形成的相关性做了研究。Kita等[9]制作脑梗死动物模型,发现在局灶性脑缺血再灌注后,与FⅤ野生型对比,FⅤ基因rs6025位点杂合子和纯合子基因型都表现出更大的脑梗死体积及较低的生存率。由此推测FⅤ基因rs6025位点多态性可能与脑梗死相关,可能参与脑梗死的发生与发展。国内外学者针对FⅤ基因rs6025位点多态性与脑梗死之间的关系做了大量实验,目前研究发现FⅤ基因rs6025位点多态性与儿童脑梗死的发病可能相关。Coen Herak等[10]研究发现,FⅤ基因rs6025位点G/A杂合子基因型在小儿中与急性脑梗死和TIA显著关联,增加了7倍患病风险,对围生期急性脑梗死增加11倍风险。而FⅤ基因rs6025位点在我国人群中突变率较低,在一定程度上限制探讨其与脑梗死的相关性。本实验所有受检对象中均为G/G基因型,提示在不同遗传背景下FⅤ基因rs6025位点G到A的突变发生率不同。考虑在中国长沙汉族人群中FⅤ基因rs6025位点可能不存在多态。推测不同种族其遗传背景存在差异,脑梗死的遗传学病因可能也存在差异。今后的研究可以选取FⅤ基因其他SNPs标签进行遗传学研究。
| [1] | Kisialiou A,.Grella R,. Carrizzo A, et al. Risk factors and acute ischemic stroke subtypes. J Neurol Sci, 2014,339(1-2):41-46. |
| [2] | Sartori M, Favaretto E, Legnani C, et al. G20210A prothrombin mutation and critical limb ischaemia in patients with peripheral arterial disease. Eur J Vasc Endovasc Surg, 2009, 38(1): 113-117. |
| [3] | Weischer M, Juul K, Zacho J, et al. Prothrombin and risk of venous thromboembolism, ischemic heart disease and ischemic cerebrovascular disease in the general population. Atherosclerosis, 2010, 208(2): 480-483. |
| [4] | They-They TP, Battas O,Slassi I, et al. Prothrombin G20210A and factor V Leiden polymorphisms in stroke. J Mol Neurosci, 2012, 46(1): 210-216. |
| [5] | Favaretto E, Sartori M, Conti E, et al. G1691A factor V and G20210A FII mutations, acute ischemic stroke of unknown cause, and patent foramen ovale. Thromb Res, 2012, 130(5): 720-724. |
| [6] | 孟强,蒲传强.青年脑梗死与凝血酶原G20210A突变关系的研究.临床神经病学杂志, 2003, 16(3): 131-133. |
| [7] | Aznar J, Mira Y, Vaya A, et al. Factor V Leiden and prothrombin G20210A mutations in young adults with cryptogenic ischemic stroke. Thromb Haemost, 2004, 91(5): 1031-1034. |
| [8] | Shaheen K, Alraies MC, Alraiyes AH, et al. Factor V Leiden: how great is the risk of venous thromboembolism? Cleve Clin J Med, 2012, 79(4): 265-272. |
| [9] | Kita T, Banno F, Yanamoto H, et al. Large infarct and high mortality by cerebral ischemia in mice carrying the factor V Leiden mutation. J Thromb Haemost, 2012, 10(7): 1453-1455. |
| [10] | Herak DC. Inherited coagulation disorders in children with arterial ischemic stroke and transient ischemic attack. Clin Biochem, 2011, 44(7): 512-513. |
 2014, Vol. 41
2014, Vol. 41


