扩展功能
文章信息
- 王姗姗, 周琳, 许宏伟
- WANG Shan-Shan, ZHOU Lin, XU Hong-Wei
- 可逆性脑血管收缩综合征临床及影像学特点
- Clinical and radiological characteristics of reversible cerebral vasoconstriction syndrome
- 国际神经病学神经外科学杂志, 2014, 41(4): 313-316
- Disease Surveillance, 2014, 41(4): 313-316
-
文章历史
- 收稿日期:2014-04-18
- 修回日期:2014-07-28
2. 解放军第187中心医院神经内科, 海南省海口市 570100
可逆性脑血管收缩综合征(reversible cerebral vasoconstriction syndrome,RCVS)是一组以剧烈头痛为特征性临床表现,伴或不伴局灶性神经功能缺损或癫痫发作的临床影像综合征。由于对该疾病的认识不足,临床工作中容易造成误诊、漏诊,现将我科诊断的3例RCVS报告并结合文献分析。 1 临床资料
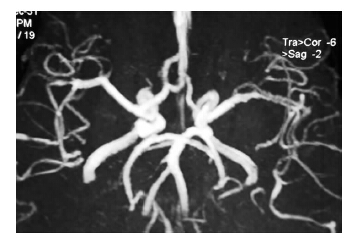
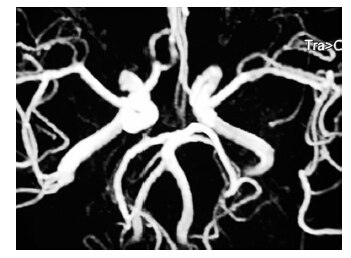
病例1,女性,54岁,以“反复头痛伴呕吐、双下肢乏力4 d”于2013年12月30日入院。入院前4 d沐浴时突然出现左侧颞部及前额部剧烈搏动样疼痛,难以忍受,尖叫伴呕吐、双下肢乏力,当地头颅CT平扫未见异常,颈部血管彩超示双侧颈内动脉、左侧颈总动脉粥样硬化,左侧椎动脉供血不足,经镇痛治疗后稍有好转;但头痛仍反复发作,剧烈难忍,伴呕吐,头昏乏力、不敢睁眼,行走后头痛加重,每次持续约数小时至半天不等。既往体健,否认传染性疾病史。家族中无类似疾病发作史,发病前无疫苗接种史。入院体查:血压156/80 mmHg,神清,急性痛苦面容,语调低沉,心肺腹未见明显异常,神经系统检查阴性。血脂:胆固醇5.64 mmol/L,低密度脂蛋白胆固醇4.42 mmol/L。腰穿脑脊液无色透明,压力正常。脑脊液常规、生化、三大染色、HIV及梅毒抗体均呈阴性。TCD检查示,双侧椎动脉、基底动脉、双侧大脑中动脉、右侧大脑前动脉血流速度显著增快。MRI平扫示双侧脑室旁见对称性小片状长T1长T2信号灶,FLAIR序列呈高信号,考虑腔隙性脑梗死。MRA示左侧大脑中动脉M2段远端较对侧纤细(图 1),考虑RCVS。给予尼莫地平,佐米曲坦片,阿普唑仑等综合治疗,临床症状逐渐缓解,9 d后头痛、恶心呕吐症状完全缓解,双下肢乏力明显减轻,可独自站立行走,即出院。出院后7个月在我院复查头颅MRA未见明显异常(图 2),随访至今无复发。
|
| 图 1 左侧大脑中动脉M2段远端较对侧纤细。 |
|
| 图 2 左侧大脑中动脉M2段未见明显异常。 |
病例2,男性,25岁,以“突发剧烈头痛伴视物模糊2 d”于2014年1月入院。患者2 d前淋雨后突发双侧颞及枕顶部“撕裂样”剧痛,呈持续性,伴视物模糊,右侧肢体麻木乏力,当地医院按“血管性头痛”处理后症状未见明显改善转入我院。入院体查:血压136/80 mmHg,心肺腹未见明显异常。神经系统检查示右侧肢体轻瘫试验阳性,余未见阳性定位体征。既往体健。三大常规、生化常规检查正常。腰穿脑脊液呈无色透明,压力200 mmH2O。脑脊液常规、生化、三大染色、HIV及梅毒抗体均呈阴性。TCD示双侧大脑前动脉、左侧大脑中动脉血流速度显著增快。MRI平扫+增强示左侧额顶叶点片状稍长T1长T2信号灶,DWI等信号,ADC稍高信号,无强化效应。MRA示左侧大脑中动脉M1、M2段呈“串珠样”改变,左侧大脑前动脉A1段变细。考虑RCVS。予尼莫地平,依达拉奉,七叶皂苷钠片及罗痛定镇痛等对症支持治疗,治疗后第3天头痛症状减轻,右侧肢体无力症状完全恢复。治疗后第6天复查TCD双侧大脑前动脉、左侧大脑中动脉血流速度较前明显减慢。第10天患者自觉无明显头痛要求出院。出院1月后复查头部MRI +MRA未见明显异常。TCD检查血流速度大致正常,电话随访至今无复发。
病例3,女性,38岁,因“反复发作性头痛6 d”于2013年2月入住我院。患者缘于6 d前工作劳累后出现头痛,以顶枕部为主伴颈肩部肌肉僵硬,呈发作性,每次持续约数分钟至数小时不等,自服“去痛片”头痛未见缓解且发作频次增加,剧烈难忍,呈“雷击样”。入院体查:生命体征平稳,神清语利,急性痛苦面容,家人搀扶步入病房,查体配合。心肺腹无特殊。神经系统检查未见明显异常。头部MRI平扫+增强+MRA示右侧顶枕叶皮质下小片状长T1长T2信号灶,无强化;DWI稍低信号,ADC高信号。右侧大脑后动脉细小。TCD示双侧椎动脉及右侧大脑中动脉血流明显增快。腰穿脑脊液无色透明,压力190 mmH2O;脑脊液常规、生化、三大染色、HIV及梅毒抗体均呈阴性。建议进一步行DSA检查,患者及其家属未同意。考虑RCVS。给予尼莫同30 mg口服,一日三次,七叶皂甘钠片30 mg口服,一日三次。治疗1周后头痛症状明显减轻,第10天患者及其家属要求带药出院,门诊定期随访。出院3个月后复查头颅MRI及MRA未见明显异常,随访至今无复发。 2 讨论
本病好发年龄在20~50岁,女性多于男性,比例约4∶1。该病临床表现以突然(雷击样、搏动样、撕裂样、爆炸性等)严重头痛、伴或不伴神经功能缺失或癫痫发作为特征的一组临床综合征。头痛可以是唯一症状,典型者为“雷击样头痛”,是一种突然发生的剧烈难以忍受的头痛,瞬间可达高峰,可持续数分钟至数十小时,可类似偏头痛伴有恶心、呕吐,畏光、畏声等症状,部分病人可出现局灶性神经功能缺损或癫痫发作。结合目前RCVS相关文献报道约80%可因沐浴、性行为、咳嗽、打喷嚏或突然的体位改变等为诱发因素,服用特殊类型药物如5-羟色胺能、抗抑郁药物,偏头痛,内分泌因素,妊娠分娩,颅脑外伤,贫血等与RCVS也有相关性[1]。RCVS诊断的金标准是DSA,可见1处或多处大脑动脉局限性狭窄,表现为节段性、多灶性,典型者呈“串珠样”改变,常累及颅内中型血管,尤其是Willis环附近的血管,如大脑前动脉、大脑中动脉、大脑后动脉起始段,4~12周即可恢复正常。Ducros等[2]研究发现,头颅CTA/MRA诊断RCVS的敏感性约为80%。新近的研究还发现颈内动脉的颅外段亦可受累[3]。发病早期4~5 d的患者首次MRI、MRA或CTA等检查可以是正常的,可据病情变化定期行TCD/MRA或CTA随访。可合并有大脑皮质凸面的非动脉瘤性蛛网膜下腔出血、脑水肿、脑实质出血及脑梗死等并发症时而表现出相应的异常改变。一项研究显示,RCVS患者TCD检查时约81.3% MCA最高流速超过80 cm/s,46.9%的患者超过120 cm/s,但多不会超过200 cm/s[4];但值得注意的是部分患者头痛消失后MCA的平均血流速度仍可高于正常值。国际头痛学会于2007年制定的RCVS诊断标准为[1]:①急性的剧烈头痛(通常是雷击样疼痛)伴或不伴局灶性神经功能缺损或颠痫发作;②单项病程,发病后1个月没有新的症状;③血管造影(MRA/CTA或DSA)证实的脑动脉阶段性收缩;④排除由动脉瘤破裂引的蛛网膜下腔出血;⑤正常或接近正常的脑脊液(蛋白<1 g/L,WBC<15×103/ml,糖正常);⑥12周后再次血管造影(MRA/CTA或DSA)显示动脉完全或基本正常。本组3例患者均以剧烈头痛为首发症状,其中1例伴有双下肢无力,1例伴视物模糊、右侧肢体轻偏瘫,1例无神经系统阳性体征;TCD检查均提示不同血管不同程度的血流速度增快;头颅MRI及MRA检查提示部分血管收缩,典型者呈“串珠样”改变;脑脊液等相关检查无特异性。经钙离子拮抗剂等治疗后临床症状、体征逐渐消失,1~3个月超声影像学复查完全恢复正常,临床症状无反复,呈单向病程,预后良好,符合RCVS的诊断标准[1]。
〖JP2〗临床上表现为突发雷击样头痛反复发作的患者,应高度警惕RCVS,并应与其它相关疾病进行鉴别。①蛛网膜下腔出血:主要鉴别是动脉瘤引起的还是RCVS继发的,继发于RCVS的SAH出血量较少且影响远离出血部位的中到大动脉,串珠样或香肠样改变的脑血管收缩有一定特征性;而动脉瘤破裂所致SAH出血接近破裂的动脉瘤,多累及出血附近的1~2条中口径血管[5, 6]。②原发性中枢神经系统脑血管炎(primary angiitis of the central nervous system,PACNS):起病多隐匿,男性多见,40~50岁为发病高峰,主要表现为全头持续性闷痛或缓慢进展性头痛,而非典型的雷击样疼痛,绝大部分PACNS患者头颅MRI存在异常,通常累及皮质和深部白质,包括胼胝体和内囊,且常是双侧的多发病灶。80%~90% PACNS患者脑脊液呈炎性改变;RCVS血管异常具有完全可逆性,而PACNS血管异常不可逆,血管成像显示动脉狭窄不对称、欠规则[1]。③感染性或免疫相关性血管炎[5]:病原体感染(如梅毒、HIV及结核等)及免疫相关的结缔组织病(如SLE、神经白塞氏病、干燥综合征及类风湿等)均可引起颅内血管狭窄,相应病原学检测及有无合并症、自身抗体等检测有助于鉴别。④偏头痛:为常见的慢性血管性疾病,约60%的偏头痛患者有家族史,其特征为发作性、多为偏侧、中重度搏动样头痛,多起病于儿童和青春期,常有遗传背景,偏头痛通常反复发作,血管可复性很快;而RCVS常一生中仅此一次,血管的恢复在4~12周。
RCVS发病机制目前尚不明确,普遍认为与血管收缩能力短暂性失调导致颅内中等程度血管(尤其是大脑Willis环附近的血管近端)呈节段性、多灶性收缩有关[1]。颅内血管近端受交感神经传入纤维的支配,从而调节血管张力,且拟交感药物(如大麻、迷幻药)及部分肿瘤释放的儿茶酚胺物质,如嗜铬细胞瘤,支气管类癌等,及一些免疫抑制剂或血制品、颈动脉内膜剥脱术、神经外科手术,缺铁性贫血,产后等均可促发RCVS[7, 8, 9],提示脑血管交感神经过度兴奋在RCVS的发病过程中占有重要地位[9]。有研究发现RCVS可合并或继发可逆性后部白质脑病(reversible posterior leukoencephalopathy syndrome,RPLS),与经典的缺血性卒中不同,RCVS和RPLS的病理改变是血管源性水肿而非真正意义上的坏死[1],这也提示脑血管功能障碍也参与了RCVS的发病过程[5, 10]。本组病例2、病例3头颅MRI扫描可见局灶性病灶,治疗后复查病灶消失,考虑是血管源性水肿所致,与文献相符[5, 10]。国外有学者提出在自身或外界应激的共同作用下,由血管活性物质等因素促发致遗传易感个体脑血管交感兴奋性增强、内皮细胞功能障碍,脑血管强力收缩等张力调节功能障碍致脑血管多发节段性痉挛等可引起头痛与缺血性卒中,而血脑屏障破坏则引起出血性卒中[8, 10]。本组病例均未并发或继发脑梗死,考虑与诊断及时、治疗积极等因素有关。
RCVS少见,其发病原因及机制尚不明确,目前对RCVS治疗多为经验性治疗,钙离子通道拮抗剂如尼莫地平或维拉帕米作为一线治疗药物已被证实有效[1],不推荐使用激素。另有学者提出,斯里兰卡肉桂碱受体拮抗剂单曲林可有效抑制细胞内钙自内质网的释放,从而抑制动脉收缩,有望成为新的治疗用药[1, 2]。RCVS大多数患者可恢复,预后好,少数继发卒中可遗留轻微症状;但严重持久的大动脉收缩可导致出血性脑梗死[1, 5],因严重的卒中而致死的病例不超过1%[11]。临床工作中应加强对突发的“雷击样”、“爆炸样”、“撕裂样”头痛患者的筛查,提高对该病的认识。
| [1] | Calabrese LH, Dodick DW, Schwedt TJ, et al. Narrative Review:reversible cerebral vasoconstriction syndromes. Ann Intern Med, 2007, 146(1): 34-44. |
| [2] | Ducros A, Bousser MG. Reversible cerebral vasoconstriction syndrome. Pract Neurol, 2009, 9: 256-267. |
| [3] | Melki E, Denier C, Theaudin-Saliou M, et al. External carotid artery branches involvement in reversible cerebral vasoconstriction syndrome. J Neurol Sci, 2012, 313(1-2): 46-47. |
| [4] | Chen SP, Fuh JL, Chang FC, et al. Transcranial color doppler study for reversible cerebral vasoconstriction syndromes. Ann Neurol, 2008, 63(6): 751-757. |
| [5] | 王子高,祖衡兵.可逆性脑血管收缩综合征.中国神经精神疾病杂志, 2013, 39(5): 314-317. |
| [6] | Hantson P, Forget P. Reversible cerebral vasospasm, multilobular intracerebral hemorrhages, and nonaneurysmal subarachnoid hemorrhage: review of possible interrelationships. Curr Pain Headache Reports, 2010, 14(3): 228-232. |
| [7] | 魏兴梅,窦宁宁,仲俊.交感神经在脑血管疾病中作用机制的研究.国际神经病学神经外科学杂志, 2013, 40(5): 446-449. |
| [8] | 解龙昌,杨新光,何毅华,等.回顾性分析可逆性脑血管收缩综合征(附2例病例报道).现代生物医学, 2013, 14(3): 57-59. |
| [9] | Abruzzo T, Patino M, Leach J, et al. Cerebral vasoconstriction triggered by sympathomimetic drugs during intra-atrerial chemotherapy. Pediat Neurol, 2013, 48(2): 139-142. |
| [10] | Noda K, Fukae J, Fujishima K, et al. Reversible cerebral vasoconstriction syndrome presenting as subarachnoid hemorrhage, reversible posterior leukoencephalopathy, and cerebral infarction. Int Med, 2011, 50(11): 1227-1233. |
| [11] | Ducros A. Reversible cerebral vasoconstriction syndrome. Lancet Neurol, 2012, 11(10): 906-917. |
 2014, Vol. 41
2014, Vol. 41


