扩展功能
文章信息
- 徐晓娅, 郭晓聪, 黄琳明, 李作孝, 石强
- XU Xiao-Ya, GUO Xiao-Cong, HUANG Lin-Ming, LI Zuo-Xiao, SHI Qiang
- 雌激素对实验性变态反应性脑脊髓炎大鼠发病影响的研究
- Study on effect of estrogen on experimental allergic encephalomyelitis in rats
- 国际神经病学神经外科学杂志, 2014, 41(4): 305-308
- Disease Surveillance, 2014, 41(4): 305-308
-
文章历史
- 收稿日期:2014-04-11
- 修回日期:2014-07-23
2. 宜宾市第二人民医院检验科, 四川省宜宾市 644000;
3. 泸州医学院附属医院神经内科, 四川省泸州市 646000
多发性硬化(multiple sclerosis,MS)被广泛认为是累及中枢神经系统(central nervous system,CNS)白质的自身免疫性脱髓鞘性疾病。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是公认的研究MS的理想动物模型。近年研究认为MS的发病机制兼有自身免疫性损伤和神经变性损伤两方面[1]。多项研究表明,雌激素具有广泛的免疫调节作用和神经保护作用,在多种自身免疫性疾病及神经变性性疾病模型中具有重要作用。但目前关于雌激素与MS的研究报道较少。本实验通过制造EAE模型及雌激素干预,观察雌激素对EAE大鼠临床表现及病理改变的影响。 1 材料与方法 1.1 实验动物及试剂
雄性Wistar大鼠30只,6~8周龄,体重(200~250 g);豚鼠5只,体重400~450 g,以上动物由泸州医学院实验动物科提供。主要实验试剂:氟氏完全佐剂,购自美国Sigma公司;苯甲酸雌二醇,购自上海通用药业股份有限公司。中性甲醛固定液由病理教研室提供。 1.2 方法 1.2.1 大鼠分组及EAE模型的建立[2]
30只雄性大鼠随机分为EAE组,大剂量雌激素组,小剂量雌激素组,每组10只。将豚鼠处死后,在无菌操作下,迅速剥出脊髓,去掉马尾与脊膜,称重。加入生理盐水研磨成50%匀浆,与等量福氏完全佐剂混合,用注射器反复抽打成油包水乳液,即制得粗制碱性髓鞘蛋白(MBP)抗原。将MBP抗原注入3组大鼠双后肢足垫皮下,每只0.2 ml/100 g。 1.2.2 模型干预
EAE模型建立后常规饲养,于造模当天开始,小剂量雌激素组每日皮下注射苯甲酸雌二醇250 μg/kg/d,连续10 d。大剂量雌激素组每日皮下注射苯甲酸雌二醇1 mg/kg/d,连续10 d。EAE对照组每日注射橄榄油,连续10 d。 1.3 神经功能评分及评分标准
于建模后第1天开始(建模当天计为第1天),每日同一时段由同一人单盲观察发病情况,进行神经功能评分。0分:无明显异常;1分:后肢不全瘫痪;2分:后肢完全瘫痪;3分:后肢全瘫伴前肢不全瘫;4分:四肢全瘫或死亡。症状介于两条标准之间者以±0.5分计。造模到开始发病的时间为潜伏期,四肢瘫痪、死亡或连续3 d症状评分无加重时为高峰期,中间时间则为进展期。 1.4 脑和脊髓组织病理观察
脑和脊髓组织标本用中性甲醛固定后,在泸州医学院病理教研室作组织切片,常规脱水、透明、浸蜡、石蜡包埋和切片(8 μm厚)。切片后烘干、脱蜡和常规苏木素一伊红染色,光镜下观察病理改变。 1.5 统计学方法
所得数据以x±s表示,各组间样本均数比较采用方差分析,两两比较采用LSD检验。计数资料采用Fisher’s Exact Test检验。统计学处理由SPSS 16.0软件完成。 2 结果 2.1 发病情况
EAE发病动物表现为脱毛、食欲减退、体质量下降显著,出现不同程度的肢体无力、共济失调、瘫痪等,部分动物伴尿便失禁。雌激素治疗组发病率减低,潜伏期延长,进展期缩短,高峰期症状评分减低,以大剂量组变化更明显。见表 1。
| 组别 | 发病率(%) | 潜伏期(d) | 进展期(d) | 高峰期症状评分(分) |
| EAE对照组 | 100 | 11.6±2.5 | 7.2±1.4 | 3.1±1.1 |
| 雌激素小剂量组 | 80 | 17.5±1.6▼ | 5.1±0.6▼ | 1.5±1.1▼ |
| 雌激素大剂量组 | 50▲ | 24.2±3.0▼★ | 3.4±0.8▼☆ | 0.6±0.7▼☆ |
| 注:与EAE对照组比较,▲P<0.05,▼P<0.01;与小剂量组比较,☆P<0.05,★P<0.01。 | ||||
EAE对照组大鼠发病高峰期可见组织疏松肿胀,脑及脊髓实质内小血管充血,血管周围主要是小静脉周围有大量炎性细胞浸润,主要为淋巴细胞及单核细胞,形成“袖套”状改变,血管周围白质明显脱髓鞘改变,少突胶质细胞变性。大、小剂量雌激素组脑及脊髓也可见淋巴细胞单核细胞等炎性细胞浸润,及不同程度的白质脱髓鞘改变,但较EAE对照组明显减轻,其中大剂量雌激素组病理改变最轻,部分未发病动物未见明显病理损害。见图 1。
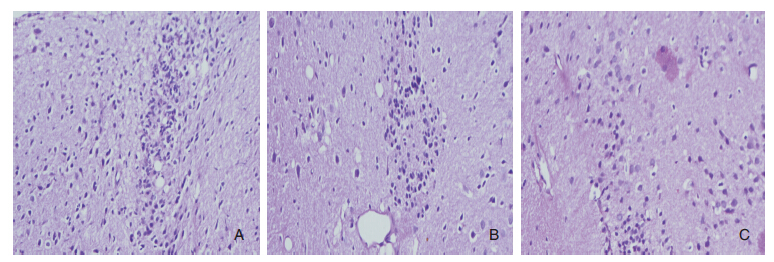
|
| 图 1 病理学检查结果,HE×400。A:EAE组;B:小剂量雌激素组;C:大剂量雌激素组。 |
目前MS的病因及发病机制尚不清楚,国内外研究均发现,MS患者中存在多种抗体,支持MS系免疫相关的疾病[3]。EAE作为一种中枢神经系统变态反应性脱髓鞘病变模型,是世界公认的研究人类MS的动物模型。许多研究证实,EAE是细胞免疫及体液免疫均参与的错综复杂的病理免疫过程,以细胞免疫为主[4]。同时MS患者晚期多有明显智能损害,MRI提示脑沟增宽、脑回变窄、脑室系统扩张等脑萎缩表现。近年国外研究发现,MS病程中伴随有灰质的萎缩,白质损害中也伴随有华勒变性及轴突的减少,故目前认为,MS的发病机制兼有自身免疫性损伤和神经变性损伤两方面[1]。
研究表明,雌激素对中枢神经系统发挥着重要的调节和保护作用,这一观点得到广泛认可[5]。雌激素可影响学习记忆和认知功能,降低老年性痴呆的发病率[6],减轻脑损伤后脑细胞死亡的程度,提高脑损伤后的恢复能力。国外大量关于雌激素与EAE/MS的研究表明,EAE大鼠的发病情况、症状严重程度与雌激素水平也有一定关系[7].针对MS患者的研究也表明,MS患者中枢神经系统病灶处的雌激素水平明显增高[8]。雌激素能够延迟MS/EAE的病程进展,降低复发率,减少活动病灶[9],对MS具有明显的保护作用。此作用是通过与其受体结合实现的。体内多种细胞的细胞膜或细胞核上均有雌激素受体(estrogen receptor,ER)表达。ER分为ERα和ERβ两种。通过选择性雌激素受体配体实验研究显示[10],在MS发病的初期及高峰期,雌激素主要通过与ERα结合,通过免疫调节,抑制炎症反应而达到保护EAE的作用;而在疾病后期及缓解期,雌激素主要通过与ERβ结合,通过非抗炎效应,对疾病发挥重要的保护作用。但最近又有研究表明,雌激素对EAE大鼠的神经系统的保护作用以及抗炎作用是通过ERα而非ERβ受体传导途径实现的[11]。故雌激素对MS/EAE发挥保护作用的具体机制目前尚不清楚。
本实验为避免内源性雌激素干扰,故选用了雄性大鼠。研究结果提示,模型组大鼠经过一定潜伏期后均出现不同程度的EAE症状,提示造模成功,雌激素干预组部分动物发病,发病率与雌激素剂量呈反比。从雌激素对大鼠EAE模型发病的影响可以看出,雌激素具有降低EAE动物发病率、延长发病潜伏期、缩短病情的进展期、减轻神经功能的损害、降低EAE死亡率的作用,其作用大小与雌激素剂量有关,高剂量作用更明显。
经神经组织病理切片检查证实EAE模型组脱髓鞘改变及炎性细胞浸润明显,符合EAE病理表现。雌激素各治疗组病理表现较EAE对照组减轻,以高剂量治疗组病理改变最轻。说明雌激素可减轻EAE大鼠的病理损害,作用与雌激素剂量有关。本实验病理切片未见明显轴突崩解、神经细胞数量减少等神经变性表现,可能与复制的系急性单相病程的EAE模型,病程比较短,在疾病高峰期就已经处死动物,尚未出现此类损害表现有关。有待我们进一步进行深入的研究。
雌激素对EAE作用的深入研究,为防治MS提供了新方法。国外已有将雌激素用于治疗MS患者的研究报道[1, 12],并发现它能明显减少MS患者中枢神经系统内的病灶,同时还能改善MS所致的认知功能的损害。但目前,雌激素的临床应用还存在广泛争议,如雌激素能增加乳腺癌、子宫内膜癌、卵巢癌的发病率等。乳腺和子宫内膜等组织中主要表达的是ERα,故近年有研究尝试通过使用选择性ERβ配体治疗达到保护MS的作用而避免其导致生殖系统肿瘤的副作用的发生[1]。故将来有望通过使用雌激素或选择性的作用于雌激素的受体的药物来达到临床上治疗MS的目的。本实验仅观察研究了雌激素对EAE临床表现及病理变化的影响,进一步深入研究雌激素对EAE的作用机制将为雌激素的临床安全治疗提供重要依据。
| [1] | Gold SM, Voskuhl RR. Estrogen and testosterone therapies in multiple sclerosis. Prog Brain Res, 2009, 175: 239-251. |
| [2] | 董梅,刘瑞春,郭力,等.Wistar大鼠实验性变态反应性脑脊髓炎的模型建立.脑与神经疾病杂志, 2004, 12(6): 425-428. |
| [3] | 周昊,杨欢.中枢神经系统自身免疫疾病相关抗体.国际神经病学神经外科学杂志, 2013, 40(3): 289-293. |
| [4] | Buntinx M, Ameloot M, Steds P, et al. Interferon-gamma-induced calcium influx in T lymphocytes of multiple sclerosis and rheumatoid arthritis patient: a complementary mechanism for T cell activation. J Neuroimmunol, 2002, 124(1-2): 70-82. |
| [5] | Kipp M, Amor S, Krauth R, et al. Multiple sclerosis:neuroprotective alliance of estrogen-progesterone and gender. Front Neuroendocrinol, 2012, 33(1): 1-16. |
| [6] | Sarkaki A, Amani R, Badavi M, et al. Pre-treatment effect of different doses of soy isoflavones on spatial learning and memory in an ovariectomized animal model of Alzheimer's disease. Pak J Biol Sci, 2008, 11(8): 1114-1119. |
| [7] | Garay L, Gonzalez Deniselle MC, Gieeman L, et al. Steroid protection in the experimental autoimmune encephalomyelitis model of multiple sclerosis. Neuroimmunomodulation, 2008, 15(1): 76-83. |
| [8] | Luchetti S, van Eden CG, Schuurman K, et al. Gender differences in multiple sclerosis: induction of estrogen signaling in male and progesterone signaling in female lesions. Neuropathol Exp Neurol, 2014, 73(2): 123-135. |
| [9] | Subramanian S, Matejuk A, Zamora A, et a1. Oral feeding with ethinyl estradiol suppresses and treats experimental autoimmune encephalomyelitis in SJL mice and inhibits the recruitment of inflammatory cells into the central nervous system. Immunology, 2003, 170(3): 1548-1555. |
| [10] | Tiwari-Woodruff S, MoralesLB, Lee R, et al. Differential neuroprotective and antiinflammatory effects of estrogen receptor ERα and ERβ ligand treatment. Proc Natl Acad Sci U S A, 2007, 104(37): 14813-14818. |
| [11] | Spence RD, Wisdom AJ, Cao Y, et al. Estrogen mediates neuroprotection and anti-inflammatory effects during EAE through ERα signaling on astrocytes but not through ERβ signaling on astrocytes or neurons. Neurosci, 2013, 33(26): 10924-10933. |
| [12] | Sicotte NL, Giesser BS, Tandon V, et al. Testodterone tresment in multiple sclerosis:a pilot syudy. Arch Neurol, 2007, 64(5): 683-688. |
 2014, Vol. 41
2014, Vol. 41


