扩展功能
文章信息
- 戴正泽, 邱文
- 中枢神经系统神经细胞表面抗体综合征
- 国际神经病学神经外科学杂志, 2014, 41(3): 288-293
- Disease Surveillance, 2014, 41(3): 288-293
-
文章历史
- 收稿日期:2014-02-28
- 修回日期:2014-05-28
2. 南京医科大学, 江苏省南京市 210009
神经系统副肿瘤综合征(paraneoplatic neurological syndrome,PNS)是指一些恶性肿瘤非直接侵犯及非转移引起的神经和(或)肌肉损害的一组临床症候群[1]。根据临床表现,可分为经典型和非经典型综合征两类。目前认为PNS发生可能与自身免疫有关,最主要证据来自于PNS患者血液及脑脊液中发现多种抗神经元抗体。根据作用位点不同,这些抗体大致可分为两类:第一类作用于神经细胞内抗原的抗体;第二类作用于神经细胞表面、神经毡(神经突起构成的网状结构)处抗原的抗体。近年研究发现除PNS之外,其他一些中枢神经系统综合征患者体内也存在着第二类抗体,这些抗体可能是其致病因素[2, 3]。这里将第二类抗体称为神经细胞表面抗体(neuronal surface antibodies,NSAbs),由于与其相关的神经系统综合征在诊断、治疗方面存在许多相似点,近年来国外学者提出将这些综合征统称为神经细胞表面抗体综合征(neuronal surface antibody associated syndromes,NSAS)[4]。目前已确认N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)抗体脑炎等5种疾病属于该类综合征(见表 1),免疫治疗大都可收到明显效果。根据是否伴有肿瘤可分为两类,伴有肿瘤的称为副肿瘤性NSAS,属于PNS。不伴有肿瘤的称为非肿瘤性NSAS,临床上更加常见,表现上与经典PNS(如边缘性脑炎)难以区别,可以通过检出血清(或脑脊液)中相应抗体作出诊断[2, 3, 5]。目前国内相关研究较少,下面将此类综合征的临床特征、诊断及治疗综述如下。
| 综合征 | 神经细胞表面抗体 | 可能相关肿瘤 | 免疫治疗反应 |
| NMDAR抗体脑炎 | 抗-NMDAR | 卵巢畸胎瘤(儿童罕见,18岁以上超过50%) | 有效 |
| 边缘性脑炎 | 抗-LGI1 | 罕见 | 有效 |
| 抗-CASPR2(<10%) | 有些病例伴随胸腺瘤 | 有效 | |
| 抗-AMPAR | 肺、乳腺、甲状腺肿瘤(60%~70%) | 有效,但经常复发 | |
| 抗-GABABR | SCLC(60%~70%) | 有效 | |
| 抗-mGluR5 | 霍奇金淋巴瘤 | 未知 | |
| 莫旺综合征 | 抗-CASPR2 | 胸腺瘤(38%) | 有效 |
| PERM | 抗-GlyR | 胸腺瘤 | 有效 |
| NSAbs相关小脑性共济失调 | 抗-VGCC | SCLC(>95%) | 无效 |
| 抗-mGluR1 | 霍奇金淋巴瘤 | 有效 | |
| 抗-CASPR2 | 无 | 未知 | |
| 注:NMDAR:N-甲基-D-天门冬氨酸受体;PERM:伴随强直和肌阵挛的进行性脑脊髓炎;AMPAR:α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体;LGI 1:富亮氨酸胶质瘤失活蛋白1;CASPR 2:接触蛋白相关蛋白 2;GABABR:γ-氨基丁酸受体B;mGluR 5:代谢性谷氨酸受体 5;GlyR:甘氨酸受体;VGCC:电压门控型钙通道;mGluR 1:代谢性谷氨酸受体1;SCLC:小细胞肺癌 | |||
NMDAR抗体脑炎患者大部分是年轻女性和儿童。超过50%年轻女性患者患有卵巢畸胎瘤,罕见儿童伴有恶性肿瘤。临床症状主要表现为明显的精神症状、癫痫、中枢性通气不足、自主神经功能障碍和运动障碍,口面部异动是最具特征性的运动障碍。儿童中癫痫和异常运动更加常见。起病初期,55%患者头部MRI的FLAIR或T2序列可见高信号,高信号最常见于颞叶内侧面。95%患者存在脑脊液的异常,表现为淋巴细胞和蛋白水平升高,部分患者还可出现寡克隆带[5, 6]。给予切除肿瘤(如伴发肿瘤)和免疫治疗后,半数左右患者可以完全恢复,部分患者遗留不同程度缺陷,少数患者死亡[7]。 1.2 边缘性脑炎
边缘性脑炎(limbic encephalitis,LE)表现为亚急性起病的短期记忆减退、行为异常和癫痫,伴随脑脊液炎性改变和神经元抗体出现。以往认为边缘性脑炎是罕见的PNS,但现在研究表明其经常以非肿瘤性出现[3]。
电压门控型钾通道(voltage gated potassium channel,VGKC)抗体相关边缘性脑炎是首个免疫治疗有效的中枢神经系统NSAS。研究发现,患者体内能与VGKC发生免疫共沉淀的抗体并不以VGKC本身,而是与VGKC紧密结合的蛋白,主要是富亮氨酸胶质瘤失活蛋白1(leucine rich glioma inactivated 1 protein,LGI 1)或接触蛋白相关蛋白2(contactin associated protein 2,CASPR 2)作为靶点[8, 9],现将这些抗体称为VGKC复合物抗体,也可明确称为LGI 1或CASPR 2抗体。患者体内检出的抗体中大部分是LGI 1抗体。近60%患者头部MRI显示中颞叶炎性改变,但淋巴细胞增多等脑脊液炎性改变少见。多数患者免疫治疗数周可收到良好疗效,部分患者未经治疗可自行缓解[8, 10]。
部分表现出经典边缘性脑炎患者体内可检出α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(a-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor,AMPAR)抗体和γ-氨基丁酸受体B(gamma-aminobutyric acid B receptor,GABABR)抗体,患者多数伴有肿瘤(包括小细胞肺癌、甲状腺癌和乳腺癌),其中副肿瘤性神经元抗体阴性的小细胞肺癌患者体内GABABR抗体可能更常见[11]。显著精神症状可能与AMPAR抗体有关,显著的癫痫可能与GABABR抗体有关。虽然少数伴有AMPAR抗体患者中观察到复发,但大部分伴有AMPAR抗体或GABABR抗体患者接受针对肿瘤治疗和免疫治疗后显示出神经系统症状的持续改善[12, 13]。
最近,两位患有边缘性脑炎和霍奇金淋巴瘤患者体内检出了一种新型NSAb——代谢性谷氨酸受体5(metabotropic glutamate receptor 5,mGluR 5)抗体。患者均在霍奇金淋巴瘤确诊前出现了神经系统症状。其中一位患者的头部MRI显示双侧后顶-枕叶在T2 WI相上呈现高信号。两位患者经相应治疗后神经系统功能恢复良好[14]。 1.3 莫旺综合征
莫旺综合征(Morvan’s syndrome)是一种与VGKC复合物抗体相关的自身免疫性疾病。法国人Morvan(1890)首次描述了这种疾病,故而得名。莫旺综合征有着广泛的神经系统症状,包括神经性肌强直、失眠、幻觉、记忆受损、癫痫、多汗、便秘、尿失禁和心律失常[15]。莫旺综合征中CASPR2抗体较LGI1抗体更为常见[16],部分患者两种抗体同时存在。大约40%患者伴有肿瘤,最常见是胸腺瘤,这些患者预后不良,其余无肿瘤患者免疫治疗后可收到较好疗效[8]。 1.4 伴随强直和肌阵挛的进行性脑脊髓炎
伴随强直和肌阵挛的进行性脑脊髓炎(progressive encephalomyelitis with rigidity and myoclonus,PERM)是一种临床上少见疾病,主要表现为亚急性起病的广泛性强直、肌阵挛、痛性抽搐和过度惊骇。部分PERM患者体内存在谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)抗体,最近有些此类患者体内又发现了针对甘氨酸受体(glycine receptor,GlyR)的抗体[17, 18]。关于GlyR抗体的病例报告表明这些患者存在显著的脑干功能紊乱、轻微的MRI和脑脊液炎性改变[17]。一位伴有胸腺瘤的患者,切除肿瘤和免疫治疗后收到明显疗效[18]。 1.5 NSAbs相关小脑性共济失调(cerebellar ataxia associated with NSAbs)
部分患有小细胞肺癌的小脑变性患者体内可以检出电压门控型钙通道(voltage gated calcium channel,VGCC)抗体[19],且免疫治疗无效,提示VGCC抗体可能与小脑病理改变无关(或是治疗前该抗体已导致小脑Purkinje细胞永久性损害)[19, 20]。既往有霍奇金淋巴瘤病史的两例亚急性小脑变性患者体内检出了代谢性谷氨酸受体1(mGluR1)抗体,将这种抗体转运给试验动物,可以导致受试动物出现共济失调[21]。最近用蛋白质组学方法对非肿瘤性小脑性共济失调进行了研究,88例患者中9例检出了CASPR2抗体[22]。 2 辅助检查 2.1 抗体筛查
由于大多数NSAS与NMDAR抗体和VGKC复合物抗体相关,临床应首先检查这两种抗体。目前已有商业化方法可检测大部分已知NSAbs。如果已知NSAbs检测结果为阴性,可使用大鼠海马或神经元免疫组织化学染色法检测患者血清(或脑脊液)中是否存在针对神经元的其他抗体。如结果阳性将有助发现新的NSAbs和其抗原,并指导免疫治疗。 2.2 肿瘤筛查
EFNS(European Federation of Neurological Societies)2011年提出了PNS的肿瘤筛查指南。该指南推荐CT检查胸部或腹部肿瘤、钼靶检查乳腺癌、超声检查卵巢畸胎瘤或睾丸肿瘤。上述肿瘤筛查阴性的患者可考虑使用PET扫描。对于没有发现肿瘤的患者,建议每隔6个月复查一次,持续4年[23]。 3 NSAS的诊断
Zuliani等[4]研究人员对诊断NSAS诸多因素进行回顾性研究,2012年提出了NSAS的诊断流程和标准(见图 1)。
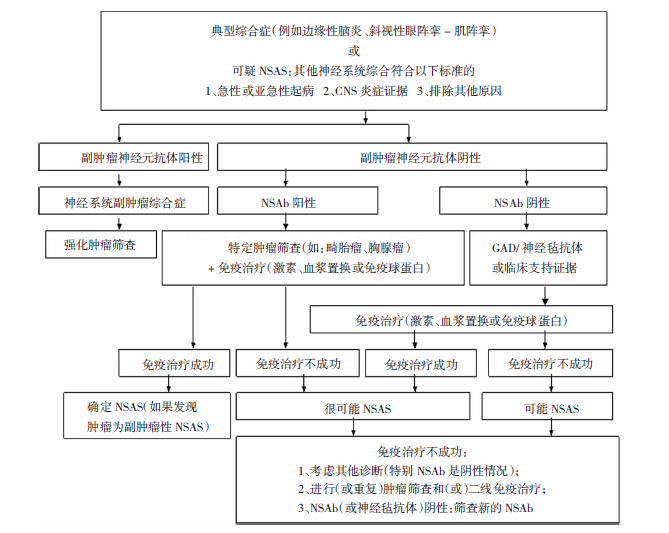
|
| 图 1 NSAS的诊断流程和标准 |
不同疾病根据其临床特点有各自的诊断流程。 3.1.1 典型综合征
临床症状符合典型综合征(例如边缘性脑炎或斜视性阵挛-肌阵挛)的患者,已排除其他病因(如感染、外伤、中毒、代谢性疾病或中枢神经系统疾病史)情况下,如要诊断为NSAS,还需进一步排除PNS。为此应当筛查肿瘤,同时检测副肿瘤性神经元抗体和NSAbs。如果发现肿瘤或副肿瘤性神经元抗体阳性,该综合征可确诊PNS。无论是否发现肿瘤,如果NSAbs阳性,则给予免疫治疗,并可根据疗效作出诊断。必要时应强化对特定肿瘤的筛查(例如NMDAR抗体阳性应筛查畸胎瘤,VGKC抗体阳性应筛查胸腺瘤)。 3.1.2 可疑NSAS
该类综合征是指临床症状符合下述临床标准的其他中枢神经系统综合征。如果同时存在下述临床支持证据将增加其为NSAS的可疑性,并有助于诊断分类。考虑到所有的症状可能与肿瘤相关,应当首先筛查肿瘤和副肿瘤性神经元抗体。如果发现肿瘤或副肿瘤性神经元抗体阳性,根据Graus等在2004年提出的PNS诊断标准[24],该综合征可确诊或疑似PNS。同时也应寻找NSAbs,如果没有禁忌,特别已排除感染性疾病情况下,可边等待检测结果,边进行试验性糖皮质激素、静滴免疫球蛋白或血浆置换治疗,并根据疗效作出诊断。 3.1.2.1 临床标准
①急性或亚急性(<12周)起病。②中枢神经系统炎症证据(至少具备以下1项):脑脊液炎性改变(淋巴细胞增多,特异性寡克隆带或IgG指数增高);MRI异常(例如边缘性脑炎的中颞叶在FLAIR/T2相上呈高信号)或功能影像学异常(PET上显示高代谢或SPECT上显示高灌注);脑活检发现炎性改变(淋巴细胞浸润或其他免疫激活信号)。③排除其他原因(感染、外伤、中毒、代谢性疾病、脱髓鞘或中枢神经系统疾病史)。 3.1.2.2 临床支持证据
①有其他自身抗体介导的(例如重症肌无力)或器官特异性自身免疫性疾病史。②前驱感染、发热性疾病或病毒感染样前驱症状。 3.2 诊断标准
依据临床表现(是否伴有上述流程中的临床支持证据),神经细胞相关抗体检测和肿瘤筛查结果,免疫治疗疗效可以做出如下诊断。 3.2.1 确诊标准
血清或脑脊液内发现已知神经细胞表面抗体,且免疫治疗有效。如发现肿瘤则为副肿瘤性NSAS。 3.2.2 很可能标准
血清或脑脊液内发现已知神经细胞表面抗体。
存在其他神经细胞抗体标志物(GAD抗体,未知的神经细胞表面/神经毡抗体)或至少一项临床支持证据,并且免疫治疗有效。 3.2.3 可能标准
存在其他神经细胞抗体标志物(GAD抗体,未知的神经细胞表面/神经毡抗体)或至少一项临床支持证据。
免疫治疗有效。 4 治疗
副肿瘤性NSAS治疗可参考PNS治疗,主要包括两方面:①针对肿瘤的治疗,包括手术治疗和积极合理的放、化疗;②免疫治疗。其他NSAS则主要给予免疫治疗。
目前针对这些病人使用何种免疫治疗尚未达成共识,但典型综合征早期进行免疫治疗的重要性已得到公认。一线免疫治疗包括糖皮质激素、静滴免疫球蛋白或血浆置换及这些治疗的组合。一线免疫治疗数周后,大多数NSAbs相关脑炎患者症状缓解,然而NMDAR抗体脑炎患者缓解较慢。对于无缓解者,如果肿瘤筛查阴性,建议给予二线免疫治疗,包括利妥昔单抗、环磷酰胺或二者同时使用[5]。虽然长期免疫治疗已用于预防NMDAR抗体脑炎的复发,但是目前还缺乏评价其疗效的数据[25],有待收集相关数据并进行评价。 5 小结
虽然患者体内检出的神经细胞表面抗体并不确定与副肿瘤综合征相关,但预示着免疫治疗的良好疗效。潜在肿瘤存在的概率和肿瘤的类型与所检出神经细胞表面抗体的类别密切相关。将来,需要建立国际标准的抗体检测程序,从而有助于早期诊断和治疗这些疾病,以期获得理想治疗效果和缩短住院时间。相信随着研究的深入,将会有更多的NSAbs被发现,这将促进神经系统自身免疫性疾病的研究。
| [1] | 周昊,杨欢.中枢神经系统自身免疫疾病相关抗体.国际神经病学神经外科学杂志, 2013, 40(3): 289-293. |
| [2] | Vincent A, Bien CG, Irani SR, et al. Autoantibodies associated with diseases of the CNS: new developments and future challenges. Lancet Neurol, 2011, 10(8): 759-772. |
| [3] | Lancaster E, Martinez-Hernandez E, Dalmau J. Encephalitis and antibodies to synaptic and neuronal cell surface proteins. Neurology, 2011, 77(2): 179-189. |
| [4] | Zuliani L, Graus F, Giometto B, et al. Central nervous system neuronal surface antibody associated syndromes: review and guidelines for recognition. J Neurol Neurosurg Psychiatry, 2012, 83(6): 638-645. |
| [5] | Dalmau J, Lancaster E, Martinez-Hernandez E, et al. Clinical experience and laboratory investigations in patients with anti-NMDAR encephalitis. Lancet Neurol, 2011, 10(1): 63-74. |
| [6] | 陈蕾,田志岩,吴潇哲,等.抗N-甲基-D-天冬氨酸受体.国际神经病学神经外科学杂志, 2012, 39(1): 92-94. |
| [7] | Day GS, High SM, Cot B, et al. Anti-NMDA-receptor encephalitis: case report and literature review of an under-recognized condition. J Gen Intern Med, 2011, 26(7): 811-816. |
| [8] | Irani SR, Alexander S, Waters P, et al. Antibodies to Kv1 potassium channel-complex proteins leucine-rich, glioma inactivated 1 protein and contactin-associated protein-2 in limbic encephalitis, Morvan's syndrome and acquired neuromyotonia. Brain, 2010, 133(9): 2734-2748. |
| [9] | Lancaster E, Huijbers MG, Bar V, et al. Investigations of caspr2, an autoantigen of encephalitis and neuromyotonia. Ann Neurol, 2011, 69(2): 303-311. |
| [10] | Buckley C, Oger J, Clover L, et al. Potassium channel antibodies in two patients with reversible limbic encephalitis. Ann Neurol, 2001, 50(1): 73-78. |
| [11] | Boronat A, Sabater L, Saiz A, et al. GABA(B) receptor antibodies in limbic encephalitis and anti-GAD-associated neurologic disorders. Neurology, 2011, 76(9): 795-800. |
| [12] | Lai M, Hughes EG, Peng X, et al. AMPA receptor antibodies in limbic encephalitis alters synaptic receptor location. Ann Neurol, 2009, 65(4): 424-434. |
| [13] | Lancaster E, Lai M, Peng X, et al. Antibodies to the GABA(B) receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurol, 2010, 9(1): 67-76. |
| [14] | Lancaster E, Martinez-Hernandez E, Titulaer MJ, et al. Antibodies to metabotropic glutamate receptor 5 in the Ophelia syndrome. Neurology, 2011, 77(18): 1698-1701. |
| [15] | Misawa T, Mizusawa H. Anti-VGKC antibody-associated limbic encephalitis/Morvan syndrome. Brain Nerve, 2010, 62(4): 339-345. |
| [16] | Irani SR, Pettingill P, Kleopa KA, et al. Morvan syndrome: clinical and serological observations in 29 cases. Ann Neurol, 2012, 72(2): 241-255. |
| [17] | Hutchinson M, Waters P, McHugh J, et al. Progressive encephalomyelitis, rigidity, and myoclonus: a novel glycine receptor antibody. Neurology, 2008, 71(16): 1291-1292. |
| [18] | Clerinx K, Breban T, Schrooten M, et al. Progressive encephalomyelitis with rigidity and myoclonus: resolution after thymectomy. Neurology, 2011, 76(3): 303-304. |
| [19] | Graus F, Lang B, Pozo-Rosich P, et al. P/Q type calcium-channel antibodies in paraneoplastic cerebellar degeneration with lung cancer. Neurology, 2002, 59(5): 764-766. |
| [20] | Fukuda T, Motomura M, Nakao Y, et al. Reduction of P/Q-type calcium channels in the postmortem cerebellum of paraneoplastic cerebellar degeneration with Lambert-Eaton myasthenic syndrome. Ann Neurol, 2003, 53(1): 21-28. |
| [21] | Sillevis Smitt P, Kinoshita A, De Leeuw B, et al. Paraneoplastic cerebellar ataxia due to autoantibodies against a glutamate receptor. N Engl J Med, 2000, 342(1): 21-27. |
| [22] | Becker E, Zuliani L, Pettingill R, et al. Contactin-associated protein-2 antibodies in non-paraneoplastic cerebellar ataxia. J Neurol Neurosurg Psychiatry, 2012, 83(4): 437-440. |
| [23] | Titulaer MJ, Soffietti R, Dalmau J, et al. Screening for tumours in para neoplastic syndromes: report of an EFNS task force. Eur J Neurol, 2011, 18(1): 19-27. |
| [24] | Graus F, Delattre JY, Antoine JC, et al. Recommended diagnostic criteria for paraneoplastic neurological syndromes. J Neurol Neurosurg Psychiatry, 2004, 75(8): 1135-1140. |
| [25] | Gabilondo I, Saiz A, Galan L, et al. Analysis of relapses in anti-NMDAR encephalitis. Neurology, 2011, 77(10): 996-999. |
 2014, Vol. 41
2014, Vol. 41

