扩展功能
文章信息
- 武晨, 江文
- 突触囊泡蛋白2A:抗癫痫药物的新靶点
- 国际神经病学神经外科学杂志, 2014, 41(3): 260-264
- Disease Surveillance, 2014, 41(3): 260-264
-
文章历史
- 收稿日期:2014-03-20
- 修回日期:2014-06-05
神经末梢突触囊泡释放神经递质是一个精细复杂的过程,涉及多种蛋白质之间的相互作用。其中位于突触囊泡膜上的囊泡蛋白2(synaptic vesicle protein 2,SV2)在中枢神经系统功能维持中起到关键作用,并与癫痫的病理生理有关。其主要亚型SV2A是新型抗癫痫药物左乙拉西坦(levetiracetam,LEV)的作用靶点。本文就SV2A的结构特点及生物学功能,SV2A与癫痫的相关研究做以综述。 1 SV2A的结构特点与生物学功能 1.1 SV2A的结构特点
SV2A存在于低等脊椎动物和高等哺乳动物的神经元和内分泌细胞中。人SV2A基因位于1号染色体长臂2区1带2亚带,含有14565个碱基对,其编码的mRNA携带13个外显子,约含4353个碱基对。所翻译的蛋白质分子量为82.6 KD,由742个氨基酸构成。SV2A的启动子区的共同序列原件中包含了不同的转录因子,如adaptor protein-1、p53、RSRFC4、interferon regulatory factor1、ary1 hydrocarbon receptor和Pax-2。但尚无证据显示这些转录因子参与调控SV2A的表达。miRNA微阵列预测分析显示SV2A mRNA 3’-非翻译区存在与miR-485结合的两个序列,过表达和沉默miR-485证实,miR-485负性调控SV2A的转录和翻译过程[1]。
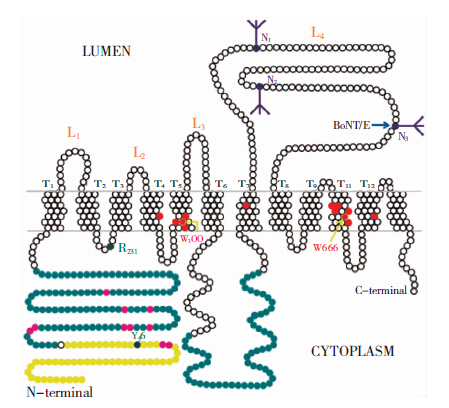
SV2A含有12个疏水跨膜区(TMR)和1个含3个N-糖基化位点的突触泡内大环,后者分别对应于氨基酸498(N1)、氨基酸548(N2)和氨基酸573(N3)。已证实这3个位点是神经肉毒毒素BoNT/A和BoNT/E进入神经元中的关键位点[2, 3]。SV2A胞质面N端第57个氨基酸是与Ca2+敏感蛋白synaptotagmin(SYT-1)C2B结构域相互作用的主要部位[4]。SYT-1是Ca2+通路介导胞吐过程的第一个受体,SV2A和SYT-1以Ca2+依赖的方式相互作用。SV2A N端含酪氨酸的内吞膜体结构(Tyr46)对SV2A和SYT-1向囊泡表面运输起着关键作用[5]。SV2A同样包含有ATP结合位点,分别位于TMR1和7胞质端内侧部分(见图 1),因而推测它可能是一个ATP结合蛋白,并且由腺嘌呤核苷酸调控着突触囊泡的引燃过程[6]。
SV2A mRNA及其翻译产物除在三叉神经核和面神经核以外的大脑各区广泛表达[7]。在大鼠和人的海马中,SV2A主要表达在突触密集的区域,如CA3区的透明层和DG区的门区[8],它无规律的分布在胞体和门区神经元树突上。SV2A在CA1和CA3始层表达稀疏,主要围绕在锥体神经元周围[9]。皮质各层亦可观察到SV2A的表达,神经毯(neuropil)内可见弥散分布的SV2A,胞体周围和锥体神经元树突上SV2A则呈斑点状分布[10]。在海马,小脑和皮质的兴奋性突触和抑制性突触上均有SV2A的表达[11]。定量分析成年大鼠皮质中谷氨酸能和GABA能轴突末端SV2A的表达,得出96%的囊泡GABA转运体(VGAT)与SV2A存在共表达,而在谷氨酸能突触上SV2A仅和82%的囊泡谷氨酸转运体1(VGLUT1)和41% VGLUT2共表达[12]。
Crèvecoeur等[13]采用激光显微分割技术结合qRT-PCR及Western blot定量分析不同时期(E12至P30天)SV2A在小鼠海马各区的表达变化,发现SV2A在P5-P7天表达明显升高且局限于CA1区,P7-P10天表达趋于稳定。而P7恰是SV2A(-/-)小鼠出现癫痫发作的时间点,也是生理条件下端脑髓鞘形成和CA1区LTP形成的时期,进而推测出生后早期表达升高的SV2A对鼠脑正常发育起到了保护作用。 1.3 SV2A的生物学功能
SV2A在囊泡循环和神经递质释放中的作用仍然不清楚。研究者最初认为SV2A是一种转运蛋白,是基于它和主要协助转运蛋白超家族(major facilitator superfamily,MFS)成员高度同源以及二者拓扑结构的相似性[14]。SV2A中心呈紧凑的漏斗样构象,这与E.coli乳糖通透酶转运体十分类似[15, 16]。TM5的Try300和TM10的Try666对于SV2A的功能十分重要,可为其发挥转运功能提供必要的疏水环境[17]。曾推测SV2A是某种神经递质的转运体,但这一假设很快被否定。因为在不同神经递质的神经末梢中均观察到SV2A的表达,且缺失SV2A并不影响谷氨酸进入囊泡中的总量[18]。还有学者认为SV2A可能是Cl-和Ca2+转运体。缺失SV2A的GABA能神经元胞吐能力下降,这种变化同囊泡氯离子转运蛋白ClC-3敲除小鼠相似[19]。而SV2A TMR1上一对结构保守的负电荷残基使其也可能成为Ca2+等阳离子转运体[20]。
SV2A参与调节神经递质的正常传导。Crowder等[21]记录了P9和P12 SV2A敲除小鼠海马CA3区锥体神经元自发抑制性突触后电流(sIPSC),其频率和幅度较野生型明显下降,提示SV2A缺失后降低了依赖动作电位的GABA(action potential-dependent GABAergic neurotransmission)分泌。使用钠通道阻滞剂河豚毒素后比较两组微小抑制性突触后电流(mIPSC)的频率和幅度,均无差异,提示SV2A缺失并不影响非依赖动作电位的GABA分泌。突触超微结构分析得出SV2A敲除小鼠的囊泡、突触数量及形态并未发生改变,提示SV2s既非突触的结构性组成部分,也不是囊泡形成所必须的。
SV2A还可能参与了Ca2+介导的胞吐过程。连续向SV2A敲除的海马神经元激发2个以上的动作电位,神经元表现出持续增加的Ca2+依赖性的递质释放,突触前末端给予Ca2+螯合剂EGTA后可以部分逆转这种作用[20]。鉴于这些研究结果,关于Ca2+和SV2A相互作用目前有两种假说,一是SV2A调节了突触前静息Ca2+含量;二是SV2A在囊泡胞吐中调节了残余Ca2+水平[22]。部分研究也证实了SV2A调节了突触前Ca2+动力学[23, 24]。重复给予SV2A/SV2B双敲除小鼠海马神经元10HZ刺激后,下降的突触反应性随着时间延长而逐渐增强,EGTA可逆转该现象。
SV2A表达的变化影响了突触前可塑性。SV2A敲除小鼠的海马神经元表现为初始囊泡释放概率(initial release probability,IRP)的降低,但对于囊泡稳态无影响。囊泡释放概率是突触前可塑性的重要参数之一,其结构基础为待释放囊泡(readily releasable pool,RRP)的数量,已有研究表明SV2A缺失降低了RRP的数量[25]。Nowack等[26]通过构建SV2A-EGFP使海马神经元中SV2A的表达升高近2倍,同样发现囊泡释放概率下降。表达SV2A-EGFP神经元的EPSC振幅较正常组降低了65%,说明SV2A表达的变化(降低或升高)均会影响突触的正常功能。
SV2A缺失对谷氨酸能(GLu)和GABA能神经递质的影响不尽相同。Venkatesan等[27]检测P6-P14天SV2A敲除小鼠CA1锥体神经元自发兴奋性和抑制性突触后电流(sEPSCs和sIPSCs)时发现,该表型小鼠sEPSCs频率增加,但是幅度无变化;而sIPSCs的频率和幅度均降低,说明SV2A缺失后加强了GLu能递质的释放。 2 鉴定SV2A是左乙拉西坦的结合靶点
Lynch等[28]采用受体放射分析的方法,用LEV的光活化衍生物[3H]ucb 30889标记大鼠脑囊泡膜成分,光交联样品SDS-PAGE显示放射性配体标记的是一个分子质量90 kDa的膜整合蛋白,分析突触囊泡结合位点的位置推断SV2是LEV的主要结合位点。检测[3H]ucb 30889在SV2A(+/+)、SV2A(-/-)、SV2B(-/-)和SV2A/2B(-/-)小鼠中的表达发现,它仅和表达SV2A小鼠的脑组织结合。此外,SV2A(+/-)小鼠[3H]ucb 30889受体最大结合容量(Bmax)值较野生型下降了50%。为进一步证实LEV仅与SV2A结合,Lynch等[28]将人SV2A、SV2B和SV2C(hSV2A、hSV2B、hSV2C)导入成纤维细胞系COS-7,并分析三者瞬时表达产物与[3H]ucb 30889的结合水平,发现[3H]ucb 30889的比活度值(DPM)仅在表达hSV2A的细胞系中明显升高,且可被LEV抵消。 3 SV2A与左乙拉西坦的亲和-效价相关性研究
LEV通过SV2A发挥抗癫痫作用的依据是,选择性SV2A配体的抗惊厥作用与其和LEV的体外亲和力密切相关。LEV、LEV立体异构体ucbL060、LEV衍生物[3H]ucb 30889与hSV2A的亲和力(用pIC50表示),和它们在听觉性发作小鼠模型中的抗惊厥效用(用pED50表示)有良好的相关性。角膜点燃模型和Strasbourg遗传性失神癫痫大鼠(GAERS)中SV2A配体的pED50与pIC50相关系数r2分别为0.80和0.72[29]。
LEV对SV2A(+/-)小鼠的抗惊厥作用明显下降。该表型小鼠V-EEG并无明显的痫性放电,但癫痫易感性增强[30]。在6 Hz难治癫痫发作模型中LEV对野生型小鼠发作阈值的增加程度(用ΔCS50表示)高于杂合小鼠。CS50是指引起50%动物惊厥发作的电流刺激。此外,给予两种表型小鼠不同剂量LEV预处理后观察两者ΔCS50发现,低剂量LEV(17 mg/kg)预处理时两种表型ΔCS50均增加但差异无统计学意义,但给予高剂量LEV(170 mg/kg)时,野生型小鼠的ΔCS50恰为SV2A(+/-)小鼠的50%。这一现象可以解释为SV2A(+/-)表型仍有50%的SV2A可与LEV结合,只有当LEV几乎全部结合SV2A时,两种表型的ΔCS50才有明显差异[31]。 4 SV2A在不同癫痫模型以及临床活检标本中的表达 4.1 SV2A在不同癫痫模型中的表达
大鼠双侧海马电点燃模型中,癫痫持续状态(SE)24 h之内,海马内分子层、齿状回门区以及门区神经元周围SV2A免疫反应性(IR)有所降低。SE1周后,SV2A IR在海马CA以及DG各层持续降低;直至到达慢性期(SE后6~8个月),阳性表达的SV2A在海马各区降低近28%。SV2A在癫痫大鼠海马各区的表达降低,尤其在苔藓纤维末端(未出现自发发作时)降低明显,提示这种变化可能是癫痫发作的结果也可能是促成癫痫发生的原因[8]。
PTZ点燃小鼠模型中,SV2A选择性地在齿状回门区表达升高,而在CA3的透明层以及CA1和CA3锥体细胞周围表达无变化。同时检测其他囊泡分泌蛋白SNARE complexes、NSF、Munc-18-1和α-SNAP水平无变化。此外,齿状回门区谷氨酸脱羧酶67(GAD67)标记的GABA能中间神经元胞体和树突上可以观察到表达升高的SV2A,而在VGLUT标记的谷氨酸能苔藓纤维末端并未发现这一现象,推测表达上升的SV2A可能通过易化GABA能神经递质的传递作为癫痫发作后的代偿机制之一[9, 32]。 4.2 SV2A在不同病因致癫痫发作病人中的表达
颞叶癫痫(TLE)病人手术切除标本显示,前颞叶新皮质的SV2A表达较正常组织降低了30%~50%,海马切除标本中同样观察到SV2A表达的降低(除DG区内分子层以外),以神经毯中SV2A的丢失最为严重[33]。Toering等[10]分析了6名局灶型脑皮质发育不良(FCD,ⅡB型)和6名复合型结节性硬化病人(TSC)标本中SV2A的表达。与正常组相比,FCD和TSC标本中SV2A总量表达降低。伴有癫痫的颅内肿瘤(50%~80%的胶质瘤病人合并癫痫)患者中,强阳性的SV2A IR弥散分布在正常皮质及瘤周,瘤区内以及肿瘤细胞周SV2A的表达则明显降低[34, 35]。以上结果均提示表达变化的SV2A可能导致递质释放异常进而促进癫痫发生。 5 结语
SV2A通过调节神经递质的释放继而维持着脑内兴奋性递质与抑制性递质的平衡。LEV与SV2A结合后恢复了正常的递质传递以及平衡中枢神经系统的兴奋性,因而推测LEV亦有可能用于改善其他病理条件下的神经系统疾病,如双向情感障碍以及Alzheimer病。已有研究显示给予遗忘型轻度认知障碍病人(aMCI)小剂量LEV降低海马兴奋性可以改善患者记忆扫描任务的能力,而这类病人则是AD的高危人群[36]。
关于SV2A在癫痫发作及癫痫发生之间的作用仍有许多问题值得探索,如SV2A介导LEV发挥抗癫痫作用的机制是什么?在不同癫痫模型中SV2A的表达调控机制是什么?随着神经递质释放的分子机制以及突触前膜可塑性研究的不断深入,这些问题将逐一得到解答。
| [1] | Mendoza-Torreblanca JG, Vanoye-Carlo A, Phillips-Farfan BV, et al. Synaptic vesicle protein 2A:basic facts and role in synaptic function. Eur J Neurosci, 2013, 38(11): 3529-3539. |
| [2] | Bajjalieh SM, Peterson K, Shinghal R, et al. SV2, a brain synaptic vesicle protein homologous to bacterial transporters. Science, 1992, 257(5074): 1271-1273. |
| [3] | Dong M, Liu H, Tepp WH, et al. Glycosylated SV2A and SV2B mediate the entry of botulinum neurotoxin E into neurons. Mol Biol Cell, 2008, 19(12): 5226-5237. |
| [4] | Schivell AE, Mochida S, Kensel-Hammes P, et al. SV2A and SV2C contain a unique synaptotagmin-binding site. Mol Cell Neurosci, 2005, 29(1): 56-64. |
| [5] | Yao J, Nowack A, Kensel-Hammes P, et al. Cotrafficking of SV2 and synaptotagmin at the synapse. J Neurosci, 2010, 30(16): 5569-5578. |
| [6] | Yao J, Bajjalieh SM. Synaptic vesicle protein 2 binds adenine nucleotides. J Biol Chem, 2008, 283(30): 20628-20634. |
| [7] | Bajjalieh SM, Frantz GD, Weimann JM, et al. Differential expression of synaptic vesicle protein 2 (SV2) isoforms. J Neurosci, 1994, 14(9): 5223-5235. |
| [8] | van Vliet EA, Aronica E, Redeker S, et al. Decreased expression of synaptic vesicle protein 2A, the binding site for levetiracetam, during epileptogenesis and chronic epilepsy. Epilepsia, 2009, 50(3): 422-433. |
| [9] | Ohno Y, Ishihara S, Terada R, et al. Preferential increase in the hippocampal synaptic vesicle protein 2A (SV2A) by pentylenetetrazole kindling. Biochem Biophys Res Commun, 2009, 390(3): 415-420. |
| [10] | Toering ST, Boer K, de Groot M, et al. Expression patterns of synaptic vesicle protein 2A in focal cortical dysplasia and TSC-cortical tubers. Epilepsia, 2009, 50(6): 1409-1418. |
| [11] | Gronborg M, Pavlos NJ, Brunk I, et al. Quantitative comparison of glutamatergic and GABAergic synaptic vesicles unveils selectivity for few proteins including MAL2, a novel synaptic vesicle protein. J Neurosci, 2010, 30(1): 2-12. |
| [12] | Bragina L, Fattorini G, Giovedi S, et al. Analysis of Synaptotagmin, SV2, and Rab3 Expression in Cortical Glutamatergic and GABAergic Axon Terminals. Front Cell Neurosci, 2011, 5: 32. |
| [13] | Crevecoeur J, Foerch P, Doupagne M, et al. Expression of SV2 isoforms during rodent brain development. BMC Neurosci, 2013, 14: 87. |
| [14] | Feany MB, Lee S, Edwards RH, et al. The synaptic vesicle protein SV2 is a novel type of transmembrane transporter. Cell, 1992, 70(5): 861-867. |
| [15] | Lynch BA, Matagne A, Brannstrom A, et al. Visualization of SV2A conformations in situ by the use of Protein Tomography. Biochem Biophys Res Commun, 2008, 375(4): 491-495. |
| [16] | Holyoake J, Sansom MS. Conformational Change in an MFS Protein: MD Simulations of LacY. Structure, 2007, 15(7): 873-884. |
| [17] | Nowack A, Yao J, Custer KL, et al. SV2 regulates neurotransmitter release via multiple mechanisms. Am J Physiol Cell Physiol, 2010, 299(5): C960-C967. |
| [18] | Custer KL, Austin NS, Sullivan JM, et al. Synaptic vesicle protein 2 enhances release probability at quiescent synapses. J Neurosci, 2006, 26(4): 1303-1313. |
| [19] | Riazanski V, Deriy LV, Shevchenko PD, et al. Presynaptic CLC-3 determines quantal size of inhibitory transmission in the hippocampus. Nat Neurosci, 2011, 14(4): 487-494. |
| [20] | Janz R, Sudhof TC. SV2C is a synaptic vesicle protein with an unusually restricted localization: anatomy of a synaptic vesicle protein family. Neuroscience, 1999, 94(4): 1279-1290. |
| [21] | Crowder KM, Gunther JM, Jones TA, et al. Abnormal neurotransmission in mice lacking synaptic vesicle protein 2A (SV2A). Proc Natl Acad Sci U S A, 1999, 96(26): 15268-15273. |
| [22] | Surges R, Volynski KE, Walker MC. Is levetiracetam different from other antiepileptic drugs? Levetiracetam and its cellular mechanism of action in epilepsy revisited. Ther Adv Neurol Disord, 2008, 1(1): 13-24. |
| [23] | Chang WP, Sudhof TC. SV2 renders primed synaptic vesicles competent for Ca2+ -induced exocytosis. J Neurosci, 2009, 29(4): 883-897. |
| [24] | Wan QF, Zhou ZY, Thakur P, et al. SV2 acts via presynaptic calcium to regulate neurotransmitter release. Neuron, 2010, 66(6): 884-895. |
| [25] | Xu T, Bajjalieh SM. SV2 modulates the size of the readily releasable pool of secretory vesicles. Nat Cell Biol, 2001, 3(8): 691-698. |
| [26] | Nowack A, Malarkey EB, Yao J, et al. Levetiracetam reverses synaptic deficits produced by overexpression of SV2A. PLoS One, 2011, 6(12): e29560. |
| [27] | Venkatesan K, Alix P, Marquet A, et al. Altered balance between excitatory and inhibitory inputs onto CA1 pyramidal neurons from SV2A-deficient but not SV2B-deficient mice. J Neurosci Res, 2012, 90(12): 2317-2327. |
| [28] | Lynch BA, Lambeng N, Nocka K, et al. The synaptic vesicle protein SV2A is the binding site for the antiepileptic drug levetiracetam. Proc Natl Acad Sci U S A, 2004, 101(26): 9861-9866. |
| [29] | Kaminski RM, Matagne A, Leclercq K, et al. SV2A protein is a broad-spectrum anticonvulsant target: functional correlation between protein binding and seizure protection in models of both partial and generalized epilepsy. Neuropharmacology, 2008, 54(4): 715-720. |
| [30] | Kaminski RM, Gillard M, Leclercq K, et al. Proepileptic phenotype of SV2A-deficient mice is associated with reduced anticonvulsant efficacy of levetiracetam. Epilepsia, 2009, 50(7): 1729-1740. |
| [31] | Noyer M, Gillard M, Matagne A, et al. The novel antiepileptic drug levetiracetam (ucb L059) appears to act via a specific binding site in CNS membranes. Eur J Pharmacol, 1995, 286(2): 137-146. |
| [32] | Ohno Y, Okumura T, Terada R, et al. Kindling-associated SV2A expression in hilar GABAergic interneurons of the mouse dentate gyrus. Neurosci Lett, 2012, 510(2): 93-98. |
| [33] | Feng G, Xiao F, Lu Y, et al. Down-regulation synaptic vesicle protein 2A in the anterior temporal neocortex of patients with intractable epilepsy. J Mol Neurosci, 2009, 39(3): 354-359. |
| [34] | de Groot M, Aronica E, Heimans JJ, et al. Synaptic vesicle protein 2A predicts response to levetiracetam in patients with glioma. Neurology, 2011, 77(6): 532-539. |
| [35] | de Groot M, Toering ST, Boer K, et al. Expression of synaptic vesicle protein 2A in epilepsy-associated brain tumors and in the peritumoral cortex. Neuro Oncol, 2010, 12(3): 265-273. |
| [36] | Bakker A, Krauss GL, Albert MS, et al. Reduction of hippocampal hyperactivity improves cognition in amnestic mild cognitive impairment. Neuron, 2012, 74(3): 467-474. |
 2014, Vol. 41
2014, Vol. 41