扩展功能
文章信息
- 吕欣欣, 张瑞雪, 唐吉友
- LV Xin-Xin, ZHANG Rui-Xue, TANG Ji-You
- 细胞外信号调节激酶1/2与Rho激酶作用对脑梗死后神经血管单元的影响
- Regulatory effect of interaction between extracellular signal-regulated kinase 1/2 and Rho-associated kinase on neurovascular unit after cerebral infarction
- 国际神经病学神经外科学杂志, 2014, 41(3): 221-226
- Disease Surveillance, 2014, 41(3): 221-226
-
文章历史
- 收稿日期:2014-03-04
- 修回日期:2014-05-27
2. 山东大学, 山东省济南市 250000;
3. 山东大学附属千佛山医院神经内科, 山东省济南市 250000
脑梗死因具有极高的致死率和致残率已成为研究的焦点。目前,脑梗死的治疗的主要措施是静脉溶栓恢复缺血区的血流[1],因溶栓存在严格的时间窗限制和溶栓后再出血的风险,所以临床应用中受到一定的限制,因此迫切需要寻求一种更有效的治疗脑梗死的方法。以细胞信号通路为基础的神经保护是一种治疗脑梗死的有效措施,Rho激酶(Rho-associated kinase,ROCK)和细胞外信号调节激酶1/2(extracellular signal regulated kinase1/2,ERK1/2)介导的信号通路通过参与调节脑梗死后神经细胞的生长,在脑梗死后神经保护中发挥重要的作用。聚腺苷二磷酸核糖聚合酶-1(poly ADP ribose polymerase-1,PARP-1)作为ERK1/2和ROCK共同的下游靶点蛋白,是神经血管单元各成分中细胞生长调控的关键效应蛋白。因此,探讨ERK1/2、ROCK对其下游靶点蛋白PARP-1的表达的调控及其具体机制,对临床脑梗死的神经保护治疗具有重要的指导意义。 1 材料和方法 1.1 材料 1.1.1 实验动物与分组
健康雄性SD大鼠(体重250~300 g),由山东中医药动物实验中心提供。本实验分两个部分,一、SD雄性大鼠35只,体重250~300 g,随机分为假手术组(S),脑梗死组(M)。各组根据不同的时间点分为1 h、3 h、12 h、24 h、3 d和7 d共6个亚组,每组5只。二、SPF级雄性SD大鼠35只,随机分为对照组(S),模型组(M),U0126组(U),Fasudil组(F),U0126+Fasudil(U+F)组,每组8只大鼠。 1.1.2 主要试剂
兔抗大鼠多克隆磷酸化ERK1/2抗体、兔抗大鼠多克隆总ERK1/2抗体(cell signaling,USA),山羊抗大鼠多克隆ROCK抗体(Santa cruz,USA),兔抗大鼠多克隆PARP-1抗体(abcam,Britain),ERK1/2受体阻断剂U0126(selleck,USA),ROCK阻断剂Fasudil(法舒地尔,碧云天生物有限公司),TTC染色剂(sigma,USA)。 1.2 方法 1.2.1 大脑中动脉模型的制作
雄性SD大鼠,体重约280~300 g,10%水合氯醛0.3 ml/kg腹腔注射麻醉。根据Zea-longa改良线栓法[2]制作右侧大脑中动脉缺血模型:依此分离颈总、颈内及颈外动脉,结扎颈外动脉及颈总动脉近心端,动脉夹夹闭颈内动脉远端,一根头端沾有硅胶的鱼线从颈总动脉近分叉处缓慢插入颈内动脉,直到略感阻力,即大脑中动脉和大脑前动脉分叉处,进线18±0.5 mm。整个实验保持大鼠体温37±0.5℃。对照组进行相同手术,但不插线,其余步骤同制作大脑中动脉模型。 1.2.2 干预措施
对照组、模型组、U0126组、Fasudil组、U0126+Fasudil组分别在模型制作前30 min及造模后12 h给予大鼠尾静脉注射DMSO、DMSO、ERK1/2抑制剂U0126(30 mg/kg[3])、ROCK抑制剂Fasudil(10 mg/Kg[4])、联合应用抑制剂U0126+Fasudil。 1.2.3 神经功能评分
术后24 h进行大鼠神经功能评分,依据评分标准[2]:0分:无神经功能缺损;1分:提尾时,大鼠脑梗死对侧(左侧)前爪不能伸展;2分:对侧前爪(左侧)抓地力下降;3分:大鼠自发向跟各方向转圈,提尾时向对侧(左侧)转圈;4分:大鼠自发向对侧(左侧)转圈;5分:大鼠昏迷或死亡。 1.2.4 TTC染色
大鼠行神经功能评分后,在10%的水合氯醛麻醉下断头取脑,-20℃冰箱冷冻10 min后连续冠状切片(厚2.0 mm,6片),TTC(2%,由1%PBS配制)37℃恒温箱中避光染色30 min后置于多聚甲醛溶液中固定24 h,切片在蓝色背景下进行正反两面拍照,image-plus图像处理软件计算脑梗死面积。 1.2.5 western blot检测
评分后断头取脑,分离右侧大脑皮质,取100 mg大脑皮质溶解于1 ml RIPA(细胞裂解液)+10 μl PMSF(蛋白酶抑制剂)(碧云天生物有限公司,中国)混合溶液中,然后碾磨、离心、取上清、测蛋白浓度(蛋白浓度测定盒(BCA),碧云天生物有限公司,中国)。蛋白浑浊液和上样缓冲液按5∶[DK)]1混合后95℃变性5 min,取50 μg蛋白样品上样,凝胶电泳、280 mA恒流下转移到PVDF膜上、在5%脱脂奶粉中封闭1 h,然后加一抗[抗磷酸化ERK1/2(1∶[DK)]1000)、总ERK1/2(1∶[DK)]1000)、ROCK(1∶[DK)]200)、PARP-1(1∶[DK)]200)、GAPDH(1∶[DK)]1000)抗体]孵育4℃过夜,二抗(1∶[DK)]5000)常温孵育1 h,ECL(Millipore,USA)发光试剂盒检测蛋白浓度,Image J图像处理软件分析灰度值。 1.3 统计学分析
计量资料用平均数±标准差(x[TX-*5]±s)表示,采用SPSS 17.0统计软件进行分析,多组间比较采用单因素方差分析,两组间比较应用LSD-Post Hoc检验。P<0.05表示差异有统计学意义。 2 结果 2.1 脑梗死后各时间点ERK1/2和ROCK在缺血侧大脑皮质的表达变化
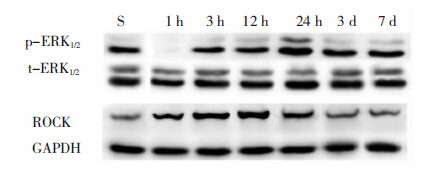
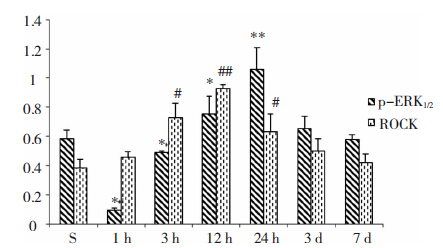
脑梗死后各时间点的总ERK1/2表达不变,而磷酸化的ERK1/2(p-ERK1/2)随时间的延长表达逐渐升高,24 h时达最高峰(P<0.01),随后ERK1/2的磷酸化水平逐渐降低。与假手术组相应时间点比较(由于假手术组各亚组蛋白表达相同,下面图 1中用S组表示假手术组各个时间点蛋白水平),脑梗死组1 h、3 h p-ERK1/2的活性显著降低(P<0.05),12 h、24 h ERK1/2的磷酸化水平明显高于假手术组(P<0.05),24 h磷酸化水平脑梗死后3 d和7 d p-ERK1/2蛋白的水平仍高于假手术组(P<0.05)。见图 1、图 2。
|
| 图 1 脑梗死后不同时间点ERK1/2和ROCK的表达变化。 |
|
| 图 2 脑梗死后不同时间点ERK1/2和ROCK的表达变化。*和**为与对照组相比,p-ERK1/2的表达先降低后升高再降低(P<0.05;P<0.01),ROCK的表达先升高后降低(#P<0.05;##P<0.01)。 |
脑梗死后不同时间点ERK1/2和ROCK的表达变化。*和**为与对照组相比,p-ERK1/2的表达先降低后升高再降低(P<0.05;P<0.01),ROCK的表达先升高后降低(#P<0.05;##P<0.01)。 2.2 脑梗死后24 h不同组间神经功能评分
脑梗死后24 h神经功能评分,与对照组相比,模型组、U0126组、Fasudil组及U0126+Fasudil神经功能评分增加,有统计学意义(P<0.05)。与模型组相比,U0126组及Fasudil组神经功能评分降低(P<0.05;P<0.05),U0126+Fasudil组神经功能评分明显降低(P<0.01)。与U0126组或Fasudil组相比,U0126+Fasudil组神经功能评分降低具有统计学意义(P<0.05)。见表 1。
| S | M | F | U | U+F | |
| 神经功能评分 | 0 | 2.6±0.5# | 1.9±0.6#* | 2.1±0.6#* | 1.4±0.5#**+& |
| 注:#为与对照组相比,P<0.05;*为与模型组相比,P<0.05;**为与模型组相比,P<0.01;+为与F相比,P<0.05;&为与U组相比,P<0.05。 | |||||
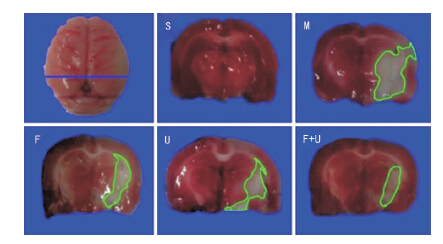
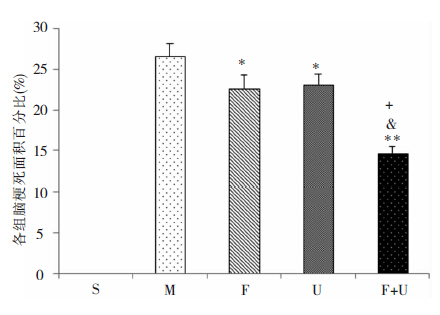
脑梗死面积的测定结果显示,对照组染色未见脑梗死;模型组脑梗死面积占整个脑组织面积比例为26.6±1.5;与模型组相比,U0126组、Fasudil组脑梗死面积较模型组明显减小(P<0.05),分别为23.1±1.3和22.6±1.7;U0126+Fasudil组脑梗死面积为为14.6±0.9,显著低于模型组(P<0.05)、U0126组(P<0.05)及Fasudil组(P<0.05)。见图 3、图 4。
|
| 图 3 TTC染色示,红色为正常组织,白色为梗死部分。 |
|
| 图 4 各组脑梗死面积百分比比较。*和**为与MCAO组相比,P<0.05,P<0.01;+为与Fasudil组相比,P<0.05;&为与U0126组相比,P<0.05。 |
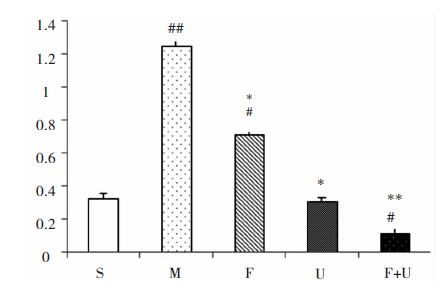
脑梗后24 h模型组p-ERK1/2表达与对照组相比明显增加(P<0.01);Fasudil组p-ERK1/2的表达较模型组下降,仍高于对照组(P<0.05);U0126组p-ERK1/2的表达较模型组显著下降(P<0.05),与对照组相当(P>0.05);U0126+Fasudil组与对照组相比,p-ERK1/2的表达显著减低(P<0.05)。见图 5、图 6。

|
| 图 5 U0126及Fasudil对脑梗死后p-ERK1/2表达的影响。 |
|
| 图 6 与S组相比,#P<0.05,##P<0.01;与MCAO组相比,**P<0.01,*P<0.05。 |
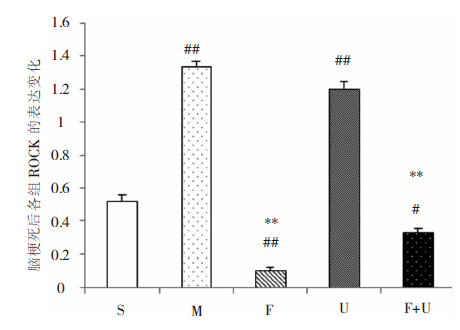
与对照组相比,模型组ROCK的表达上升(P<0.05);应用Fasudil后,ROCK的表达显著降低,低于对照组(P<0.05);U0126组ROCK的表达与模型组相比差异无统计学意义(P>0.05);Fasudil+U0126组ROCK的表达与模型组相比明显降低(P<0.05),与Fasudil组相比差异无统计学意义(P>0.05)。见图 7、图 8。

|
| 图 7 U0126及Fasudil对脑梗死后ROCK表达的影响。 |
|
| 图 8 U0126及Fasudil对脑梗死后ROCK表达的影响。#和##为与S组相比,P<0.05,P<0.01;**和*为与MCAO组相比,P<0.01,P<0.05。 |
脑梗后24 h模型组PARP-1的表达量增多,与对照组相比显著提高(P<0.05);Fasudil组及U0126组与模型组相比,PARP-1的表达均降低(P<0.05,P<0.05);Fasudil+U0126组PARP-1的表达量最低,与单独应用Fasudil或U0126组相比有显著差异(P<0.05)。见图 9、图 10。

|
| 图 9 U0126及Fasudil对脑梗死后PARP-1表达的影响。 |

|
| 图 10 U0126及Fasudil对脑梗死后PARP-1表达的影响。#和##为与S组相比,P<0.05,P<0.01;**和*为与MCAO组相比,P<0.01,P<0.05;++为与Fasudil组相比,P<0.01;&为与U0126组相比,P<0.05。 |
ERK1/2是细胞内重要的信号调节激酶,参与细胞的生长、增殖及分化过程,并且在中枢神经系统中广泛表达,调节神经细胞对外界刺激信号的反应。ERK1/2激活具有双重作用,既能够调节细胞生长,也可以诱导细胞死亡[5]。一方面ERK1/2通过介导基质金属蛋白酶(MMP-9)和组织蛋白酶组织抑制因子(TIMP-1)及炎症因子的表达,加重脑缺血损伤[3, 6, 7]。另有研究表明槐定碱(sophoridine)及Dex能够上调ERK1/2的表达进而减轻脑水肿、神经坏死以及减少梗死体积[8, 9]。我们的研究采用永久性大脑中动脉缺血模型,结果显示,p-ERK1/2的表达在脑梗死早期下降,脑梗死后24 h明显增加,U0126能够阻断p-ERK1/2的激活,降低脑梗死面积,改善神经功能。由此我们推断在脑梗死早期ERK1/2的表达上调,有助于保护脑缺血急性期神经功能损伤,在脑梗死后期,p-ERK1/2的过表达反而加重神经功能损伤,因此阻断此通路对脑梗死有保护意义。
Rho/ROCK信号通路通过调节细胞肌动蛋白微丝骨架的聚合状态,调控细胞黏附、迁移、增殖与凋亡。前期实验发现缺血后6 h ROCK底物P-内收蛋白(P-adducin)在缺血区表达明显增加[10]。RhoA蛋白破坏轴突生长锥,损伤神经的恢复[11]。ROCK通过降低一氧化氮合酶(eNOS)的表达影响血管舒张[12]、调节急性缺血后的炎症反应、破坏血脑屏障[13]参与脑梗死的发生和发展过程。我们的实验显示,脑梗死后ROCK的表达升高,在脑梗死后12 h ROCK的表达达高峰,持续一段时间后下降,可能因为我们的实验采用的是永久性脑梗死模型,所以ROCK表达变化在时间上存在一定的差异,本实验应用ROCK阻断剂,显著降低神经功能损伤,与之前的研究相一致[4, 12, 14]。ROCK通过以上多条途径参与脑梗死后神经血管的损伤,因此,早期应用ROCK阻断剂对脑梗死的治疗有一定的临床意义。
ERK1/2和ROCK这两条信号通路同时参与地塞米松诱导去甲肾上腺素介导的血管平滑肌收缩、前列环素PGE2调节细胞表面趋化因子7抗体表达介导人类单核细胞的迁移[15, 16]。血管紧张素Ⅱ诱导肠系膜上动脉的收缩和血小板生长因子(PDGF)介导恶性胶质瘤的增殖的过程都通过ERK1/2介导,这种作用均可以被ROCK阻断剂Y-27632阻断,推测ROCK可能是ERK1/2的上游分[17, 18]。我们的研究也证明了ERK1/2很可能作为ROCK的下游效应分子,参与到脑梗死后信号通路的调控。
脑缺血后,一系列NO自由基和超氧自由基引起DNA断裂,诱导PARP-1过度表达,通过消耗NAD+和促进线粒体释放细胞凋亡诱导因子(apoptosis-inducing factor,AIF)及调控的炎症基因表达促进细胞死亡。脑缺血后过度激活PARP-1介导的细胞毒性存在于神经血管单元的各成分中,虽然刺激PARP-1激活的因子种类、发生的时间及作用机制不同,但最终导致神经血管单元各组成部分的功能紊乱及细胞毒性将直接或间接影响神经元的功能[19]。抑制缺血半暗带区PARP-1的激活,可以显著减少脑梗死面积,改善神经功能[20]。本研究发现:ERK1/2阻断剂及ROCK阻断剂都能够降低PARP-1的表达,减少脑梗死面积,提高神经功能评分,说明ERK1/2和ROCK这两条信号通路都通过PARP-1发挥脑梗死后的调控作用。并且已有研究显示PARP-1上有ERK1/2直接磷酸化位点[21],关于ROCK如何通过PARP-1发挥作用需进一步研究。
总之,脑缺血后,ERK1/2和ROCK通过介导炎症因子的激活、细胞因子诱导的细胞外基质蛋白酶表达等途径,导致包括神经元、血脑屏障、胶质细胞、细胞外基质等结构的神经血管单元损伤,同时ERK1/2作为ROCK的下游效应分子,与ROCK共同调节PARP-1的表达进而调控脑梗死后神经血管单元的存亡。
| [1] | Montaño A, Staff I, McCullough LD, et al. Community implementation of intravenous thrombolysis for acute ischemic stroke in the 3to 4.5hour window. Am J Emerg Med, 2013, 31(12): 1707-1709. |
| [2] | Menzies SA, Hoff JT, Betz AL. Middle cerebral artery occlusion in rats: a neurological and pathological evaluation of a reproducible model. Neurosurgery, 1992, 31(1): 100-106. |
| [3] | Maddahi A, Chen Q, Edvinsson L, et al. Enhanced cerebrovascular expression of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 via the MEK/ ERK pathway during cerebral ischemia in the rat. BMC Neurosci, 2009, 10(11): 56-68. |
| [4] | Yamashita K, Kotani Y, Nakajima Y, et al. Fasudil, a Rho kinase (ROCK) inhibitor, protects against ischemic neuronal damage in vitro and in vivo by acting directly on neurons. Brain Res, 2007, 1154: 215-224. |
| [5] | Sawe N, Steinberg G, Zhao H. Dual roles of the MAPK/ERK1/2 cell signaling pathway after stroke. J Neurosci Res, 2008, 86(8): 1659-1669. |
| [6] | Maddahi A, Edvinsson L. Cerebral ischemia induces micro vascular pro-inflammatory cytokine expression via the MEK/ERK pathway. J Neuroinflammation, 2010, 7(1): 14. |
| [7] | Wang ZQ, Chen XC, Yang GY, et al. U0126 prevents ERK pathway phosphorylation and interleukin-1beta mRNA production after cerebral ischemia. Chin Med Sci J, 2004, 19(4): 270-275. |
| [8] | Liu Z, He D, Zhang X, et al. Neuroprotective effect of early and short-time applying sophoridine in pMCAO rat brain: Down-regulated TRAF6 and up-regulated p-ERK1/2 expression, ameliorated brain infaction and edema. Brain Res Bull, 2012, 88(4): 379-384. |
| [9] | Zhu YM, Wang CC, Chen L, et al. Both PI3K/Akt and ERK1/2 pathways participate in the protection by dexmedetomidine against transient focal cerebral ischemia/reperfusion injury in rats. Brain Res, 2013, 1494: 1-8. |
| [10] | Yagita Y, Kitagawa K, Sasaki T, et al. Rho-kinase activation in endothelial cells contributes to expansion of infarction after focal cerebral ischemia. J Neurosci Res, 2007, 85(11): 2460-2469. |
| [11] | Niu L, Zhou J, Huang Y, et al. db-Cyclic adenosine monophosphate promotes axon regeneration and motor function recovery in cerebral ischemia-reperfusion rats. Neurol India, 2010, 58(2): 195-200. |
| [12] | Rikitake Y, Kim H H, Huang Z, et al. Inhibition of Rho Kinase (ROCK) Leads to Increased Cerebral Blood Flow and Stroke Protection. Stroke, 2005, 36(10): 2251-2257. |
| [13] | Yamamoto M, Ramirez SH, Sato S, et al. Phosphorylation of Claudin-5 and Occludin by Rho Kinase in Brain Endothelial Cells. Am J Patholo, 2008, 172(2): 521-533. |
| [14] | Shin HK, Salomone S, Ayata C. Targeting cerebrovascular Rho-kinase in stroke. Expert Opin Ther Targets, 2008, 12(12): 1547-1564. |
| [15] | Zhang T, Shi WL, Tasker JG, et al. Dexamethasone induces rapid promotion of norepinephrine-mediated vascular smooth muscle cell contraction. Mol Med Rep, 2013, 7(2): 549-554. |
| [16] | Allaire MA, Dumais N. Involvement of the MAPK and RhoA/ROCK pathways in PGE2-mediated CCR7-dependent monocyte migration. Immunol Lett, 2012, 146(1-2): 70-73. |
| [17] | Zohrabian VM, Forzani B, Chau Z, et al. Rho/ROCK and MAPK signaling pathways are involved in glioblastoma cell migration and proliferation. Anticancer Res, 2009, 29(1): 119-123. |
| [18] | Jo M. Cooperativity between the Ras-ERK and Rho-Rho Kinase Pathways in Urokinase-type Plasminogen Activator-stimulated Cell Migration. J Biolog Chem, 2002, 277(14): 12479-12485. |
| [19] | Moroni F, Chiarugi A. Post-ischemic brain damage: targeting PARP-1 within the ischemic neurovascular units as a realistic avenue to stroke treatment. FEBS J, 2009, 276(1): 36-45. |
| [20] | Lee JH, Park SY, Shin HK, et al. Poly(ADP-ribose) polymerase inhibition by cilostazol is implicated in the neuroprotective effect against focal cerebral ischemic infarct in rat. Brain Res, 2007, 1152: 182-190. |
| [21] | Kauppinen TM. Direct phosphorylation and regulation of poly(ADP-ribose) polymerase-1 by extracellular signal-regulated kinases 1/2. Proc Nat Acad Sci, 2006, 103(18): 7136-7141. |
 2014, Vol. 41
2014, Vol. 41


