扩展功能
文章信息
- 尹波, 黄纯海, 王苟思义, 王非一凡, 叶宁荣, 李钊, 桑树山, 李学军
- Yin Bo, Huang Chun-hai, Wanggou Si-yi, Wangfei Yi-fan, Ye Ning-rong, Li Zhao, Sang Shu-shan, Li Xue-jun
- VE-statin/Egfl7-siRNA抑制恶性胶质瘤诱导内皮细胞血管生成能力的体外研究
- Inhibitory effect of VE-statin/Egfl7-siRNA on angiogenesis of endothelial cells induced by malignant glioma in vitro
- 国际神经病学神经外科学杂志, 2014, 41(3): 193-197
- Disease Surveillance, 2014, 41(3): 193-197
-
文章历史
- 收稿日期:2014-04-07
- 修回日期:2014-06-28
2. 湖南常德澧县人民医院神经外科, 湖南 常德 415500;
3. 吉首大学第一附属医院神经外科, 湖南 吉首 416000
2. Department of Neurosurgery, Lixian People's Hospital, Changde 415500, China;
3. Department of Neurosurgery, The First Affiliated Hospital, Jishou University, Jishou 416000, China.
脑胶质瘤是由神经外胚叶衍化而来的胶质细胞发生的恶性肿瘤,发病率占颅内肿瘤的第一位。虽然近年医学技术取得了令人瞩目的进步,但是恶 性胶质瘤患者的预后并没得到多大改观,其平均生 存期仍然只有12~15个月。胶质瘤的生长及侵袭 依赖于血管形成,持续的血管增殖被认为是胶质瘤 一个重要的恶性特征[1],肿瘤血管生成的机制复 杂,寻找具有调控血管生成的关键性靶点具有重要 的意义。类表皮生长因子域7(Epidermal growth factor-like domain7,VE-statin/Egfl7)是新近发现的内 皮细胞源性血管生成调控因子,在胚胎发育过程中 高表达,在胚胎血管发育的管状形成过程中起着关 键性调控作用。它在成人除肺、卵巢、子宫等富血 管组织外的大部分组织中不表达或弱表达[2]。继 Wu等[3]及本课题组[4]分别发现VE-statin/Egfl7在 肝癌和恶性胶质瘤中存在高水平表达后,越来越多 的证据显示VE-statin/Egfl7基因在多种人类恶性 肿瘤中被重新激活。本研究拟进一步采用小RNA 干扰技术(Small interfering RNA,siRNA)体外研究 VE-statin/Egfl7在胶质瘤血管生成中的作用,阐明 VE-statin/Egfl7的在胶质瘤中表达的作用和机制。 1 材料与方法 1.1 细胞培养
人脐静脉内皮细胞株HUVEC及人脑星型胶质细胞瘤细胞株U251(来源于多形性胶质母细胞瘤WHO IV级)均购自中南大学湘雅中心实验室细胞库。加入含12%胎牛血清的RMPI 1640培养基于37℃和5%二氧化碳的温箱中培养。 1.2 主要仪器和试剂
Trizol购自美国intrivogen公司。RT-PCR相关试剂均购自TAKARA公司。胎牛血清、RMPI 1640培养基及Opti-MEM等为GIBCO产品。MTT、结晶紫为Sigma产。Plasmid大抽Kit为QIAGEN生产。引物由上海吉凯基因合成。荧光显微镜为奥林帕斯公司产。SDS-PAGE蛋白电泳仪及蛋白转膜仪为上海天能产。倒置相差显微镜为Nikon TMS-F。Transwell培养板购于美国Costar。多孔培养板购于美国Corning公司。 1.3 实验方法 1.3.1 U251-HUVEC共培养及实验分组
用Transwell培养技术建立U251-HUVEC共培养系统:将Transwell小室放入24孔培养板中,小室底层有一张通透性的聚碳酸酯膜。将HUVEC和U251细胞分别种在上下室内,由于聚碳酸酯膜有通透性,上下层培养液中的成分可以互相交换,从而可以研究上下层细胞之间相互作用。聚碳酸酯膜的孔径若小于3.0 μm,细胞不能通过但细胞分泌的物质可以通过,常用0.4 μm。若膜的孔径大于3.0 μm则上室的细胞在下室细胞的趋化作用下会穿过此孔向下迁移。实验分组:①正常阴性对照(CC),即正常培养未加任何干预措施。②含普适性阴性对照序列(NC)的慢病毒感染U251和HUVEC细胞。③含VE-statin/Egfl7-siRNA有效靶点序列(KD)的慢病毒感染U251和HUVEC细胞。 1.3.2 VE-statin/Egfl7-siRNA慢病毒载体构建及感染U251及HUVEC
前期本课题组已成功筛选出VE-statin/Egfl7基因RNA干扰的有效靶点。VE-statin/Egfl7-siRNA慢病毒载体构建及感染细胞方法见参考文献[5, 6]。 1.3.3 HUVEC增殖能力检测(MTT法)
收集对数期细胞,调整细胞悬液浓度,细胞培养用24孔板,膜孔径0.4 μm。下室接种U251,每孔1×105个;上室接种HUVEC,每孔200 μl,含细胞数6×103个/孔;置37℃、5%CO2温箱分开培养;待两种细胞均融合达30%以上时进行共培养,并按实验分组要求进行慢病毒感染,继续培养;培养后24 h、48 h、72 h、96 h、5 d行MTT检测;小心吸去上清,加入480 μl新鲜RPMI 1640培养液,再加入120 μl 0.5%MTT溶液,继续培养4 h;然后吸掉上清,将聚碳酸酯膜取下置入96孔板中,每孔加入150 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,弃聚碳酸酯膜;同时设置调零孔(二甲基亚砜),每组设定5复孔;选择492 nm波长,在酶标仪上测定各孔光密度(optical density,OD)值。 1.3.4 HUVEC粘附及迁移能力检测(结晶紫法)
按1.3.3准备细胞及感染病毒。感染慢病毒72 h后,收集HUVEC接种于上室,膜孔径0.4 μm,膜的上面经鼠尾胶原包被用于粘附实验,每孔200 μl,含细胞数2×104个/孔;测定前,将各实验组上室置入新的24孔板中,每孔加0.6 ml 33%醋酸脱色,充分振荡,每组设定5复孔;同时设置调零孔(33%醋酸);每孔取脱色液150 μl加入96孔板中,在570 nm处测定OD值。细胞迁移实验用的膜孔径为8.0 μm,上室内HUVEC接种为每孔200 μl,含细胞数1×105个/孔,培养24 h后测定迁移细胞数;吸去培养液,用棉签轻轻擦除上室聚碳酸酯膜内侧面贴壁细胞,用0.01 MPBS漂洗两次,4%多聚甲醛固定10 min;后续结晶紫染色步骤同粘附实验。 1.3.5 HUVEC体外成管能力检测
取7倍体积的鼠尾胶原,1倍体积的10×RMP 1640培养基,1倍体积的0.1 N氢氧化钠和1倍体积的胎牛血清,在冰盒上无菌小瓶内迅速混匀,调pH值至7.4左右; 收集对数期细胞用24孔板培养,膜孔径0.4 μm。调整细胞悬液浓度,先在下室接种HUVEC,每孔4×104个,上室接种U251细胞,4×104个/孔,进行共培养,如前所述进行慢病毒感染;置37℃、5%CO2温箱培养;待HUVEC细胞近100%融合汇集成单细胞层后吸除培养液;将配制好的胶原凝胶加入下室覆盖HUVEC层,每孔300 μl;于37℃、5%CO2温箱继续培养,观察HUVEC的管状结构形成情况。 1.4 统计分析
用SPSS 13.0统计分析软件包处理数据,数据以x±s表示,检验水准a=0.05。根据数据资料的特征,采用单因素方差分析,SNK-q检验进行两两间显著性分析。图像分析采用Image-Pro Plus 6.0软件。 2 结果 2.1 慢病毒瞬转U251和HUVEC细胞株
含靶向VE-statin/Egfl7基因的siRNA序列的慢病毒表达载体感染U251及HUVEC细胞48小时后,在倒置相差荧光显微镜下可见感染细胞发出强烈的绿色荧光,感染率﹥80%,而对照组因未感染慢病毒故不发出荧光。实时荧光定量PCR检测结果显示实验组与对照组相比,两种细胞的VE-statin/Egfl7表达抑制率均﹥80%以上。 2.2 HUVEC增殖活性的变化
加入MTT后活细胞生成紫蓝色的针状结晶。用二甲基亚砜(DMSO)溶解后在酶标仪上测定各孔OD值。KD组HUVEC在48 h后增殖能力明显低于两对照组,此状态一直持续至第4 d(P<0.01);第5 d时又恢复至对照组水平(P>0.05)。CC组与NC组无明显差异(P>0.05)。见图a~c。
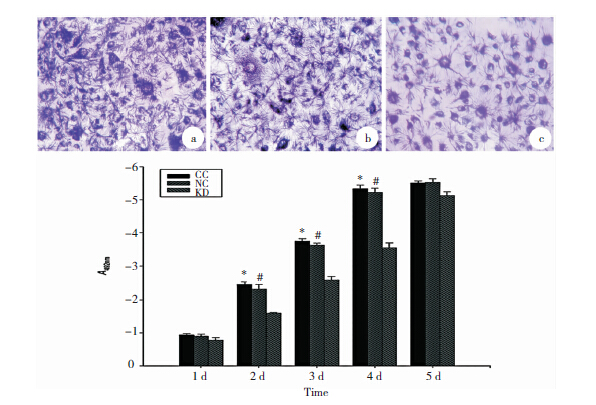
|
| 图 1 VE-statin/Egfl7-siRNA对HUVEC细胞增殖能力的影响 a~c:KD组HUVEC在48 h后增殖能力明显低于两对照组,此状态一直持续至第4 d(P<0.01);第5 d时又恢复至对照组水平(P>0.05)(*,#对比KD组,q=20.023,16.686;29.009,26.034;30.549,28.672,P<0.01)。(a)代表HUVEC细胞的正常阴性对照组,(b)代表普适应性阴性对照序列的慢病毒感染HUVEC细胞,(c)代表含VE-statin/Egfl7-siRNA有效靶点序列的慢病毒感染HUVEC细胞。 |
在CC及NC两组中,接种30 min后其结晶紫OD值分别为0.850±0.033和0.823±0.036,均明显高于KD组(0.406±0.027),表明VE-statin/Egfl7 siRNA可明显抑制HUVEC的粘附性(q=30.816,28.942,P<0.01);但24 h时检测三组细胞迁移无显著差异,表明VE-statin/Egfl7 siRNA对HUVEC的迁移能力无明显影响(P>0.05)。 2.4 HUVEC成管能力的变化
加入鼠尾胶原6 h后,CC及NC组均可见HUVEC细胞出现变形,大多呈长梭形,伸出较长的伪足。与未加胶的普通HUVEC培养相比,细胞伸展,胞体变成细长形。随着培养时间的延长,变形的细胞不断运动,并逐渐出现纵轴一致的群集性现象。24 h后已可见明显的单层HUVEC围成的毛细血管管腔样结构,并逐渐增加。3 d后管腔结构仍较明显。与两对照组相比,KD组一直未见管状结构形成。采集24 h的图像经Image-Pro Plus 6.0量化分析后发现,CC及NC组管状结构相对面积分别为0.599±0.052和0.587±0.036;管型数分别为25.20±2.51和23.8±2.32,KD组均为0。两组间相比无明显差异(P>0.05)。 3 讨论
如其它实体性肿瘤一样,胶质瘤的生长高度依赖持续的血管生成。本课题组在前期研究中发现[4]VE-statin/Egfl7在人脑恶性胶质瘤血管内皮细胞及肿瘤细胞中均存在高水平表达,并且与肿瘤的恶性程度、增殖及血管新生有着密切的正相关性。用免疫组化及实时荧光定量PCR检测到人源多形性胶质母细胞株U251也存在该基因的高表达,这表明VE-statin/Egfl7非内皮细胞特异性分泌,胶质瘤细胞也可合成该蛋白,但它的作用及分子机制尚不太清楚。本研究通过transwell技术建立了U251与HUVEC的共培养系统,从而在体外构建胶质瘤细胞与内皮细胞相互作用与影响的微生态环境,以单独分析特定因子VE-statin/Egfl7的作用及机制。前期本课题组采用小RNA干扰技术构建了靶向VE-statin/Egfl7基因的短发夹结构RNA慢病毒绿色荧光蛋白表达载体,对HUVEC及U251细胞的VE-statin/Egfl7基因可产生显著特异性的沉默作用[5, 6]。在此基础上,本研究旨在进一步在体外探索VE-statin/Egfl7在恶性胶质瘤诱导内皮细胞血管生成中的作用和机制,结果发现沉默VE-statin/Egfl7基因表达后,HUVEC生长亦出现暂时性减缓,但很快恢复正常增殖状态,而且内皮细胞的迁移能力亦不受影响,但是内皮细胞的粘附能力明显受到抑制;成管实验发现,VE-statin/Egfl7基因沉默后内皮细胞不能形成毛细血管样结构。结果提示VE-statin/Egfl7可通过调节内皮细胞的粘附性而在胶质瘤血管生成过程的血管管腔化中起着关键性调控作用。
VE-statin/Egfl7是新一发现的血管活性因子,在生理或病理性血管生成中VE-statin/Egfl7可重新被激活而参与血管生成[7],这也提示在某些血管依赖性的恶性肿瘤中它的表达可能被重新激活,在肿瘤的抗血管生成治疗中是一极具潜在价值的靶点,因而近三年VE-statin/Egfl7与肿瘤发生发展的相关性研究备受重视。除了在胶质瘤中,研究表明VE-statin/Egfl7在人体多种恶性肿瘤中存在表达,并促进肿瘤的侵袭和转移能力,且与预后不良相关[8, 9, 10]。自从Folkman提出了肿瘤生长血管依赖性理论,指出肿瘤血管生成是肿瘤迅速成长、侵袭和转移的关键。血管新生是肿瘤侵袭和转移的前提和基础这一观点已取得共识且为大量研究所证实。本研究表明VE-statin/Egfl7可通过调节胶质瘤的血管生成能力,在促进脑胶质瘤的恶性进展中发挥作用,该研究进一步阐明了VE-statin/Egfl7在人脑恶性胶质瘤中高水平表达的意义和机制。VE-statin/Egfl7在人脑胶质瘤恶性化特征中的分子机制尚未检索到相关报道。但有研究发现[3]VE-statin/Egfl7通过激活EGFR增加局部粘着斑激酶(FAK)的磷酸化水平,而促进内皮细胞的迁移及肝癌的转移。在果蝇中VE-statin/Egfl7与整合素配体Talin形成复合体而调节整合素αPS2βPS的活性[11],整合素与Talin的结合可以激活FAK信号通路。人体中该基因在细胞外基质与整合素αvβ3结合,参与血管形成[12]。在胚胎血管发育及血管损伤修复时,VE-statin/Egfl7的功能主要是在脉管发育过程中管状结构的形成中起着关键作用。其主要作用机制可能与调节血管内皮细胞的群集性迁移和时空排列相关[13]。在本研究中发现VE-statin/Egfl7基因沉默后,恶性胶质瘤细胞株U251诱导的HUVEC血管生成能力明显受到抑制,并影响HUVEC的粘附性,表明VE-statin/Egfl7参与胶质瘤血管生成调控是其作用机制之一。
生理及病理性血管生成中,内皮细胞迁移是重要的一个步骤,但本研究并没发现如实验前所预期VE-statin/Egfl7影响内皮细胞的迁移能力,而是在沉默VE-statin/Egfl7基因表达后发现单个HUVEC迁移能力并无明显的改变。分析其原因,VE-statin/Egfl7在血管生成中主要是调节内皮细胞的群集性迁移即血管出芽,而并不是增加单个内皮细胞的迁移能力,在多细胞器官中,尽管各种细胞能够单独迁移,但是通常细胞都是呈群集性迁移的[13]。Schmidt等[14]研究表明VE-statin/Egfl7对单个内皮细胞的迁移没有影响,它主要是通过给邻近的内皮细胞传递位置信息而影响内皮细胞的群集性迁移。当VE-statin/Egfl7表达缺失时,新形成的内皮细胞粘附于其它内皮细胞的基底侧出现局部异常的内皮细胞堆积,而不是与其邻近内皮细胞呈面对面沿血管出芽迁移路径呈线状排列,因而导致内皮细胞不能向前迁移。所以,VE-statin/Egfl7的作用机制之一可能是在内皮细胞群集性迁移过程中,精确调节内皮细胞之间的正确空间排列从而保证内皮细胞按正确的路径迁移,确保最终毛细血管样结构形成。
内皮细胞与周围细胞外基质粘附、整合亦是血管形成的重要步骤之一,若不然内皮细胞则无法发挥其正常功能,最终发生凋亡。本研究发现VE-statin/Egfl7基因沉默可使HUVEC粘附能力下降。Park等[15]研究报道VE-statin/Egfl7可促进内皮细胞粘附,但是其作用能力较其它基质蛋白弱,故单独存在情况下,VE-statin/Egfl7对内皮细胞具有促进粘附的能力。Schmidt等[14]发现VE-statin/Egfl7能够整合入新生血管周围的细胞外基质,并与Fibronectin等形成细胞外基质复合物,由于比这些胞外基质粘附能力低,因而VE-statin/Egfl7的粘附调节作用可能主要是确保内皮细胞在管状结构形成过程中精确的时空排列。
本研究表明VE-statin/Egfl7-siRNA抑制U251和HUVEC的VE-statin/Egfl7基因表达后,可明显抵抗恶性胶质瘤细胞U251诱导的HUVEC血管生成能力,其作用机制是通过调节内皮细胞粘附性影响其群集性迁移,最终在血管管腔化过程中起着关键性作用。以VE-statin/Egfl7为靶点的抗胶质瘤血管生成及基因治疗可能成为一新的有效的策略。
| [1] | Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol, 2007, 114(2):97-109. |
| [2] | Fitch MJ, Campagnolo L, Kuhnert F, et al. Egfl7, a novel epidermal growth factor-domain gene expressed in endothelial cells. Dev Dyn, 2004, 230(2):316-324. |
| [3] | Wu F, Yang LY, Li YF,et al. Novel role for epidermal growth factor-like domain 7 in metastasis of human hepatocellular carcinoma. Hepatology, 2009, 50(6):1839-1850. |
| [4] | 李学军, 黄纯海, 李萃, 等. EGFL7在人脑胶质瘤中的表达及其意义. 肿瘤防治研究, 2011, 38(2):148-151. |
| [5] | 黄纯海, 李学军, 罗勇, 等. 人EGFL7基因短发夹结构RNA慢病毒载体的构建及鉴定. 中华神经外科疾病研究杂志, 2009, 8(6):513-516. |
| [6] | 周桂林, 黄纯海, 万一, 等. 靶向人EGFL7基因的短发夹结构RNA对胶质瘤细胞系U251增殖的影响. 中国现代医学杂志, 2011, 21(22):2702-2706. |
| [7] | Nichol D, Stuhlmann H. EGFL7: a unique angiogenic signaling factor in vascular development and disease. Blood, 2012, 119(6):1345-1352. |
| [8] | Li JJ, Yang XM, Wang SH, et al. Prognostic role of epidermal growth factor-like domain 7 protein expression in laryngeal squamous cell carcinoma. J Laryngol Otol, 2011, 125(11):1152-1157. |
| [9] | Philippin-Lauridant G, Baranzelli MC, Samson C, et al. Expression of Egfl7 correlates with low-grade invasive lesions in human breast cancer. Int J Oncol, 2013, 42(4):1367-1375. |
| [10] | Delfortrie S, Pinte S, Mattot V, et al. Egfl7 promotes tumor escape from immunity by repressing endothelial cell activation. Cancer Res, 2011, 71(23):7176-7186. |
| [11] | Gilsohn E, Volk T. Slowdown promotes muscle integrity by modulating integrin-mediated adhesion at the myotendinous junction. Development, 2010, 137(5):785-794. |
| [12] | Nikolic I, Stankovic ND,Bicker F, et al. EGFL7 ligates αvβ3 integrin to enhance vessel formation. Blood, 2013,121(15):3041-3050. |
| [13] | De Mazière A, Parker L, Van Dijk S, et al. Egfl7 knockdown causes defects in the extension and junctional arrangements of endothelial cells during zebrafish vasculogenesis. Dev Dyn, 2008, 237(3):580-591. |
| [14] | Schmidt M, Paes K, De Mazière A, et al. EGFL7 regulates the collective migration of endothelial cells by restricting their spatial distribution. Development, 2007, 134(16):2913-2923. |
| [15] | Nichol D, Stuhlmann H. EGFL7: a unique angiogenic signaling factor in vascular development and disease. Blood, 2012, 119(6):1345-1352. |
 2014, Vol. 41
2014, Vol. 41


