扩展功能
文章信息
- 来小音, 陈博, 余姗姗, 唐娜, 徐莉, 陈琛, 汪道文, 卜碧涛
- LAI Xiao-Yin, CHEN Bo, YU Shan-Shan, TANG Na, XU Li, CHEN Chen, WANG Dao-Wen, BU Bi-Tao
- 强直性肌营养不良临床特点分析
- Analysis of clinical features of myotonic dystrophy
- 国际神经病学神经外科学杂志, 2014, 41(2): 97-101
- Journal of International Neurology and Neurosurger, 2014, 41(2): 97-101
-
文章历史
- 收稿日期: 2013-11-18
- 修回日期: 2014-03-17
2. 华中科技大学同济医学院附属同济医院基因诊断中心,湖北省武汉市 430030
强直性肌营养不良(myotonic dystrophy or dystrophia myotonia,DM),属氯离子通道病,呈常染色体显性遗传,临床以肌强直、肌萎缩和肌无力为主要表现。不同患者的临床表现和严重程度差异较大,还可累及其他器官,如心脏、内分泌系统、眼睛、性腺和胃肠道等。本研究总结分析21例DM患者的临床资料,以探讨其临床特点,提高对该疾病的认识水平。 1 资料和方法 1.1 一般资料
收集2008年1月至2013年7月在华中科技大学同济医学院附属同济医院门诊与住院确诊的DM患者资料,共21例,其中男性14例,女性7例,起病年龄为10~46岁,平均为30.12±11.21岁,起病年龄小于20岁者4例,20~40岁者11例,大于40岁者6例。就诊时病程从3个月~20年不等。1例患者祖父母为近亲结婚。家族中有类似表现者5例,其中4例为患者哥哥或弟弟,1例为患者的外甥女有类似表现。 1.2 方法
回顾性分析21例患者的临床资料,包括临床表现、神经电生理学、病理学,实验室检查及影像学检查等。其中神经电生理检查在我院神经科肌电图室完成; 肌肉活检采用液氮速冻,冰冻切片后行酶学染色,由我院神经科肌病病理室完成;基因检测采用聚合酶链反应(PCR)方法对DMPK基因CTG重复序列进行扩增测序,由我院基因诊断中心完成。 2 结果 2.1 临床表现
本组患者均为慢性起病,其中首发症状以双手无力、僵硬、活动不灵活为主者10例,以四肢无力为主者6例,以起步及变换姿势困难为主者3例,以心慌不适就诊者2例。肌强直以双手大鱼际肌叩击性肌球最明显者18例,肌无力以四肢远端,尤其双上肢远端为主。肌萎缩12例,以四肢远端为主,伴明显“斧状脸”及“鹅颈”者2例。吞咽困难、饮水呛咳者3例,言语不清或声嘶者8例,用力后口张不大者2例,呼吸困难者1例。脱发3例,3例行眼部检查,确诊白内障2例,子宫肌瘤2例,胆囊结石2例,肝炎2例,糖尿病1例,性功能障碍1例,便秘1例,情感控制力差1例,类风湿关节炎1例。见表 1。
| 编号 | 性别 | 发病年龄(岁) | 首发症状 | 受累肌肉 | 肌强直 | 心脏受累 | 其它症状 | CK(U/L)) | EMG | 家族史 | CTG测序 |
| 1 | 男 | 10 | 四肢躯干活动时僵硬 | 四肢 | 双手 | 无 | 无 | 354 | 肌源性损害 | 兄有类似病史 | ---- |
| 2 | 男 | 21 | 双手无力 | 双上肢 | 双手 | 无 | 类风湿关节炎 | 437 | 肌源性损害,强直电位 | 无 | ---- |
| 3 | 女 | 46 | 起步姿势变慢 | 四肢 | 双手 | I度房室传导阻滞 | 子宫肌瘤,白内障,肝炎 | 196 | 肌源性损害,强直电位 | 无 | ---- |
| 4 | 男 | 35 | 双上肢无力,握力差 | 四肢 | 双手 | 窦性心律不齐 | 无 | 477 | 肌源性损害,强直电位 | 外甥女类似病史 | ---- |
| 5 | 男 | 23 | 双手不灵活,讲话鼻音 | 四肢,头面部 | 双手 | I度房室传导阻滞 | 无 | 130 | 肌源性损害 | 无 | ---- |
| 6 | 男 | 36 | 双手不灵活,遇冷加重 | 四肢,头面部 | 双手,咀嚼肌 | 无 | 肝炎 | 376 | 肌源性损害,强直电位 | 祖父为近亲结婚 | n=13 |
| 7 | 女 | 26 | 四肢远端无力,双手放松困难 | 四肢,头面部 | 双手 | 肌酸激酶MB同工酶轻度升高 | 胆结石 | 108 | 肌源性损害,强直电位 | 无 | n=5 |
| 8 | 女 | 41 | 双手无力僵硬,舌不灵活 | 双上肢,头面部 | 双手 | 无 | 子宫肌瘤 | 151 | 肌源性损害,强直电位 | 无 | n=12 |
| 9 | 男 | 26 | 四肢僵硬,变化体位困难 | 四肢,头面部 | 双手 | I度房室传导阻滞 | 中枢系统脱髓鞘 | 831 | 肌源性损害,强直电位 | 弟有类似病史 | ---- |
| 10 | 男 | 14 | 四肢无力 | 四肢 | 双手 | I度房室传导阻滞,多源性早搏 | 无 | 358 | 肌源性损害,强直电位 | 无 | ---- |
| 11 | 男 | 42 | 时有心前区不适 | 四肢,心肌 | 双手 | 无 | 无 | 140 | 未查 | 无 | ---- |
| 12 | 男 | 44 | 双手无力 | 双上肢 | 双手 | 无 | 脱发 | 336 | 肌源性损害,强直电位 | 无 | ---- |
| 13 | 女 | 30 | 四肢无力,呼吸困难 | 四肢,呼吸肌 | 双手 | 完全性左束支传导组织,心肌钙蛋白升高 | 无 | 161 | 肌源性损害,强直电位 | 无 | n=5 |
| 14 | 男 | 15 | 四肢无力,上楼困难 | 四肢 | 双手 | 无 | 无 | 153 | 肌源性损害,强直电位 | 无 | n=5 |
| 15 | 女 | 45 | 四肢无力 | 四肢 | 不明显 | 无 | 无 | 115 | 肌源性损害,强直电位 | 无 | ---- |
| 16 | 男 | 26 | 四肢无力,言语不清 | 四肢,咽喉肌 | 双手 | 无 | 无 | 358 | 肌源性损害 | 无 | n=5 |
| 17 | 男 | 16 | 四肢无力,双手萎缩 | 四肢 | 双手 | 无 | 胆石症 | 123 | 未查 | 弟有类似病史 | n>100 |
| 18 | 女 | 42 | 四肢无力,动作慢 | 四肢,头面部,冈上下肌 | 不明显 | 无 | 胆石症 | 284 | 肌源性损害,强直电位 | 兄有类似病史 | n=14 |
| 19 | 男 | 28 | 四肢无力,心慌 | 四肢,颈面部,心肌 | 双手,咀嚼肌 | 完全性右束支传导阻滞,肌酸激酶MB同工酶轻度升高 | 便秘,脱发 | 141 | 肌源性损害,强直电位 | 无 | n=13 |
| 20 | 男 | 27 | 四肢无力,手指不灵活 | 四肢,头面部 | 双手 | 无 | 转氨酶轻度升高 | 559 | 肌源性损害,强直电位 | 无 | n=11 |
| 21 | 女 | 40 | 四肢无力,上楼困难 | 四肢 | 不明显 | 无 | 无 | 177 | 肌源性损害,强直电位 | 无 | ---- |
21例患者7例心电图异常,其中4例为I度房室传导阻滞,1例为完全性右束支传导阻滞,1例为完全性左束支传导阻滞,1例为窦性心律不齐;心肌损害标志物检查2例为肌酸激酶MB同工酶轻度升高,1例为心肌钙蛋白轻度升高。21例患者中磷酸肌酸激酶(CK)轻度升高者11例,最高值为831U/L,乳酸脱氢酶轻度升高者7例,最高值为321U/L;血生化检查1例谷丙转氨酶及谷草转氨酶轻度升高;11例患者检查风湿及免疫全套,其中1例类风湿因子(RF)升高(109 IU/ml)并抗环瓜氨酸肽抗体强阳性。 2.3 影像学检查
DM患者很少行常规头部影像学检查,本组仅1例患者行头部MRI检查示额、颞、顶、枕部皮质下及半卵圆中心可见多发异常信号,呈T1低信号,T2高信号,考虑脱髓鞘可能性大(见图 1),行腰椎穿刺脑脊液检查未见异常。
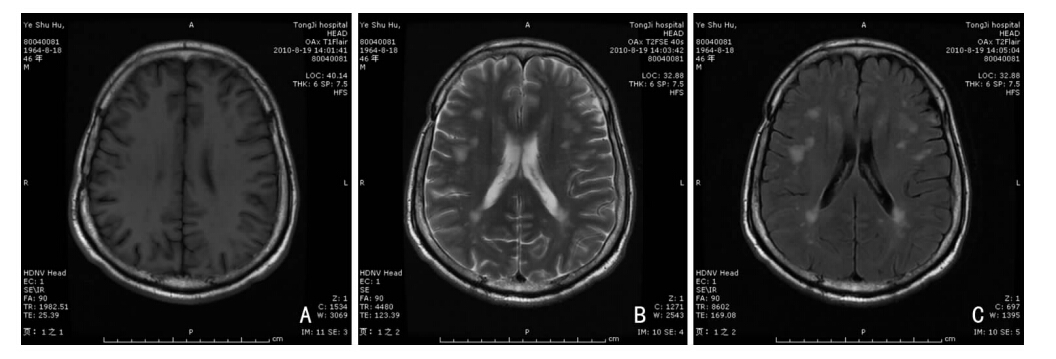
|
| 图 1 MRI脑白质多发性脱髓鞘改变(男,26岁,表现为四肢无力、轻度萎缩及肌强直。认知功能正常,未发现锥体束症,无血管疾病的证据)。A:T1加权像;B:T2加权像;C:Flair像。 |
19例患者行肌肉电图检查,均提示肌源性损害,其中16例有肌强直电位,主要出现在拇短展肌及胫前肌,10例出现在股四头肌及三角肌。神经电图:19例患者感觉神经传导速度均正常,1例患者腓肠神经运动神经传导速度减慢,同时肌肉电图伴有强直电位(见表 1)。 2.5 病理学检查
10例患者行骨骼肌活检,活检部位:9例取肱二头肌,1例取腓肠肌。其病理改变为肌纤维大小不等,部分萎缩呈角形纤维,核内移、核聚集;4例可见部分肌纤维肥大,2例可见分裂肌纤维,其中1例分裂纤维内可见胞浆体,2例可见肌纤维坏死、变性及再生,1例可见肌浆块;2例呈II型纤维占优势,1例II型纤维群组化,1例I型纤维占优势同时II型纤维少而肥大;10例间质均见结缔组织及脂肪组织增生(见图 2)。
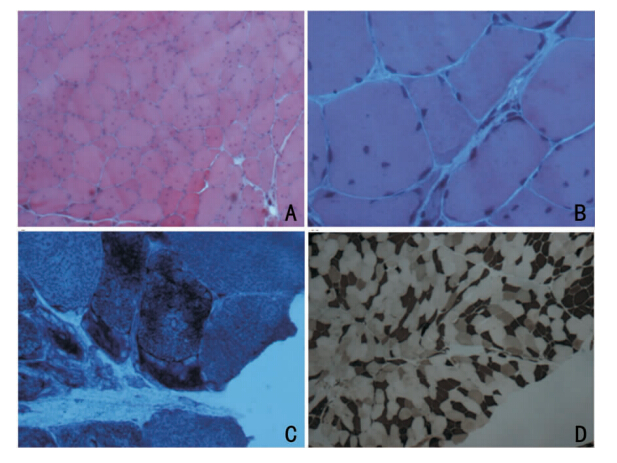
|
| 图 2 肌肉活检改变。A:HE(20×),肌纤维大小不等,可见部分肌纤维萎缩呈角形,个别肌纤维肥大。部分纤维核明显增多,核内移。B:HE(40×),示萎缩的分裂肌纤维,存在无结构的胞浆体。C:NADH(40×),NADH染色能更好地显示萎缩肌纤维的胞浆体。D:酸性ATPase(20×),显示萎缩肌纤维以I型肌纤维为主,II型肌纤维数量占优势,无明显群组化(男,表现为双上肢无力强直及轻度萎缩。肱二头肌活检)。 |
20例患者中10例行CTG重复序列检测,其中1例(编号17)CTG重复次数n>100超过正常重复范围(正常n=5~37),为DM1型;9例患者CTG重复次数均在正常范围(见表 1)。 3 讨论
DM是一种多系统受累的肌病。强直性肌营养不良1型(DM1)也被称为Steinert病,由强直性肌营养不良蛋白(DMPK)的DNA序列中一个短的重复序列(CTG)异常扩增引起。强直性肌营养不良2型(DM2)由ZNF9(锌指蛋白9)基因的CCTG序列扩增引起。目前认为该病为这两种异常扩增序列的转录产物mRNA在肌组织中高表达,使跨膜Cl-通道水平减少引起肌强直[1]。本组10例患者行CTG重复序列检测1例呈异常扩增,为DM1型,因基因排查时未行CCTG序列检测,余9例是否为DM2型尚需进一步检测确定。本组1例CTG重复序列扩增者与9例CTG重复序列检测正常者比较,CTG重复序列异常患者起病较早,上肢远端肌肉受累更明显,而其余9例患者头颈部肌肉、呼吸肌及肢体近端肌肉受累较多见。这种临床表现上的差异是否由于不同疾病分型所致(如DM1与DM2),亦或存在尚未被认识的分型尚待研究。
DM患者起病隐袭,进展缓慢,多成年起病。本组21例患者发病年龄10~46岁,多为成人型,起病年龄以20~40岁组居多。
该组患者21例,有家族类似病例者5例,其余为散发病例,可见阳性家族史虽然十分重要,但是在本病的诊断中并非必要条件,这与国内以往报道一致[2]。
DM患者的临床表现主要为肌强直、肌无力、肌萎缩。本组21例患者中19例起病均为肢体不灵活或无力,另外2例经体格检查发现双手大鱼际肌叩击性肌球。肌强直是本病主要特征,多为肢体远端受累,疾病进展过程中逐渐累及头面部及近端肌肉,出现吞咽困难、饮水呛咳、构音障碍、用力后张口困难等。肌无力及肌萎缩以肢体远端多见,其次为颈面部及四肢近端肌肉。病程长者肌肉萎缩明显,可呈肌病面容,典型者呈“斧状脸”;胸锁乳突肌萎缩时可呈“鹅颈”。DM患者可有轻度CK升高[3],本组病例CK轻度升高者10例,LDH轻度升高者7例;EMG是临床诊断DM的重要辅助检查手段,但在Young等[4]的研究中发现确诊的DM患者有近三分之一的病例未发现强直电位。本组患者19例行肌电图检查仅3例未提示强直电位,分析可能是由于部分早期病人肌强直症状较轻,强直电位少而不易发现。对于DM是否累及周围神经一直没有定论,有研究认为DM三核苷酸的重复扩增突变,不但弥散性侵犯肌纤维,也会侵犯神经纤维和轴突[5]。本组1例患者检出腓肠神经运动神经传导速度减慢。
骨骼肌以外的多系统受累是DM的重要临床表现。DM患者可出现各种心律失常甚至心肌病[6],患者可因完全性房室传导阻滞而导致猝死[7]。本组病例心电图异常主要以传导阻滞为主。因此对于DM患者要常规行心电图检查,必要时行动态心电图及心脏超声检查并密切随访。白内障也是本病常见临床症状之一,本组患者眼部视力减退者少见,可能与未常规行裂隙灯检查有关。内分泌改变以性腺发育不良多见[8],但本组患者性腺、内分泌系统受累少见。中枢神经系统受累可出现颅内脱髓鞘病变,严重者表现智能减退,嗜睡等[9]。本组1例患者有脱髓鞘病变,但未出现明显智能障碍。另外本组中发现合并肝胆系统疾病及类风湿疾病者,尚需进一步分析其与DM的关系。
DM的诊断尚需与其他类型伴有肌强直症状的疾病相鉴别。①先天性肌强直:主要表现为出生后既有肌肉强直和肥大,而无肌萎缩和内分泌改变。②先天性副肌强直:主要表现为出生即存在肌强直症状。③高钾型或正钾型周期性麻痹:发作时伴有血钾水平及心电图T波的改变。④神经性肌强直(Isaac,s syndrome):主要临床特点为持续性肌肉抽动,可伴出汗,EMG提示神经源性损害。其中①、②和③这三种疾病均可行基因诊断。
综上所述,DM在中国有家族遗传背景的病例并不多。对于DM的诊断,主要是依据肌强直及肌萎缩的临床特点,同时结合肌电图检查、肌肉活检检查、家族史及多系统(主要为心脏、眼部及内分泌系统)受累的症状和体征。本病的基因诊断三核苷酸重复序列检测实施并不困难,在有条件的医院可以开展。对于疑似病例,全面评估病情进展,及早确诊及处理多系统受累改善患者预后有重要临床意义。
| [1] | 赵晓萍.强直性肌营养不良发病机制研究进展.国外医学神经病学神经外科学分册, 2004, 31(2): 134-137. |
| [2] | 李懋,黄旭升,王占军,等.强直性肌营养不良1型患者临床特点分析.中国神经免疫学和神经病学杂志, 2013, 20(1): 37-40. |
| [3] | Romeo V. Myotonic dystrophy Type 1 or Steinert's disease. Adv Exp Med Biol, 2012, 724: 239-257. |
| [4] | Nathan P, Young DO, Daube MD, et al. Absent, unrecognized, and minimal myotionic discharges in myotonic dystrophy type 2. Muscle Nerve, 2010, 41: 758-762. |
| [5] | 笪宇威,李彦,徐敏,等.伴有周围神经损害的强直性肌营养不良.卒中与神经疾病, 2006, 06: 345-347; 350. |
| [6] | Heckert KD, Skerker RS. Atypical Presentation of Myotonic Dystrophy Type 1. PM&R, 2011, 3(4): 396-399. |
| [7] | Mendell JR, Garcha TS, Kissel JT. The immunopathogenic role of complement in human muscle disease. Curr Opin Neurol, 1996, 9(3): 226-234. |
| [8] | Orngreen MC, Arlien-Soborg P, Duno M, et al. Endocrine function in 97 patients with myotonic dystrophy type 1. J Neurol, 2012, 259(5): 912-920. |
| [9] | Ravikanth J, Sureka J, Munawwar A, et al. Magnetic resonance imaging findings inadult-form myotonic dystrophy type 1. Singapore Med J, 2012, 53(7): e150-e152. |
 2014, Vol. 41
2014, Vol. 41


