扩展功能
文章信息
- 俞晓燕, 赵玉武
- 血管周细胞与间充质干细胞关系的研究进展
- 国际神经病学神经外科学杂志, 2014, 41(1): 85-88
- Disease Surveillance, 2014, 41(1): 85-88
-
文章历史
- 收稿日期:2013-10-22
- 修回日期:2014-01-21
周细胞广泛分布于全身毛细血管和微血管周围,是构成毛细血管和毛细血管后静脉的重要成分。早在1873年法国科学家Rouget就在文章中较为详细地描述了此类细胞,因此,周细胞也被称为Rouget细胞[1],之后Zimmermann[2]基于该细胞位于微血管周围将其命名为“周细胞”[3]。
1 周细胞的生物学特征 1.1 形态学特征周细胞体积较小,直径约为10 μm,在透射显微镜下观察时缺乏显著特征。成熟血管周细胞的细胞核呈圆盘状,周围细胞质中富含有与蛋白生成相关的细胞器和线粒体。周细胞的细胞突起很长,依附于内皮细胞的非管腔表面发出初级突起,这些突起通常跨越几个内皮细胞,偶尔也会连接起相邻的毛细血管分支。微血管周细胞与内皮细胞间存在细胞外基质,两者共用此层基膜[5],基膜间存在一定间隙,周细胞和内皮细胞可经此间隙直接接触,常见的有紧密连接、缝隙连接、黏着斑和钉-槽复合体。
在正常状态下,周细胞处于静息状态,维持血管的稳定性,而机体发生应激或损伤时,周细胞的表型和功能也随之改变,这些改变包括:迁移、增殖和分化[4]。和正常组织相比,肿瘤组织血管中周细胞的覆盖范围扩展,和内皮细胞间连接也变得疏松,同时周细胞突起侵入肿瘤实质深部[5]。糖尿病性视网膜病变的组织中可以观察到周细胞发生凋亡[5],并且一些毛细血管中内皮细胞完好无缺而周细胞丢失甚至在有微动脉瘤的血管中也未发现周细胞。此外,阿尔兹海默病中也存在周细胞丢失的情况。
1.2 细胞分子标记物血管周细胞和内皮细胞位置相近,不同的生理过程中周细胞的形态不尽相同,故单纯使用光学显微镜或免疫组织化学的方法来区分两者比较困难[3]。研究人员常使用电镜下形态学观察以及联合一些标记物来标记区分周细胞,这些典型特征性标记分子包括神经胶质抗原(nerve and glial zntigen 2,NG2)、血小板源性生长因子β受体(platelet-derived growth factor-betareceptor,Pdgfrb)、CD13、CD146、细胞平滑肌抗原α(α-smooth muscle actin,αSMA)[6]、肌间线蛋白(desmin,des)、结蛋白、氨肽酶(aminopeptidase,AP)A和N等。此外,最近的研究认为蛋白信号转导调节因子(regulator of G protein signaling 5,RGS5)、SUR2(ATP-binding cassette,subfamily C(CFTR/MRP),member 9)、Kir 6.1(potassium inwardly rectifying channel,subfamily J,member 8)、Endosialin、DLK1(delta-like 1 homolog)可能是新的周细胞标记分子,还有待进一步的确认。
然而上述这些标记分子的特异性不高,迄今为止还没有一个标记分子能够完全单独用来标记周细胞[7, 8],如平滑肌细胞可表达Pdgfrb和αSMA,脂肪细胞可表达NG2。此外,周细胞不同发育阶段、病理过程或体外培养时,这些分子的表达量也有所变化[5]。因此如何有效而准确的标记及确定周细胞已成为摆在研究人员面前急需解决的一个难题,现阶段鉴别周细胞通常联合采用形态学、与内皮细胞的定位关系以及2个以上的周细胞标记分子等多种方法。
1.3 生理功能中枢神经系统中存在高密度的周细胞,与内皮细胞一起参与了血脑屏障的构成与维持[9];周细胞在血管生成中也起到了非常重要的作用,参与了血管生成的3个阶段:起始、芽孢形成、迁移[10],同时周细胞还能促进新血管的成熟;周细胞能够表达α-SMA,通过改变自身收缩状态来调节血管血流。在脑缺血时周细胞发生收缩,即使再开放闭塞的大脑中动脉后这种收缩状态仍未改变[11];脑部周细胞持续表达低水平的黏附分子(ICAM-1、VCAM-1),这些分子可激活MHC-II依赖的抗原递呈反应[12],这提示周细胞可能具有将抗原呈递给T细胞的功能[13],同时它也能分泌调节免疫的细胞因子如IL-1β和IL-6;此外,越来越多的研究发现周细胞具有多向分化潜能,能分化为成纤维细胞、平滑肌细胞、内皮细胞、脂肪细胞、巨噬细胞、树突状细胞、成骨祖细胞[13]。皮肤组织中的周细胞与MSCs有相同的行为学表现[14],可以分化为多种细胞:骨细胞、脂肪细胞、软骨细胞等。
2 周细胞与间充质干细胞的关系1974年,Friedenstein等[15]首先在骨髓组织中描述了MSC,这种类型前体细胞能够形成成纤维细胞样克隆。在体外不同组织来源的间充质干细胞有着相似的行为学表现,能够在特定的条件下分化为骨、软骨、脂肪、平滑肌等组织[16, 17, 18, 19]。近些年来通过对MSC生物学特征的研究发现,不同组织来源的间充质干细胞主要位于血管旁,与微血管壁细胞-周细胞有着密切的联系[20]。
2.1 血管周细胞与间充质干细胞的相似性间充质干细胞有许多组织来源,骨髓、脂肪、牙髓、胎盘、甚至是脑组织中均可分离得到MSCs。值得注意的是,这些MSCs均位于血管旁,在细胞表型、基因表达和分化能力等方面与周细胞有着高度的相似性。在分化潜能方面,血管周细胞也与MSCs具有一致性,在体外特定的条件下均可分化为软骨细胞、脂肪细胞、成骨细胞、平滑肌细胞等[21, 22]。Caplan[23]观察到MSCs的数目与血管密度密切相关:随着年龄的增长,血管密度下降的同时骨髓间充质干细胞的数量也随之降低。此外,在高度血管化的脂肪组织中分离得到的MSCs数量明显高于正常脂肪组织[24]。
周细胞在体外培养时形态学上类似于间充质干细胞,并且能表达MSCs的标记物如CD44、CD73、CD90、CD105[25]。zen等[26]对活检和颞叶切除术后的人脑组织进行分析后发现,在脑组织血管分支处存在一类细胞能同时表达MSCs的表面分子CD135、CD13和周细胞的标记物Pdgfrb,经过进一步分离纯化后证实这些细胞能在体外表达周细胞和间充质干细胞共有标记物:CD73、CD90、CD13、CD106、CD49d、Pdgfrb、RGS5、αSMA、NG2,且没有检测到造血细胞、内皮细胞和胶质细胞标记分子的表达。
多向分化潜能是间充质干细胞的重要特征之一,在损伤或某些诱导因子的诱导下血管周细胞也有同样的行为学表现。在低氧的环境条件下,血管周细胞能够分化为平滑肌细胞[27]。成人中枢系统中毛细血管部位的周细胞在bFGF的诱导下分化为带有周细胞、神经元和神经胶质细胞特征标记的神经谱系细胞[8]。此外,损伤部位附近或远处的周细胞可以激活Notch信号通路[28],该通路的活化近年来被证实对间充质干细胞的分化有着重要的影响[29, 30]。
长期以来,对于周细胞是不是间充质干细胞这个问题一直存在争论,有观点认为血管周细胞是MSC的前体细胞[31]。将牛视网膜周细胞植入裸鼠体内能够发育为脂肪和软骨细胞[32],此外也有报道称周细胞能分化为成骨细胞、骨骼肌细胞等,然而这些实验中使用的周细胞大都没有经过分离纯化[31]。Dellavalle等[33]从人骨骼肌分离出的周细胞植入营养不良性免疫缺陷小鼠体内后分化形成骨骼肌。从各组织分离得到的周细胞除表达自身标记物CD146、NG2、Pdgfrb外,同时表达MSC的表面分子CD44、CD73、CD90、CD105,经过长时间培养后MSC的标记物仍然保留并存在多向分化潜能[34]。Feng等[35]使用遗传谱系追踪技术首次证实了在活体内牙齿生长和损伤时周细胞能够分化为间充质干细胞——成牙本质细胞。这提示在其他组织中血管周细胞也存在分化为MSC的可能性。
2.2 血管周细胞分化成间充质干细胞的方式所有的间充质细胞虽然有着相似的基因特性,但其仍存在着明显的组织特异性[20]。分布于全身的周细胞是如何分化为具有组织特异性的MSCs,现阶段主要存在着两种假说:线性分化模式和微环境分化模式(如图 1)[20]。
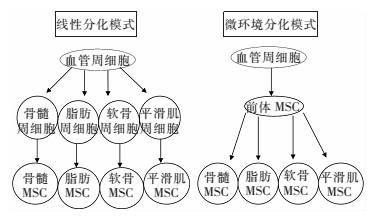
|
| 图 1血管周细胞分化为MSC的2种模式:左侧为线性分化模式;右侧为微环境分化模式 |
在线性分化模式中,前体血管周细胞首先分化为组织特异性的周细胞,之后再由组织特异性的周细胞分化形成组织特异性的MSCs。这种观点认为间充质干细胞的组织特异性主要源于这种组织特异性的干细胞[20]。
2.2.2 微环境分化模式微环境分化模式的观点认为,前体血管周细胞首先分化为一种共同的前体MSC,前体MSC在特定的组织微环境的影响下,与周围组织和细胞发相互作用后再形成组织特异性的间充质干细胞[20]。
3 周细胞在组织修复和再生中的应用出生后组织的修复重建主要依靠成人干细胞(adult stem cell,ASC),而间充质干细胞(mesenchymal stem cell,MSC)作为成人干细胞家族的重要成员之一,具有自我更新、多向分化和免疫抑制性的能力。Chen等[36]分离纯化小鼠骨骼肌周细胞来治疗缺血性心脏疾病后发现,移植周细胞后左心室扩张减弱,并能有效增强心肌收缩,这种效果明显优于移植CD56+肌源性前体细胞。通过标记荧光蛋白证实部分周细胞分化为心肌细胞;同时周细胞移植治疗大幅度降低心肌细胞纤维化、显著降低缺血部位炎症细胞的浸润、促进血管内皮生长因子A、血小板衍生生长因子β、转化生长因子β1的表达。这些证据充分表明周细胞能够促进缺血后心肌结构和功能的恢复。
4 问题与展望以干细胞为基础的组织修复和再生有着广阔的应用前景,间充质干细胞或其前体细胞能够分化为所需要的特定细胞、分泌生长因子、调节免疫、调控损伤后组织的重构同时激活内源性修复或再生机制[25, 37]。周细胞和间充质干细胞有许多相似之处,也是MSC有前景的前体细胞来源。血管周细胞分布广泛,全身微血管中均有其存在,这就为自体干细胞的临床应用提供了充足的细胞来源[31]。研究证实纯化后的周细胞能诱导心肌血管生成同时减少纤维化,可以作为心肌损伤后修复的重要治疗手段[25]。现阶段特异鉴别和分离周细胞还有一定困难,限制了对其的进一步研究和应用。相信随着技术的进步纯熟及研究的深入,周细胞的生物学特性以及与MSCs的关系会更加透彻,给组织修复和再生带来突破。
| [1] | Rouget C. Memoiresurledeveloppement,lastructureetles proprietes physiologiques des capillaires sanguins et lymphatiques. Arch Physiol Norm Path,1873,5: 603-663. |
| [2] | Zimmermann K. Der feinere Bau der Blutkapillaren. Z Anat Entwicklungsgesch,1923,68: 29-109. |
| [3] | Dalkara T,Gursoy-Ozdemir Y,Yemisci M. Brain microvascular pericytes in health and disease. Acta Neuropathol,2011,122: 1-9. |
| [4] | Dore-Duffy P,Kristen C. Morphology and properties of pericytes. Methods Mol Biol,2011,686: 49-68. |
| [5] | Armulik A,Genove G,Betsholtz C. Pericytes: developmental,physiological,and pathological perspectives,problems,and promises. Dev Cell,2011,21: 193-215. |
| [6] | Tigges U,Welser-Alves JV,Boroujerdi A,et al. A novel and simple method for culturing pericytes from mouse brain. Microvasc Res,2012,84: 74-80. |
| [7] | Cheung C,Sinha S. Human embryonic stem cell-derived vascular smooth muscle cells in therapeutic neovascularisation. J Mol Cell Cardiol,2011,51: 651-664. |
| [8] | Dore-Duffy P,Katychev A,Wang X,et al. CNS microvascular pericytes exhibit multipotential stem cell activity. J Cereb Blood Flow Metab,2006,26: 613-624. |
| [9] | Nakagawa S,Deli MA,Nakao S,et al. Pericytes from brain microvessels strengthen the barrier integrity in primary cultures of rat brain endothelial cells. Cell Mol Neurobiol,2007,27(6): 687-694. |
| [10] | Dore-Duffy P. Pericytes: pluripotent cells of the blood brain barrier. Curr Pharm Des,2008,14(16): 1581-1593. |
| [11] | Yemisci M,Gursoy-Ozdemir Y,Vural A,et al. Pericyte contraction induced by oxidative-nitrative stress impairs capillary reflow despite successful opening of an occluded cerebral artery. Nat Med,2009,15(9): 1031-1037. |
| [12] | Verbeek MM,Westphal JR,Ruiter DJ,et al. T lymphocyte adhesion to human brain pericytes is mediated via very late antigen-4/vascular cell adhesion molecule-1 interactions. J Immunol,1995,154(11): 5876-5884. |
| [13] | Inês S,Dora B,Maria AB. Neurovascular Unit: a Focus on Pericytes. Mol Neurobiol,2012,45: 327-347. |
| [14] | Paquet-Fifield S,Schlüter H,Li A,et al. A role for pericytes as microenvironmental regulators of human skin tissue regeneration. J Clin Invest,2009,119(9): 2795-2806. |
| [15] | Friedenstein AJ,Chailakhyan RK,Latsinik NV,et al. Stromal cells responsible for transferring the microenvironment of the hemopoietic tissues. Cloning in vitro and retransplantation in vivo. Transplantation,1974,17: 331-340. |
| [16] | Bianco P. Bone and the hematopoietic niche: a tale of two stem cells. Blood,2011,117: 5281-5288. |
| [17] | Charbord P. Bone marrow mesenchymal stem cells: historical overview and concepts. Hum Gene Ther,2010,21: 1045-1056. |
| [18] | Pontikoglou C,Deschaseaux F,Sensebe L,et al. Bone marrow mesenchymal stem cells: biological properties and their role in hematopoiesis and hematopoietic stem cell transplantation. Stem Cell Rev,2011,7: 569-589. |
| [19] | Li J,Sensebe L,Herve P,et al. Nontransformed colony-derived stromal cell lines from normal human marrows. II. Phenotypic characterization and differentiation pathway. Exp Hematol,1995,23: 133-141. |
| [20] | Feng J,Mantesso A,Sharpe PT. Perivascular cells as mesenchymal stem cells. Expert Opin Biol Ther,2010,10(10): 1441-1451. |
| [21] | Collett G,Wood A,Alexander MY,et al. Receptor tyrosine kinase Axl modulates the osteogenic differentiation of pericytes. Circ Res,2003,92: 1123-1129. |
| [22] | Farrington-Rock C,Crofts NJ,Doherty MJ,et al. Chondrogenic and adipogenic potential of microvascular pericytes. Circulation,2004,110: 2226-2232. |
| [23] | Caplan A. Why are MSCs therapeutic? New data: new insight. J Pathol,2009,217: 318-324. |
| [24] | da Silva Meirelles L,Sand TT,Harman RJ,et al. MSC frequency correlates with blood vessel density in equine adipose tissue. Tissue Eng Part A,2009,15: 221-229. |
| [25] | Corselli M,Chen CW,Crisan M,et al. Perivascular Ancestors of Adult Multipotent Stem Cells. Arterioscler Thromb Vasc Biol,2010,30: 1104-1109. |
| [26] | zen I,Boix J,Paul G. Perivascular mesenchymal stem cells in the adult human brain: a future target for neuroregeneration? Clin Translat Med,2012,1: 30. |
| [27] | Meyrick B,Reid L. Hypoxia and incorporation of 3H-thymidine by cells of the rat pulmonary arteries and alveolar wall. Am J Pathol,1979,96: 51-70. |
| [28] | Lovschall H,Mitsiadis TA,Poulsen K,et al. Coexpression of Notch3 and Rgs5 in the pericyte-vascular smooth muscle cell axis in response to pulp injury. Int J Dev Biol,2007,51: 715-721. |
| [29] | Tang Y. Notch and transforming growth factor-beta (TGFbeta) signaling pathways cooperatively regulate vascular smooth muscle cell differentiation. J Biol Chem,2010,285(23): 17556-17563. |
| [30] | Wang S,Kawashimab N,Sakamotoc K,et al. Osteogenic differentiation of mouse mesenchymal progenitor cell,Kusa-A1 is promoted by mammalian transcriptional repressor Rbpj. Biochem Biophys Res Commun,2010,400(1): 39-45. |
| [31] | Crisan M,Yap S,Casteilla L,et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell,2008,3: 301-313. |
| [32] | Farrington-Rock C,Crofts N,Doherty MJ,et al. Chondrogenic and adipogenic potential of microvascular pericytes. Circulation,2004,110: 2226-2232. |
| [33] | Dellavalle A,Sampaolesi M,Tonlorenzi R,et al. Pericytes of human skeletal muscle are myogenic precursors distinct from satellite cells. Nat. Cell Biol,2007,9: 255-267. |
| [34] | Crisan M,Chen CW,Corselli M,et al. Perivascular multipotent progenitor cells in human organs. Ann N Y Acad Sci,2009,1176: 118-123. |
| [35] | Feng J,Mantesso A,De Bari C,et al. Dual origin of mesenchymal stem cells contributing to organ growth and repair. Proc Natl Acad Sci U S A,2011,108(16):6503-6508. |
| [36] | Chein-wen C,Masaho O,Jonathan D,et al. Human Pericytes for Ischemic Heart Repair. Stem Cells,2013,31: 305-316. |
| [37] | Arthur A,Zannettino A,Gronthos S. The therapeutic applications of multipotential mesenchymal/stromal stem cells in skeletal tissue repair. J Cell Physiol,2009,218: 237-245. |
 2014, Vol. 41
2014, Vol. 41


