扩展功能
文章信息
- 沈宏锐, 靳陶然, 胡静, 赵哲, 邴琪, 李娜
- SHEN Hong-Rui, JIN Tao-Ran, HU Jing, ZHAO Zhe, BING Qi, LI Na
- 连枷臂综合征临床与病理分析
- Clinical and pathological features of flail arm syndrome: an analysis of 8 cases
- 国际神经病学神经外科学杂志, 2014, 41(1): 20-22
- Disease Surveillance, 2014, 41(1): 20-22
-
文章历史
- 收稿日期:2013-12-10
- 修回日期:2014-02-08
2. 河北医科大学第三医院干部病房, 河北省石家庄市 050051
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一种由于大脑皮质、脑干、脊髓的运动神经元进行性变性,导致肌无力、肌萎缩、肌束震颤、延髓麻痹、呼吸无力及锥体束征阳性的神经系统变性疾病,症状进展加重,多于数年内死亡。近年研究发现部分ALS患者肌无力症状仅局限于双侧上肢,双下肢和球部受累较轻,进展缓慢,预后相对良好。这一组病例被称之为连枷臂综合征(flail arm syndrome,FAS)。本研究对90例ALS患者进行回顾性研究,从中筛选出FAS患者8例,对其临床、病理特点进行分析,以提高对该病的认识。
1 材料与方法 1.1 临床资料收集我科2005年6月至2013年1月住院ALS患者90例。入选条件:发病年龄大于15岁;慢性进展病程;临床表现肢体无力、肌萎缩,无感觉、尿便障碍;肌电图均出现延髓、颈髓、胸髓、腰骶髓4个节段中3个或以上支配区纤颤、正相波或动作单位电位增宽、增高。排除脑血管病、其他脑与脊髓疾病、脊肌萎缩症、平山病、颈腰椎病、多灶性运动神经病患者。全部患者均符合世界神经病学联盟El Escorial诊断标准[1],其中FAS患者病程均在2年以上,进展缓慢,临床无双下肢和球部症状。
1.2 活检骨骼肌病理分析 1.2.1 骨骼肌组织标本获得全部患者均在知情同意下行骨骼肌活检,根据临床症状和肌电图结果,选择具有典型下运动神经元受累的骨骼肌(多选择肱二头肌)作为活检部位,局部浸润麻醉下开放式骨骼肌活检。留取标本快速异戊烷/液氮冷冻用于组织化学、酶学染色。
1.2.2 组织化学、酶学染色病理分析骨骼肌标本7μm冰冻连续切片,苏木精-伊红(HE)、改良Gomori三色(MGT)、还原型辅酶I四氮唑还原酶(NADH-TR)、琥珀酸脱氢酶(SDH)、单磷酸腺苷脱氨酶(AMP)、细胞色素C氧化酶(COX)、酸性磷酸酶(acid phosphatase)、腺苷三磷酸环化酶(ATPase;pH=4.35,4.65,9.95)、高碘酸Schiff反应(PAS)、油红O(ORO)染色,光镜下病理分析。病理现象由2~3名有经验的医生共同判定。
1.3 统计学处理所有数据录入SPSS 13.0软件包。计量资料用均数±标准差表示,计数资料以百分率(%)表示,计量资料数据比较采用配对t检验,计数资料采用χ2检验。P<0.05表示差异有统计学意义。
2 结果 2.1 临床资料分析90例ALS中初诊确诊ALS 78例(其中FAS 5例),初诊时拟诊、可疑ALS,经随访后确诊12例(其中FAS 3例)。分为经典ALS组(82例)和FAS组(8例)。经典ALS组中,男55例,女27例,男∶女=2.04∶1,发病年龄15~74,平均(52.3±9.6)岁;FAS组中,男7例,女1例,男∶女=7∶1,发病年龄44~62,平均(52.6±7.7)岁。两组间比较,男女比例差异有统计学意义(P<0.05),发病年龄差异无统计学意义(P>0.05)。2组患者均以50~60岁为发病高峰,仅在经典ALS组中发现1例患者有家族史。
82例经典ALS患者中61例伴肌束震颤,5例有舌肌萎缩、纤颤,40例有吞咽困难、饮水呛咳或言语不清,12例呼吸受累。8例FAS患者均表现为严重的双上肢肌无力、肌萎缩,7例伴有肌束震颤。全部患者行血CK检测,其中经典ALS34例正常,48例轻-中度升高(142~1017 U/L)。FAS中5例正常,3例轻-中度升高(143~984 U/L)。
随访到经典ALS 61例,死亡34例(病程10月~6年,平均27.4±18.6月),其中9例以延髓受累起病;存活27例ALS(随访时间6月~5年)病情均有进展,21例卧床。全部FAS患者均存活(随访时间3~7年),6例无力症状局限于双上肢,2例出现轻度下肢无力。
FAS和经典ALS病理表现类似:散在肌纤维变性、坏死,可见小角化肌纤维(图 1A)、可见中心核及核聚集。NADH-TR、SDH、COX染色,可见肌纤维胞浆中酶活性局灶性减低、肌原纤维网紊乱,常见靶状纤维(图 1B)。ATPase染色肌纤维类型优势、群化(图 1C)。酸性磷酸酶染色,萎缩肌纤维胞浆中酶活性升高(图 1D);糖原成分正常,脂滴成分正常或轻至中度增多。
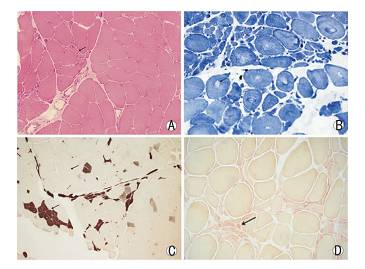
|
| 图 1活检骨骼肌病理冰冻切片组织化学、酶学染色。A:小角化肌纤维(HE;×250)。B:肌纤维胞浆中酶活性局灶性减低,可见靶状纤维(NADH-TR;×300)。C:肌纤维类型优势、群化(ATPase(pH 4.63);×200)。D:萎缩肌纤维胞浆中酸性磷酸酶酶活性升高(acid phosphatase;×300)。 |
连枷臂综合征是ALS的一种临床变异型,由Hu等[2]在1998年正式提出,约占全部ALS患者的10%[3],患者临床表现为上肢近端起病,对称性的上肢近端严重肌无力、肌萎缩,进展缓慢,渐累及上肢远端,呈肩部下沉,双上肢旋前的特殊姿势,下肢和球部肌肉不受累或受累轻微。由于经典ALS患者以上肢起病者多见(本研究中51/82,62.2%),因此,诊断FAS的关键点在于临床症状局限于上肢的时间需要大于2年[4]。本研究中8例FAS患者符合上述特征。其中2例患者在随访期出现轻度下肢无力,当时病程均>5年,不影响FAS的诊断。
FAS与经典ALS的主要区别在于症状局限、进展缓慢。在本研究的随访过程中,经典ALS的死亡率高达55.7%(34/61),存活的27例患者均症状加重明显,其中21例行走困难(77.8%)。而FAS患者均存活。提示FAS预后较佳。ALS发病高峰为50~60岁[5],本研究中,FAS组与经典ALS组的发病年龄均符合上述发病特点,二者无明显差异。FAS组的男女性别比(7∶1)明显高于经典ALS组(2.04∶1),提示FAS患者以男性为主[4, 6]。一般认为,性别比例的差异可能与遗传因素有关。在目前已知与ALS发病相关的13种相关基因中,尚未发现造成这种差异的基因突变[7]。值得注意的是,仅有45%的家族性ALS和5%的散发性ALS发现基因变异,在我们的相关研究中,曾对包括14例确诊患者(FAS患者5例)在内的35例ALS患者的SOD1、TARDBP、FUS基因进行检测,均未发现有意义的突变。说明基因突变在该病中的意义有待进一步深入研究。90例ALS患者中仅1例经典ALS有明确家族史,说明FAS同样以散发病例为主。
本研究表明,FAS和经典ALS的血肌酸激酶同样表现为正常或轻到中度升高[8],与骨骼肌活检所见散在变性、坏死肌纤维相符,也可能与肌力不足导致活动后肌肉过劳有关。肌电图是ALS诊断、鉴别诊断和观察病情进展的重要手段,可以发现亚临床病变。当结果不能满足确诊条件时,需定期复查。本研究中两组90例患者全部出现延髓、颈髓、胸髓、腰骶髓4个节段中3个或以上支配区纤颤、正相波或动作单位电位增宽、增高。说明尽管临床表现存在差异,但作为ALS的变异型,FAS同样需要满足ALS的诊断标准。
FAS和经典ALS的诊断主要依靠临床表现、电生理和基因筛查,活检骨骼肌病理分析可以作为诊断和鉴别诊断的重要辅助手段。本研究中,我们发现,FAS和经典ALS的骨骼肌病理表现无明显差异,二者均主要呈现小角化肌纤维、核聚集、肌纤维类型优势、群化等典型的神经源性肌病特点[9],这些病理现象与脊髓前角细胞变性、丢失,导致靶器官肌肉失神经支配相关。FAS的肥大肌纤维较经典ALS为著,可能与其病程较长有关,但不能作为区分二者的依据。此外,二者的共同病理表现还包括靶状纤维和萎缩肌纤维内酸性磷酸酶活性升高,分别提示线粒体相关酶活性异常和胞浆内溶酶体酶活性升高[10, 11],可能是导致ALS患者肌细胞萎缩的重要机制。这些相似的病理改变支持FAS作为ALS变异型的观点。
FAS的临床表现较经典ALS更为隐匿和局限,临床容易漏诊、误诊。由于其具有相对良性的病程,相应的治疗如力如太和抗氧化自由基药物可能具有更好的疗效[12],因此,为了更好地缓解患者压力、提高生活质量和改善预后,临床医师应提高该病的认识,力求做到早期诊断、治疗。
| [1] | Wilbourn AJ. Clinical neurophysiology in the diagnosis of amyotrophic lateral sclerosis: the Lambert and the El Escorialcriteria. J Neurol Sci,1998,160( Suppl 1): S25-S29. |
| [2] | Hu MT,Ellis CM. Flail arm syndrome: a distinctive variant of amyotrophic lateral sclerosis. J Neurol Neurosurg Psychiatry,1998,65(6): 950-951. |
| [3] | Guidetti D,Bondavalli M,Sabadini R,et al. Epidemiological survey of amyotrophic lateral sclerosis in the province of Reggio Emilia,Italy: influence of environmental exposure to lead. Neuroepidemiology,1996,15(6): 301-312. |
| [4] | Wijesekera LC,Mathers S,Talman P,et al. Natural history and clinical features of theflail arm and flail leg ALS variants. Neurology,2009,72(12): 1087-1094. |
| [5] | Logroscino G,Traynor BJ,Hardiman O,et al. Incidence of amyotrophic lateral sclerosis in Europe. J Neurol Neurosurg Psychiatry,2010,81(4): 385-390. |
| [6] | Testa D,Lovati R,Ferrarini M,et al. Survival of 793 patients with myotrophic lateral sclerosis diagnosed over a 28-year period. Amyotroph Lateral Scler Other Motor Neuron Disord,2004,5(4): 208-212. |
| [7] | EFNS Task Force on Diagnosis and Management of Amyotrophic Lateral Sclerosis,Andersen PM,Abrahams S,et al. EFNS guidelines on the clinical management of amyotrophic lateral sclerosis(MALS)--revised report of an EFNS task force. Eur J Neurol,2012,19(3): 360-375. |
| [8] | Sussmuth SD,Tumani H,Ecker D,et al. Amyotrophic lateral sclerosis: disease stage related changes of tau protein and S100 beta in cerebrospinal fluid and creatine kinase in serum. Neurosci Lett,2003,353(1): 57-60. |
| [9] | Tews DS,Goebel HH. Apoptosis-related proteins in skeletal muscle fibers of spinal muscular atrophy. J Neuropathol Exp Neurol,1997,56(2): 150-156. |
| [10] | Crugnola V,Lamperti C,Lucchini V,et al. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch Neurol,2010,67(7): 849-854. |
| [11] | Meola G,Bugiardini E,Cardani R. Muscle biopsy. J Neurol,2012,259(4): 601-610. |
| [12] | Valentino P,Conforti F JJ,Pinjlano D. et al. Brachial amyoirophic diplegia associaled with novel SOD1 mutation (L106P). Neurology,2005,64(8): 1477-1478. |
 2014, Vol. 41
2014, Vol. 41


