扩展功能
文章信息
- 牛小东, 马弟娃, 田宏亮, 王文涛, 王振伟, 高丙晶, 段磊
- NIU Xiao-Dong, MA Di-Wa, TIAN Hong-Liang, WANG Wen-Tao, WANG Zhen-Wei, GAO Bing-Jing, DUAN Lei
- 替莫唑胺对比传统化疗药治疗脑胶质瘤疗效的系统评价
- Efficacy of temozolomide versus traditional chemotherapy drugs in treatment of gliomas: a systematic review
- 国际神经病学神经外科学杂志, 2014, 41(1): 1-6
- Disease Surveillance, 2014, 41(1): 1-6
-
文章历史
- 收稿日期:2013-09-28
- 修回日期:2014-01-14
2. 兰州大学第一临床医学院, 甘肃 兰州 730000;
3. 兰州大学第二医院神经外科, 甘肃 兰州 730000
2. The First Clinical Medical College, Lanzhou University, Lanzhou 730000, China;
3. Department of Neurosurgery, the Second Hospital, Lanzhou University, Lanzhou 730000, China
脑胶质瘤(Glioma)是起源于神经上皮组织的肿瘤,大多为浸润性生长。根据2011年美国脑肿瘤注册中心报告,中枢神经系统肿瘤中恶性肿瘤约占40%[1]。目前国内外脑胶质瘤的治疗原则主要是以手术为基础联合放、化疗的综合治疗[2, 3]。
替莫唑胺(Temozolomide,TMZ)作为一种新型烷化剂类抗肿瘤药,一经上市便受到诸多好评。中国中枢神经系统胶质瘤诊断和治疗指南(2012精简版)[4]中推荐高级别胶质瘤术后应用TMZ同步放疗,放疗结束后可继续TMZ治疗,并根据具体情况调整化疗剂量和周期。同时推荐根据各地实际情况可替代使用以第一代烷化剂或亚硝脲类为代表的传统化疗药。但目前有关术后在放疗基础上应用TMZ与传统化疗药物治疗胶质瘤疗效的比较尚不清楚。
本研究收集当前世界范围内术后放疗联合TMZ及术后放疗联合传统化疗药物治疗脑胶质瘤的随机对照试验(randomized controlled trial,RCT),客观评价替莫唑胺与传统化疗药物治疗脑胶质瘤的有效性和安全性,以期为临床选择更优化疗方案提供依据。
1 材料与方法 1.1 纳入排除标准①研究类型:RCT。②研究对象:年龄≥18岁,经手术组织病理学明确诊断的脑胶质瘤患者。排除合并重大疾病、全身状况差、妊娠等患者。③干预措施:各研究均为术后放疗加化疗。试验组(TMZ组)为放疗联合TMZ,对照组(传统化疗药组)为放疗联合传统化疗药,传统化疗药主要有亚硝脲类、替尼泊苷(VM-26)、甲基苄肼(PCB)、长春新碱(VCR)等,其中亚硝脲类有尼莫司汀(ACNU)、洛莫司汀(CCNU)、福莫司汀(FCNU)等。④结局指标:治疗有效率、生存率、生存期、消化道反应、骨髓抑制及生活质量等。
1.2 检索策略计算机检索PubMed、EMBASE、the Cochrane Library、CNKI、Wan Fang Date、VIP和CBM数据库,并辅助手工检索相关期刊,检索时间均截至2013年7月。检索采用主题词与自由词相结合的方式,所有检索策略通过多次预检索后确定。中文检索式为:(胶质瘤OR神经胶质瘤OR恶性胶质瘤)AND(替莫唑胺OR蒂清),英文检索式为:(Glioma * OR Glioblastoma)AND(Temozolomide OR TMZ)AND(Random *)。
1.3 文献筛选和资料提取两名研究员按照纳入排除标准进行筛选并获取全文。按照预先设计的资料提取表格提取数据。①基本信息:作者、发表年代、发表杂志、各组病例数、平均年龄、干预措施。②结局指标:有效率、生存率、生存期、消化道反应、骨髓抑制及生活质量等。2名研究者交叉核对,如有分歧通过讨论或第3方解决。
1.4 质量评价根据Cochrane Handbook5.1偏倚风险评估工具[5],对纳入研究进行质量评价:①随机方法是否正确;②是否做到分配隐藏;③是否采用盲法;④不完整资料报告;⑤选择性结果报告;⑥其它偏倚。针对每项研究结果,对上述6条作出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的判断。
1.5 统计学处理应用Excel 2003提取并录入数据,采用RevMan 5.2软件[6]处理数据。计数资料采用相对危险度(Risk Ratio,RR)或危险比(Hazard Ratio,HR)分析统计量;计量资料采用均数差(Mean Difference,MD)或标准均数差(Standardized Mean Difference,SMD)进行统计分析。各效应量均以95%CI表示,检验水准α=0.05。对纳入的研究进行χ2检验分析异质性,若存在统计学同质性采用固定效应模型;若不具有统计学同质性(P≤0.1,I2≥50%),分析异质性来源,若无临床异质性可采用随机效应模型,必要时采用亚组分析;对不能合并的数据采用描述性分析。
2 结果 2.1 文献检索结果初检文献1061篇,最终纳入8篇研究[7, 8, 9, 10, 11, 12, 13, 14]。文献筛选流程图见图 1。各研究患者性别、年龄、肿瘤切除程度等比较差异无统计学意义(P>0.05)。
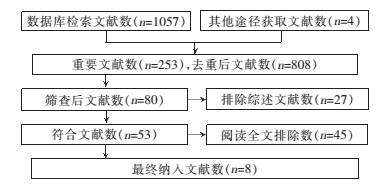
|
| 图 1文献筛选流程图 |
共纳入8篇研究[7, 8, 9, 10, 11, 12, 13, 14],864例患者,其中TMZ组374例,传统化疗药组490例。各研究放疗方案基本一致,总剂量中位剂量为60 Gy。基本特征见表 1。
| 研究 | 试验组/对照组 | 年龄 | 肿瘤级别 | KPS评分 | 试验组 | 对照组 | 测量指标 |
| 翟小明2012[7] | 48/48 | >18 | III~IV | ≥60 | 同步时TMZ 75 mg/(m2·d),42 d,放疗结束2周后序贯化疗,TMZ 150~200 mg/(m2·d),共6周期 | VM-26 1次/4周,Me-CCNU 1次/8周;4~6个月完成4~6周期化疗 | a,b,c,d |
| 武新虎2012[8] | 28/28 | 22~65 | III~IV | ≥70 | 同步时TMZ 75 mg/(m2·d),放疗完后间隔4周开始序贯化疗,第1~5天 TMZ 200 mg/(m2·d),4~6个周期 | FCNU 100 mg/m2静注,每周1次,连续3周,停药5周,维持期每3周静脉注射1次,共4~6次 | a,b,c,d |
| 郑伟2011[9] | 21/26 | 19~77 | III~IV | ≥70 | 同步时TMZ 75 mg/(m2·d),放疗结束后,间隔4周开始序贯化疗,第1~5天TMZ 150 mg/(m2·d),3~5个周期 | 第1天ACNU 90 mg/m2,第1~3天VM-26 60 mg/m2,6~8周/周期,先同步放化疗l周期,后序贯化疗3~5周期 | a,b,c,d |
| Brada M 2010[10] | 112/224 | 41~60 | III~IV复发性 | 不详 | TMZ 200 mg/(m2·d),9个周期或更多 | PCV静注,6周/周期,共6周 | b,d,e |
| 侯艳丽2008[11] | 18/16 | 13~76 | I~IV | >70 | 同步时TMZ 75 mg/(m2·d),放疗后用标准方案,4~6个周期 | 其他化疗药75 mg/(m2·d),前5天给药,28 d/周期,4~6个周期 | b,c |
| 邓研农2008[12] | 32/32 | 25~65 | II~IV | >60 | 放疗结束后1周开始化疗,TMZ 150~200 mg/(m2·d);4~6个周期 | CCNU口服,5d/周,疗程和治疗周期同TMZ组 | a,b,d |
| 刘英姿2007[13] | 26/26 | 35~64 | III~IV | >60 | 放疗后化疗,TMZ 200 mg/(m2·d);3~5个周期 | 联合用药,VM-26静注,CCNU口服,共3~5疗程 | a,b,d |
| Osoba D 2000[14] | 89/90 | 21~73 | III~IV复发性 | ≥70 | 未接受化疗者TMZ 200 mg/(m2·d),已接受化疗者TMZ 150 mg/(m2·d),28天/周期 | PCB口服125 mg/(m2·d)或150mg/(m2·d)前28天连续用药,56天/周期 | e |
纳入8个研究[7, 8, 9, 10, 11, 12, 13, 14]仅有2个研究[7, 10]报告随机方法,隐蔽分组仅有1个研究[10]报告清楚,盲法均未提及。质量评价见表 2。
纳入研究各指标的Meta分析结果见表 3。
| 结局指标 | 研究 | 病例数 | 统计方法 | 效应值 | P值 |
| 2.4.1 治疗有效率 | [7,8,9,12,13] | 315 | RR(M-H,Fixed,95%CI) | 1.48[1.24,1.77] | <0.0001 |
| 2.4.1.1 TMZ vs亚硝脲类 | [8, 12] | 120 | RR(M-H,Fixed,95%CI) | 1.57[1.18,2.09] | 0.002 |
| 2.4.1.2 TMZ vs亚硝脲类联合VM-26 | [7, 9, 13] | 195 | RR(M-H,Fixed,95%CI) | 1.42[1.13,1.79] | 0.002 |
| 2.4.2 生存率 | |||||
| 2.4.2.1 TMZ vs亚硝脲类 | |||||
| 1年生存率 | [8] | 56 | HR(Exp[(O-E)/V],Fixed,95%CI) | 5.81[2.42,13.96] | <0.0001 |
| 2年生存率 | [8] | 56 | HR(Exp[(O-E)/V],Fixed,95%CI) | 12.57[6.54,24.15] | <0.00001 |
| 3年生存率 | [8] | 56 | HR(Exp[(O-E)/V],Fixed,95%CI) | 15.26[8.45,27.56] | <0.00001 |
| 2.4.2.2 TMZ vs亚硝脲类联合VM-26 | |||||
| 1年生存率 | [7, 9] | 143 | HR(Exp[(O-E)/V],Fixed,95%CI) | 5.87[3.37,10.22] | <0.00001 |
| 2年生存率 | [7] | 96 | HR(Exp[(O-E)/V],Fixed,95%CI) | 12.82[7.52,21.86] | <0.00001 |
| 3年生存率 | [7, 9] | 143 | HR(Exp[(O-E)/V],Fixed,95%CI) | 18.14[12.53,26.27] | <0.00001 |
| 5年生存率 | [9] | 47 | HR(Exp[(O-E)/V],Fixed,95%CI) | 23.94[13.26,43.22] | <0.00001 |
| 2.4.3 无进展生存期 | [13] | 52 | MD(IV,Fixed,95%CI) | 4.00[2.61,5.39] | <0.00001 |
| TMZ vs亚硝脲类联合VM-26 | [13] | 52 | MD(IV,Fixed,95%CI) | 4.00[2.61,5.39] | <0.00001 |
| 2.4.4 平均生存期 | [12, 13] | 116 | SMD(IV,Fixed,95%CI) | 1.84[1.40,2.27] | <0.00001 |
| 2.4.4.1 TMZ vs亚硝脲类 | [12] | 64 | SMD(IV,Fixed,95%CI) | 1.92[1.32,2.51] | <0.00001 |
| 2.4.4.2 TMZ vs亚硝脲类联合VM-26 | [13] | 52 | SMD(IV,Fixed,95%CI) | 1.74[1.10,2.39] | <0.00001 |
| 2.4.5 不良反应 | |||||
| 2.4.5.1消化道反应 | [7, 8, 12] | 256 | RR(M-H,Fixed,95%CI) | 0.53[0.39,0.71] | <0.0001 |
| TMZ vs亚硝脲类 | [8, 12] | 160 | RR(M-H,Fixed,95%CI) | 0.53[0.37,0.77] | 0.0009 |
| TMZ vs亚硝脲类联合VM-26 | [7] | 96 | RR(M-H,Fixed,95%CI) | 0.52[0.32,0.83] | 0.007 |
| 2.4.5.2 II度以上骨髓抑制 | [12, 13] | 284 | RR(M-H,Fixed,95%CI) | 0.20[0.08,0.51] | 0.007 |
| TMZ vs亚硝脲类 | [12] | 64 | RR(M-H,Fixed,95%CI) | 0.29[0.06,1.27] | 0.1 |
| TMZ vs亚硝脲类联合VM-26 | [13] | 220 | RR(M-H,Fixed,95%CI) | 0.16[0.05,0.54] | 0.003 |
有5个研究报告[7, 8, 9, 12, 13]了治疗有效率。各研究间同质性较好(I2=0%),采用固定效应模型。Meta分析结果显示两亚组中TMZ组治疗有效率均优于对照组,差异有统计学意义,分别为[RR=1.57,95%CI(1.18,2.09)]和[RR=1.42,95%CI(1.13,1.79)]。总有效率TMZ组优于对照组,差异有统计学意义[RR=1.48,95%CI(1.24,1.77)]。
2.4.2 生存率 2.4.2.1 TMZ vs亚硝脲类有1个研究[8]报告1、2、3年生存率。结果显示TMZ组和亚硝脲类组中1、2、3年生存率TMZ组高于对照组,差异均有统计学意义(1年生存率[HR=5.81,95%CI(2.42,13.96)])。
2.4.2.2 TMZ vs亚硝脲类联合VM-26有2个研究[7, 9]报告1、2、3、5年生存率。结果显示TMZ组和亚硝脲类联合VM-26组中1、2、3、5年生存率TMZ组高于对照组,差异均有统计学意义(1年生存率[HR=5.87,95%CI(3.37,10.22)],5年生存率[HR=23.94,95%CI(13.26,43.22)])。
2.4.3 无进展生存期有1个研究[13]报告无进展生存期,结果显示TMZ组较长于亚硝脲类联合VM-26组,差异有统计学意义[MD=4.00,95%CI(2.61,5.39)]。
2.4.4 平均生存期有2个研究[12, 13]报告平均生存期。结果显示两亚组中平均生存期TMZ组均长于对照组,差异有统计学意义,分别为[SMD=1.92,95%CI(1.32,2.51)]和[SMD=1.74,95%CI(1.10,2.39)]。总平均生存期TMZ组长于对照组,差异有统计学意义[SMD=1.84,95%CI(1.40,2.27)]。
2.4.5 不良反应 2.4.5.1 消化道反应有3个研究[7, 8, 12]报告消化道反应。结果显示两亚组中消化道反应及发生率TMZ组均低于对照组,差异有统计学意义,分别为[RR=0.53,95%CI(0.37,0.77)]和[RR=0.52,95%CI(0.32,0.83)]。总消化道反应的发生率TMZ组低于对照组,差异有统计学意义[RR=0.53,95%CI(0.39,0.71)]。
2.4.5.2 II度以上骨髓抑制有2个研究[12, 13]报告骨髓抑制。TMZ vs亚硝脲类亚组[12]结果显示骨髓抑制的差异无统计学意义。TMZ vs亚硝脲类联合VM-26亚组[13]结果显示骨髓抑制程度TMZ组轻于对照组,差异有统计学意义[RR=0.16,95%CI(0.05,0.54)]。总骨髓抑制程度TMZ组轻于对照组,差异有统计学意义[RR=0.20,95%CI(0.08,0.51)]。
2.4.6生活质量有2个研究[10, 14]报告两组短期生活质量差异有统计学意义(P<0.05),且TMZ组患者优于传统化疗药组。
3讨论本研究以脑胶质瘤患者为研究对象,采用术后放疗联合TMZ或其他化疗药进行治疗,从治疗有效率、生存率、生存期、消化道反应、骨髓抑制及生活质量等进行了全面分析,Meta分析结果显示,TMZ在提高疗效、延长生存期、减少消化道反应和骨髓抑制等方面均优于传统化疗药,这与TMZ的药理特点密不可分。TMZ口服后吸收快而完全,生物利用度近100%,进入体内后不经肝脏代谢而广泛分布全身,能够通过血脑屏障,在脑肿瘤组织中分布浓度高,能更好地发挥细胞毒作用。在急性放射性脑损伤方面无明显差异(P>0.05)。范存刚解读ESMO《高级别胶质瘤的诊断、治疗与随访指南》[15]中指出,放疗同步TMZ化疗能显著改善高级别胶质瘤患者的中位生存期和2年、5年生存率,已成为70岁以下高级别胶质瘤患者的标准治疗方案。
与传统化疗药相比,TMZ不良反应轻微,但仍不能忽视,其常见严重不良反应为骨髓毒性[16],在应用中应注意观察。就同步联合放疗、肿瘤级别,患者年龄等与不良反应的发生是否有关系,周保元等研究[17]123例患者结果分析得知,TMZ同步放化疗后再行TMZ辅助化疗的患者,其骨髓毒性比单纯TMZ化疗明显(P=0.017)。可能因为同步放化疗时放疗的骨髓毒性和TMZ毒性有累加作用。肿瘤级别对骨髓毒性无影响。关于年龄的影响,Terri等[18]认为有一定关系,特别是在女性中,年龄31~40岁和大于60岁时骨髓毒性的风险有增加趋势。
同时,本研究存在以下局限性:①纳入研究只有部分明确报道了随机方法和过程。②纳入研究样本量偏少,每项指标可合并的数据较少。③随访时间较短,且没有严格报道发病率、病死率及生存率,故不能进行远期疗效的评价。④纳入原始研究未区分肿瘤高低级别对疗效的影响,可能会在结果合并时产生异质性。⑤对比纳入的中西方研究,国内的研究大多主要集中在干预效果的比较上,而西方研究在比较疗效之外更关注患者治疗后的生活质量,国内研究样本量较少,且质量上大多低于西方的研究。 目前替莫唑胺相较于传统化疗药治疗脑胶质瘤具有一定的优势,我们建议今后在患者经济条件允许的情况下首选替莫唑胺。此外,建议今后该类随机对照试验严格按照CONSORT[19]统一标准设计和实施,以提高研究质量。
| [1] | Central brain tumor registry of the United States. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2004-2007. Hinsdale,IL:2011.http://www.cbtrus.org/2011-NPCR-SEER/WEB-0407-Report-3-3-2011.pdf. Accessed 27 May 2013. |
| [2] | 高进苗,张晓东.大脑胶质瘤病的临床诊治进展.国际神经病学神经外科学杂志,2012,39(5):434-438. |
| [3] | Rolle CE,Sengupta S,Lesniak MS. Challenges in clinical design of immunotherapy trials for malignant glioma. Neurosurgery clinics of North America,2010,21(1):201-214. |
| [4] | 《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断和治疗指南(2012精简版).中华医学杂志,2012,92(33):2309-2313. |
| [5] | Higgins JPT,Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration,2011. Available from www.cochrane-handbook.org. |
| [6] | ReviewManager (RevMan) (Computer program). Version 5.2. Copenhagen: The Nordic Cochrane Centre,The Cochrane Collaboration,2012. |
| [7] | 翟小明,王建平,张军宁,等.成人脑恶性胶质瘤术后两种同步放化疗方案的疗效比较.南方医科大学学报,2012,32(2): 255-257. |
| [8] | 武新虎,朱锡旭,沈泽天,等. 替莫唑胺与福莫司汀治疗恶性脑胶质瘤的临床观察. 现代肿瘤医学,2012,20(6):1165-1168. |
| [9] | 郑伟,聂青,康静波,等. 高级别脑胶质瘤患者术后同步放化疗的临床疗效研究. 中华神经医学杂志,2011,10(9):900-904. |
| [10] | Brada M,Stenning S,Gabe R,et al. Temozolomide versus procarbazine,lomustine,and vincristine in recurrent high-grade glioma. Journal of clinical oncology: official journal of the American Society of Clinical Oncology,2010,28(30): 4601-4608. |
| [11] | 侯艳丽,白永瑞,吴旭东,等. 脑胶质瘤术后三维适形放射治疗的疗效分析. 上海交通大学学报(医学版),2008,(8):934-936. |
| [12] | 邓研农. 替莫唑胺与洛莫司汀治疗脑胶质瘤的临床观察. 肿瘤防治研究,2008,35(10):737-739. |
| [13] | 刘英姿,张学新,张磊,等. 单用替莫唑胺与替尼泊甙联合洛莫司汀治疗恶性胶质瘤的比较. 临床荟萃,2007,22(16):1154-1156. |
| [14] | Osoba D,Brada M,Yung WK,et al. Health-related quality of life in patients treated with temozolomide versus procarbazine for recurrent glioblastoma multiforme. Journal of clinical oncology:official journal of the American Society of Clinical Oncology,2000,18(7):1481-1491. |
| [15] | 范存刚,张庆俊. 解读ESMO《高级别胶质瘤的诊断、治疗与随访指南》. 国际神经病学神经外科学杂志,2012,39(6):566-569. |
| [16] | Niewald M,Berdel C,Fleckenstein J,et al. Toxicity after radiochemotherapy for glioblastoma using temozolomide a retrospective evaluation. Radiat Oncol,2011,21(6):141-147. |
| [17] | 周保元,毛庆,王鹏,等. 替莫唑胺在胶质瘤化疗中的不良反应分析. 中国神经肿瘤杂志,2012,01:14-18. |
| [18] | Terri S,Armstrong,Yumei Cao,et al. Risk analysis of severe myelotoxicity with temozolomide: The effects of clinical and genetic factors. Neuro Oncol,2009,11(6):825-832. |
| [19] | Altman DG,Schulz KF,Moher D,et al. The revised CONSORT statement for reporting randomized trials: explanation and elaboration. Ann Intern Med,2001,134(8):663-694. |
 2014, Vol. 41
2014, Vol. 41

