2. 529070, 中山大学附属江门医院放射科
2. Department of Radiology, the Affiliated Jiangmen Hospital of Sun Yat-sen University, Jiangmen 529070, China
肾上腺是恶性肿瘤常见的转移部位之一,在有恶性肿瘤病史的患者中发现的肾上腺异常中,高达50%为转移性病灶所致[1],是否发生肾上腺转移关系到恶性肿瘤的临床分期。同时,肾上腺良性病变如肾上腺腺瘤,是普通人群中常见的无症状肾上腺良性肿瘤,可以规律随访观察。因此,肾上腺病变的准确诊断对处理策略和治疗方案的选择至关重要。目前,CT和MRI是肾上腺病变常用的影像学诊断方法,但对于部分患者仍存在诊断困难的问题。18F-FDG PET/CT能够同时提供解剖信息和代谢信息,可进行相对定量分析,作为无创性影像学检查手段,对肾上腺转移瘤和良性病变的鉴别具有一定的优势[2]。笔者回顾性分析无症状肾上腺病变患者的18F-FDG PET/CT影像学检查资料,分析18F-FDG PET/CT对肾上腺良恶性病变诊断的准确程度,并探讨18F-FDG PET/CT各项参数对肾上腺转移瘤的预测诊断价值。
1 资料与方法 1.1 一般资料回顾性分析2012年12月至2016年10月于我院行PET/CT检查发现的肾上腺病变患者,将患者分为肾上腺转移瘤组和肾上腺良性病变组。肾上腺转移瘤组纳入标准(满足下列1个条件即可入组):①经组织病理学证实;②与既往影像学资料对比,肾上腺病变为新发病灶;③原发恶性肿瘤治疗后肾上腺病变缩小超过20%[3]。肾上腺良性病变组纳入标准(满足下列1个条件即可入组):①经组织病理学证实;②随访复查肾上腺病变6个月以上无明显变化。肾上腺良性病变包括肾上腺腺瘤、皮质腺瘤、髓样脂肪瘤、肾上腺囊肿、肾上腺结核等。排除标准(肾上腺转移瘤组和肾上腺良性病变组):①未能规律随访复查的患者;②肝脏疾病影响测量结果,如脂肪肝、肝硬化、肝脏肿瘤等;③失访的患者。共纳入符合标准的患者95例,其中男性68例,女性27例;年龄27~93岁,平均年龄(59.7±11.2)岁。肾上腺良性病变组:男性36例,女性19例,平均年龄(59.2±11.2)岁;肾上肾转移瘤组:男性32例,女性8例,平均年龄(60.3±11.2)岁。肾上腺转移瘤组40例,原发恶性肿瘤分别为:肺癌23例,结肠癌4例,胰腺癌4例,胃癌3例,鼻咽癌2例,乳腺癌2例,舌癌1例,卵巢癌1例。肾上腺良性病变组55例,1例经穿刺活检证实为肾上腺结核,其余均经随访观察证实,平均随访时间15个月。本研究经我院医学伦理委员会批准([2018]35号),所有患者均在检查前签署了知情同意书。
1.2 PET/CT显像方法采用美国GE公司Discovery VCT 64型PET/CT扫描仪,18F-FDG由广州原子高科有限公司提供(放化纯度>95%)。检查前患者禁食至少6 h,空腹血糖水平控制在8.1 mmol/L以下,18F-FDG注射剂量为3.70~5.55 MBq/kg(0.1~0.15 mCi/kg),注射后患者于暗室内安静平卧休息60 min,PET/CT检查前排空小便。图像采集从颅底至股骨中段。CT扫描参数:管电压120 kV,自动管电流技术80~200 mA,转速0.6 r/s,螺距0.516:1。PET扫描参数:采用三维方式采集5~7个床位,每个床位3 min,层厚3.75 mm,采用标准重建法重建,矩阵512×512,重建层厚1.25 mm;采集完成后利用CT数据对PET图像进行衰减校正,重建横断位、冠状位及矢状位图像。注射显像剂2 h后行肾上腺病灶局部延迟显像,检查条件同首次显像,早期显像和延迟显像的时间间隔为1 h。
1.3 图像分析由1名主任医师和1名副主任医师分别对PET/CT图像进行单独阅片,意见不一致时协商达成一致。在PET图像上,根据病变位置勾画ROI后由工作站软件自动计算肾上腺病灶的SUVmax和肝脏本底SUVmax,再计算出两者的比值,用SUVmax比值表示。测量肾上腺病灶的CT值和病变大小,病变大小采用横断位最大层面长径和垂直径的均值表示。
1.4 统计学方法采用SPSS 20.0软件进行统计学分析。肾上腺良恶性病变组之间的差异比较采用单因素分析,定性资料,包括性别、病变部位之间的差异采用χ2检验;定量资料采用x±s表示,符合正态分布且方差具有齐性,采用独立样本t检验;方差不齐采用Mann-Whitney U秩和检验;将单因素分析得出有统计学意义的指标纳入多因素Logistic回归分析;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析,得到鉴别诊断肾上腺良、恶性病变的最佳临界点,计算灵敏度和特异度。P < 0.05表示差异有统计学意义。
2 结果 2.1 一般情况95例患者中,共检查出110个肾上腺病灶,其中良性病变60个,转移瘤50个;双侧病灶15例,单侧病灶80例(其中左侧63例,右侧17例)。肾上腺良性病变组:41例为左侧肾上腺病变(图 1),9例为右侧肾上腺病变,5例为双侧肾上腺病变。肾上腺转移瘤组:22例为左侧肾上腺病变,8例为右侧肾上腺病变,10例为双侧肾上腺病变(图 2)。肾上腺良性病变组与转移瘤组在性别、年龄和病变部位间的差异均无统计学意义(χ2=2.408、t=-0.466、χ2=5.217,均P>0.05),见表 1。
|
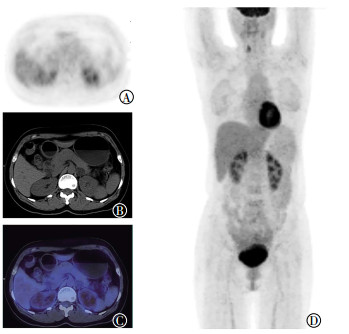
图 1 左侧肾上腺良性结节18F-FDG PET/CT显像图 Figure 1 18F-FDG PET/CT images of one benign nodule in the left adrenal gland 患者女性,39岁。图中,A~D:分别为PET图像、CT横断面图像、PET/CT融合图像和PET显像最大密度投影图像,PET/CT显像示左侧肾上腺结节糖代谢无异常增高,大小为2.1 cm×2.0cm,CT值为5.3HU,SUVmax=2.4,SUVmax比值为0.89,随访18个月左侧肾上腺结节未见明显变化。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值。 |

|
图 2 右上肺癌双侧肾上腺转移瘤18F-FDG PET/CT显像图 Figure 2 18F-FDG PET/CT images of bilateral adrenal metastatic lesions in one patient with right upper lobe lung cancer 患者男性,68岁。图中,A~C:分别为PET图像、CT横断面图像和PET/CT融合图像,PET/CT显像示双侧肾上腺肿块糖代谢异常增高,左、右肾上腺SUVmax分别为6.7、6.5,大小分别为5.5 cm×3.0 cm、5.0 cm×3.0 cm,CT值分别为25.6、32.2 HU,SUVmax比值分别为2.79、2.71;D:PET显像最大密度投影图像,示右上肺癌除双侧肾上腺转移之外,还伴有淋巴结、肺内、肝脏、右侧肱骨多发转移。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;SUVmax:最大标准化摄取值。 |
| 表1 肾上腺良性病变组与转移瘤组间的患者性别、年龄、病变部位的比较 Table 1 The comparison of sex, age, lesion location between adrenal benign group and metastasis group |
110个肾上腺病灶的大小为0.65~5.70 cm,平均大小为(1.65±0.82)cm;CT值为-20.4~46.8 HU,平均CT值为(24.2±14.9)HU;SUVmax为1.1~31.9,平均SUVmax为4.5±4.6;肝脏本底SUVmax为1.7~4.0,平均肝脏本底SUVmax为2.4±0.4;SUVmax比值为0.44~14.5,平均SUVmax比值为1.99±2.15。肾上腺转移瘤组病灶的大小、CT值、SUVmax、SUVmax比值均高于良性病变组,两者间差异具有统计学意义(Z=-4.908、-6.030、-7.966、-8.252,均P < 0.001),见表 2。
| 表2 肾上腺良性病变组与转移瘤组间单因素比较 Table 2 The comparison of monofactor between adrenal benign group and metastasis group |
将病灶大小、CT值、SUVmax、SUVmax比值纳入多因素Logistic回归分析,采用Enter法逐步回归,得出肾上腺转移瘤的独立危险因素是SUVmax比值(回归系数为2.581,P < 0.001),95%CI为3.806~45.870。将SUVmax比值进行ROC分析,曲线下面积为0.958,最佳诊断临界点为1.24,灵敏度、特异度分别为90.0%、93.3%,提示利用SUVmax比值诊断肾上腺转移瘤的准确率较高,为91.8%(曲线下面积>0.9),临界点为1.24时,正确诊断指数最大为83.3%,见图 3。

|
图 3 肾上腺转移瘤SUVmax比值最佳临界值的受试者工作特征曲线 Figure 3 The cut-off value of SUVmax ratio in the analysis of receiver operating characteristic curve in adrenal metastasis diagnosis 图中, SUVmax:最大标准化摄取值。 |
18F-FDG PET/CT显像是分子影像学成像方法,在恶性肿瘤疾病的临床诊断与治疗评估中具有重要价值。恶性肿瘤患者PET/CT全身检查时发现肾上腺病变,判断其是否为转移性病变是关键问题。随着医学影像学的发展和广泛使用,肾上腺偶发病变的发现率逐渐增高。Song等[4]观察了1049例无恶性肿瘤病史的偶发肾上腺病变,发现全部为良性病变。通过对比分析肾上腺病变的PET/CT影像学表现,提高肾上腺病变的综合影像诊断水平,可以避免采取侵入性的诊断手段(如手术切除和穿刺活检等)进行诊断。
传统的影像学检查方法(如CT和MRI)可用于检测和诊断肾上腺病变[5-6],肾上腺腺瘤为最常见的肾上腺良性病变,其胞质内含有脂肪成分,CT平扫呈低密度,MRI同反相位对比信号减低,具有一定的特征性[7]。肾上腺转移瘤生长速度快,侵袭性强,病变范围大于肾上腺良性病变。本研究中良性病变组平均直径小于转移瘤组平均直径,差异有统计学意义(P < 0.001)。CT值较病灶大小能更好地区分肾上腺良恶性病变,CT值< 10 HU时,其诊断腺瘤的灵敏度为71%,特异度高达98%[7]。本研究良性病变组平均CT值明显低于转移瘤组,两者间差异具有统计学意义,与文献报道一致[7]。但在临床实际工作中,约有30%的腺瘤脂肪成分少,CT值>10 HU时,难以与转移瘤鉴别,同时由于CT扫描技术不同,测量的CT值会产生部分偏差[8]。
18F-FDG PET/CT显像主要是通过代谢信息评估肾上腺是否转移,转移瘤血供丰富,代谢活跃,摄取18F-FDG程度明显增高[9]。有文献报道18F-FDG PET/CT在鉴别肺癌患者肾上腺转移瘤与肾上腺良性肿块上具有重要作用,诊断的灵敏度为88.7%,特异度为90.8%,ROC曲线下面积为0.9622,总体诊断准确率为90.77%[10]。本研究中,肾上腺良性病变的平均SUVmax为2.1±0.9,转移瘤平均SUVmax为7.5±5.6,后者均明显高于前者,两者的差异有统计学意义,从而证实SUVmax的诊断价值。Metser等[11]通过研究,确定SUVmax=3.1为诊断肾上腺良恶性病变的最佳诊断界值。
Cho等[12]指出SUVmax比值可以很好地鉴别肺癌肾上腺转移,SUVmax比值联合CT值可以提高肺癌肾上腺转移的诊断准确率,当SUVmax比值>1.3且CT值>18 HU时预测肺癌肾上腺转移的灵敏度高达97.7%,特异度为81.2%,准确率为93.4%。Kim等[13]研究指出,在明确有原发肿瘤病史的患者中,年龄、CT值>10 HU、SUVmax比值>2.5以及其他部位的转移灶是预测肾上腺转移的危险因素,联合诊断的灵敏度、特异度、准确率分别高达92.0%、88.4%、90.8%。左侧肾上腺转移瘤发生率较高,占50.3%。本研究中,55%(22/40)的患者发生左侧肾上腺转移,与文献报道一致[13]。Kim等[14]另一项研究证实,当SUVmax为2.54、SUVmax比值为1.4时,诊断肺癌肾上腺转移的灵敏度为87%,特异度为100%。Kunikowska等[15]认为,肾上腺/肝脏SUVmax的比值>1.53且肾上腺SUVmax>5.2时,PET/CT对肾上腺肿瘤的诊断灵敏度、特异度、阳性预测值较高;多因素分析表明肾上腺/肝脏的SUVmax比值是一个独立的预测因素。Launay等[16]研究结果显示,肾上腺腺瘤的SUVmax、肾上腺/肝脏的SUVmax比值明显低于恶性肿瘤,SUVmax < 3.7或SUVmax比值< 1.29对肾上腺良性病变有较高的预测价值。本研究将肾上腺病变的大小、CT值、SUVmax、SUVmax比值纳入多因素Logistic回归分析,得出SUVmax比值是预测肾上腺转移瘤的独立危险因素,SUVmax比值= 1.24是最佳诊断界值,其灵敏度、特异度分别为90.0%、93.3%,ROC曲线下面积为0.958,与上述文献报道基本一致。本文研究对象中原发恶性肿瘤不仅纳入肺癌患者,也包括了其他恶性肿瘤。
PET/CT显像对诊断肾上腺良恶性病变具有明显的优势,但部分良性病变(如嗜铬细胞瘤、肾上腺结核等)也会不同程度地摄取18F-FDG,需结合病史及实验室检查明确诊断。本研究中有1例肾上腺病灶SUVmax高达6.2,结合影像学表现及既往病史诊断为肾上腺结核,后经穿刺活检证实。部分体积较小的肾上腺转移瘤及神经内分泌肿瘤肾上腺转移会引起假阴性,需要结合病史和实验室检查综合鉴别诊断。
本研究的局限性:①因是回顾性研究,收集资料难免存在选择性偏倚;②大部分肾上腺病变性质根据临床病史和随访复查证实;③样本量较小。今后应增加样本量,多纳入经组织病理学证实的病例,对具体的肾上腺病变展开研究。
综上所述,18F-FDG PET/CT显像对无症状的肾上腺病变具有很高的诊断价值。SUVmax比值是肾上腺转移瘤的一个独立危险预测因素,SUVmax比值为1.24是鉴别诊断肾上腺良性病变与转移瘤的最佳临界点。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 段晓蓓负责论文命题的提出、设计,收集病例,数据分析及论文撰写;陈相猛负责图像阅读、论文指导;黄斌豪负责论文审阅;邹伟强、秦贵磷、吴月娥负责收集病例、查阅相关资料。
| [1] | Mayo-Smith WW, Boland GW, Noto RB, et al. State-of-the-art adrenal imaging[J]. Radiographics, 2001, 21(4): 995–1012. DOI:10.1148/radiographics.21.4.g01jl21995 |
| [2] | Kumar R, Xiu Y, Yu JQ, et al. 18F-FDG PET in evaluation of adrenal lesions in patients with lung cancer[J]. J Nucl Med, 2004, 45(12): 2058–2062. |
| [3] | Vikram R, Yeung HD, Macapinlac HA, et al. Utility of PET/CT in differentiating benign from malignant adrenal nodules in patients with cancer[J]. AJR Am J Roentgenol, 2008, 191(5): 1545–1551. DOI:10.2214/AJR.07.3447 |
| [4] | Song JH, Chaudhry FS, Mayo-Smith WW. The incidental adrenal mass on CT:prevalence of adrenal disease in 1, 049 consecutive adrenal masses in patients with no known malignancy[J]. AJR Am J Roentgenol, 2008, 190(5): 1163–1168. DOI:10.2214/AJR.07.2799 |
| [5] |
曲倩倩, 董印, 韩雪, 等.
扩散加权成像对肾上腺肿瘤的鉴别诊断价值[J]. 医学影像学杂志, 2015, 25(3): 492–495.
Qu QQ, Dong Y, Han X, et al. The use of diffusion weighted imaging in the differential diagnosis of adrenal tumor[J]. J Med Imaging, 2015, 25(3): 492–495. |
| [6] |
谢君伟, 左庆国, 王都.
多层螺旋CT与MRI在嗜铬细胞瘤诊断中的价值[J]. 国际放射医学核医学杂志, 2011, 35(4): 245–248.
DOI:10.3760/cma.j.issn.1673-4114.2011.04.013 Xie JW, Zuo QG, Wang D. The value of CT and MRI in diagnosis of pheochromocytoma[J]. Int J Radiat Med Nucl Med, 2011, 35(4): 245–248. DOI:10.3760/cma.j.issn.1673-4114.2011.04.013 |
| [7] | Boland GW, Lee MJ, Gazelle GS, et al. Characterization of adrenal masses using unenhanced CT:an analysis of the CT literature[J]. AJR Am J Roentgenol, 1998, 171(1): 201–204. DOI:10.2214/ajr.171.1.9648789 |
| [8] | Mansmann G, Lau J, Balk E, et al. The clinically in apparent adrenal mass:update in diagnosis and management[J]. Endocr Rev, 2004, 25(2): 309–340. DOI:10.1210/er.2002-0031 |
| [9] | Brady MJ, Thomas J, Wong TZ, et al. Adrenal nodules at FDG PET/CT in patients known to have or suspected of having lung cancer:a proposal for an efficient diagnostic algorithm[J]. Radiology, 2009, 250(2): 523–530. DOI:10.1148/radiol.2502080219 |
| [10] | Wu Q, Luo W, Zhao Y, et al. The utility of 18F-FDG PET/CT for the diagnosis of adrenal metastasis in lung cancer:a PRISMA-compliant meta-analysis[J]. Nucl Med Commun, 2017, 38(12): 1117–1124. DOI:10.1097/MNM.0000000000000757 |
| [11] | Metser U, Miller E, Lerman H, et al. 18F-FDG PET/CT in the evaluation of adrenal masses[J]. J Nucl Med, 2006, 47(1): 32–37. |
| [12] | Cho AR, Lim I, Na II, et al. Evaluation of Adrenal Masses in Lung Cancer Patients Using 18F-FDG PET/CT[J]. Nucl Med Mol Imaging, 2011, 45(1): 52–58. DOI:10.1007/s13139-010-0064-6 |
| [13] | Kim JY, Kim SH, Lee HJ, et al. Utilisation of combined 18F-FDG PET/CT scan for differential diagnosis between benign and malignant adrenal enlargement[J/OL]. Br J Radiol, 2013, 86(1028): 20130190[2018-04-01]. https: //www. birpublications. org/doi/pdf/10. 1259/bjr. 20130190. DOI: 10.1259/bjr.20130190. |
| [14] | Kim BS, Lee JD, Kang WJ. Differentiation of an adrenal mass in patients with non-small cell lung cancer by means of a normal range of adrenal standardized uptake values on FDG PET/CT[J]. Ann Nucl Med, 2015, 29(3): 276–283. DOI:10.1007/s12149-014-0937-3 |
| [15] | Kunikowska J, Matyskiel R, Toutounchi S, et al. What parameters from 18F-FDG PET/CT are useful in evaluation of adrenal lesions?[J]. Eur J Nucl Med Mol Imaging, 2014, 41(12): 2273–2280. DOI:10.1007/s00259-014-2844-1 |
| [16] | Launay N, Silvera S, Tenenbaum F, et al. Value of 18-F-FDG PET/CT and CT in the Diagnosis of Indeterminate Adrenal Masses[J/OL]. Int J Endocrinol, 2015, 2015: 213875[2018-04-01]. https: //www. ncbi. nlm. nih. gov/pmc/articles/PMC4333271/pdf/IJE2015-213875. pdf. DOI: 10.1155/2015/213875. |
 2018, Vol. 42
2018, Vol. 42


