在我国,原发性支气管癌(简称肺癌)的发病率和病死率逐年上升[1],肺癌患者在治疗前必须有明确的病理诊断,及时准确地进行病理学诊断是临床的迫切要求。CT引导下经皮肺穿刺活检术作为一种微创诊断技术,在对周围型肺癌诊断中的价值已得到认可[2]。我们对275例周围型肺占位患者行SPECT的同机定位CT引导下经皮肺穿刺活检术,并联合肺癌血清肿瘤标志物检测,旨在探讨其对周围型肺癌的诊断价值。
1 资料与方法 1.1 一般资料分析我院2013年10月至2016年3月的275例周围型肺占位患者,其中男性165例、女性110例,年龄22~78岁,平均年龄(51.6±14.1)岁。术前记录患者肿瘤标志物的水平,包括癌胚抗原(carcino-embryonic antigen,CEA)、神经元特异烯醇化酶(neuron-specific enolase,NSE)、细胞角蛋白19片段21-1(CYFRA21-1)。所有患者在检查前均签署了知情同意书,该研究得到了我院伦理委员会的批准。
1.2 仪器和治疗方法采用美国GE公司的Infinia VC Hawkeye型SPECT/CT仪器(同机CT为具有定位价值的低剂量CT)及18G 100 mm的半自动切割活检针(意大利HS Hospital Service S.P.A Precisa)进行经皮肺穿刺活检术。低剂量CT采集条件:管电压140 kV,管电流2.5 mA,视野40 cm,矩阵128 mm×128 mm,层厚1 cm,图像重建层厚5 mm。根据病变部位选择仰卧位、俯卧位、侧卧位3种体位。常规消毒,2%利多卡因局部浸润麻醉至胸膜,根据SPECT的定位CT扫描确定穿刺点、进针角度、深度并进行穿刺。然后立即再次扫描确认针尖在肿块内后,使用半自动切割活检枪进行活检,在不同部位重复操作2~3次,组织取材长度1.0~1.5 cm。穿刺组织标本用10%甲醛溶液固定并送病理学检查。穿刺结束后立即行胸部扫描观察有无气胸、肺出血等并发症,术后嘱患者平卧休息、避免剧烈咳嗽。
1.3 分组根据穿刺病理结果将所有病例分为两组:(1)恶性组,穿刺活检证实或穿刺涂片找到恶性肿瘤细胞;(2)良性组,穿刺活检证实或穿刺涂片未找到恶性肿瘤细胞。
1.4 良恶性病变判定标准[3]恶性病变判定标准:手术、穿刺或支气管镜活检证实或痰涂片找到恶性肿瘤细胞。良性病变判定标准:手术病理证实无恶性肿瘤细胞,抗炎治疗后或肺CT随访1年以上病灶缩小或消失。
1.5 统计学方法采用SPSS13.0软件进行统计学分析,各组实验数据经检验符合正态分布,以均数±标准差表示,根据方差齐性与否,两组间的比较采用两独立样本t检验或近似t检验,采用受试者工作特征曲线分析NSE值对小细胞肺癌(small cell lung carci-noma, SCLC)与非小细胞肺癌(non-small cell lung carcinoma,NSCLC)的鉴别诊断效能。P < 0.05表示差异有统计学意义。
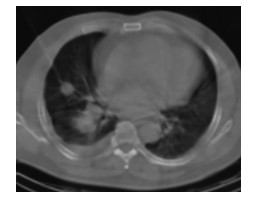
2 结果 2.1 肺穿刺病理结果275例患者均穿刺成功,成功率100%,包括58例肺小结节(图 1)。穿刺病理结果显示,恶性组198例,包括肺癌193例(NSCLC 166例:腺癌133例、鳞癌32例、腺鳞癌1例;SCLC 23例;找到癌细胞但未明确病理类型4例)、肉瘤样癌2例、恶性淋巴瘤2例、转移瘤1例;良性组77例,包括肺炎42例(真菌性肺炎1例、机化性肺炎4例、肉芽肿性炎2例、其他急慢性肺炎35例)、肺结核8例、炎性假瘤5例、尘肺3例,肺泡组织、坏死组织、纤维组织或组织细胞浸润19例。
|
图 1 定位CT引导肺小结节穿刺活检图断 Figure 1 Needle biopsy picture of small lung nodules guided by localization CT 患者男性,55岁,体检发现右肺结节,穿刺病理结果为腺癌。 |
根据良恶性判定方法,恶性组198例患者全部获得正确诊断。良性组77例患者中,71例经手术、治疗好转或随访诊断为良性病变;6例误诊病例中,3例穿刺结果为坏死组织,经支气管镜或痰涂片找到恶性肿瘤细胞并确诊肺癌,1例穿刺结果为慢性炎症,纤支镜确诊为鳞癌,2例穿刺结果为纤维组织,手术病理确诊为腺癌。肺穿刺的灵敏度、特异度和准确率分别为97.01%(198/204)、100%(71/71)和97.82%(269/275)。
2.3 并发症所有患者穿刺后均未出现严重并发症。气胸发生率为5.45%(15/275),其中2例行胸腔穿刺抽气后治愈,其余自行吸收;出血发生率为12.73%(35/275),其中针道渗血28例,少量咳血7例,予止血药物后症状好转;胸闷、心慌、出汗等轻度胸膜反应发生率为3.64%(10/275),10例患者均经休息后症状好转。
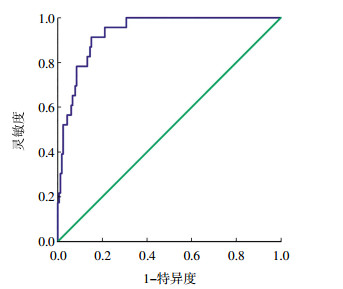
2.4 NSCLC与SCLC血清CEA、NSE、CYFRA21-1水平比较166例NSCLC与23例SCLC的肿瘤标志物水平进行比较,4例未明确病理类型的肺癌被排除。NSCLC与SCLC血清CEA、CYFRA21-1值之间的差异无统计学意义(t=1.081、0.666,均P>0.05),SCLC的NSE值高于NSCLC,两者之间的差异有统计学意义(t=3.671,P < 0.05)(表 1)。通过受试者工作特征曲线评估NSE值对SCLC与NSCLC的鉴别诊断效能,得到曲线下面积为0.935(图 2),根据统计结果中自动生成的各截断点的灵敏度和1-特异度,采用Youden指数法计算出最佳诊断界值点为26.86 ng/mL,取26.86 ng/mL作为阈值鉴别SCLC与NSCLC,所得灵敏度、特异度分别为91.34%、84.92%。
| 表1 非小细胞肺癌与小细胞肺癌CEA、NSE、CYFRA21-1水平的比较(x± s) Table 1 Comparison of CEA, NSE and CYFRA21-1 levels in non-small cell lung cancer and small cell lung cancer(x± s) |
|
图 2 神经元特异烯醇化酶值区分小细胞肺癌与非小细胞肺癌的受试者工作特征曲线分析 Figure 2 Receiver operating characteristic curve analysis of neuron-specific enolase value in differentiating small cell lung cancer from non small cell lung cancer |
目前临床上肺部病变获得病理学诊断常用方法有纤维支气管镜活检、外科手术切除病理及影像设备(CT、B超[4])引导下经皮肺穿刺活检术。CT引导下肺穿刺活检术具有方便、安全、准确、微创等诸多优点,特别是对病变位于肺周围及支气管镜不能到达的病灶的诊断具有明显的优势[2-5],与超声引导比较,优势同样明显[6]。SPECT的同机CT包括定位CT和诊断级CT,本研究采用SPECT的同机定位CT引导下进行肺穿刺活检术,探讨在定位CT引导下进行肺穿刺活检术的可行性。国内外文献报道,肺穿刺活检对肺恶性肿瘤诊断的灵敏度、特异度、准确率分别为67%~97%、90%~100%、74%~99%[5-8]。本研究中的275例患者均穿刺成功,成功率100%,肺穿刺活检诊断的灵敏度、特异度、准确率分别为97.01%、100%、97.82%,与上述文献报道结果类似,表明同机定位CT引导下进行肺穿刺活检是可行的,尽管图像质量不如诊断级CT清晰,但完全可以获得实施穿刺所要求的影像。
尽管肺穿刺活检对肺癌的诊断具有较高的准确率,但也有其局限性。本研究的结果中出现6例假阴性,穿刺病理结果为坏死组织、纤维组织等非特异性结果,假阴性率为2.94%。另外,肺穿刺活检术后的并发症不可避免,以气胸、出血最为常见[9-12]。本研究中有15例患者出现气胸,发生率为5.45%;针道渗血28例,少量咳血7例,发生率为12.73%,与既往文献报道类似[7, 12]。本研究中患者的并发症发生率较低,表明同机定位CT引导下进行肺穿刺活检是安全的。
SCLC的治疗以化疗、放疗为主,而NSCLC的治疗以手术切除或手术辅以放化疗为主[13],因此,术前无创性鉴别SCLC和NSCLC具有较高的实用价值。ROC曲线下面积表示诊断系统的诊断效能,曲线下面积一般位于0.5~1.0之间,其值越接近1.0诊断效能就越高,当曲线下面积为0.5~0.7时,诊断准确率较低,其值为0.7~0.9时诊断准确率中等,而其值为0.9~1.0时诊断准确率较高[14]。本研究用ROC评价肺癌肿瘤标志物对SCLC和NSCLC的鉴别价值,研究结果表明,SCLC和NSCLC的CEA、CYFRA21-1值之间不存在差异性,不可用来区分SCLC和NSCLC。但SCLC的NSE值明显高于NSCLC,通过ROC曲线评估其鉴别诊断效能,ROC曲线下面积为0.935,诊断准确率较高,因此,NSE值可用来区分SCLC和NSCLC。本研究取26.86 ng/mL作为诊断阈值(高于此值为SCLC,低于此值为NSCLC)鉴别SCLC与NSCLC,所得灵敏度、特异度分别为91.34%、84.92%,均较高。因此,NSE值异常增高是诊断SCLC的较灵敏指标。NSE值异常增高,超过26.86 ng/mL趋向于为SCLC时,要积极行肺穿刺活检明确诊断,不能轻率地行手术治疗。本研究SCLC例数较少,所得结论还有待于今后大样本病例进一步证实。
总之,SPECT的同机定位CT引导下经皮肺穿刺活检术是可行的,术后患者并发症少,痛苦小,所受辐射剂量小,不失为一种很好的诊断肺癌的微创手段。通过NSE值可有效鉴别SCLC和NSCLC,联合经皮肺穿刺活检术对周围型肺癌的诊断具有重要价值。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 陈鹏、陆武负责研究方法提出、设计、建立及论文审阅;陈鹏负责论文起草或最终版本修订;宋长祥、刘永、袁小帅、杜鹏负责研究过程的实施及数据的获取、提供与分析等工作。
| [1] |
万书友, 侯明杰, 马丽.
CT引导下肺部肿块穿刺技术的临床应用[J]. 中国社区医师, 2014, 30(4): 93, 95.
DOI:10.3969/j.issn.1007-614x.2014.4.60 Wan SY, Hou MJ, Ma L. Clinical application of CT guided lung mass puncture technique[J]. Chin Comm Doctors, 2014, 30(4): 93, 95. DOI:10.3969/j.issn.1007-614x.2014.4.60 |
| [2] |
韦莉, 刘航, 秦志强, 等.
CT引导经皮肺穿刺活检对肺周围型病变的诊断价值与安全性[J]. 微创医学, 2014, 9(1): 40–42.
DOI:10.11864/j.issn.1673.2014.01.13 Wei L, Liu H, Qin ZQ, et al. Diagnostic value and safety of CT-guided percutaneous puncture biopsy in diagnosis of peripheral pulmonary disease[J]. J Minimally Invasive Med, 2014, 9(1): 40–42. DOI:10.11864/j.issn.1673.2014.01.13 |
| [3] |
杨雯, 李倩, 孙文逵, 等.
CT引导下经皮肺穿刺活检在老年孤立性肺结节中的应用[J]. 临床肿瘤学杂志, 2014, 19(11): 1015–1018.
Yang W, Li Q, Sun WK, et al. CT-guided percutaneous lung biopsy for the elderly pulmonary nodules[J]. Chin Clin Oncol, 2014, 19(11): 1015–1018. |
| [4] |
杨志英, 郑浩, 张琦, 等.
超声引导经皮肺穿刺在周围型肺部病变诊断中的价值[J]. 临床肿瘤学杂志, 2014, 19(5): 449–451.
Yang ZY, Zheng H, Zhang Q, et al. Clinical application of ultrasound-guided percutaneous lung biopsy in peripheral pulmonary masses[J]. Chin Clin Oncol, 2014, 19(5): 449–451. |
| [5] | Laspas F, Roussakis A, Efthimiadou R, et al. Percutaneous CT-guided fine-needle aspiration of pulmonary lesions:Results and complications in 409 patients[J]. J Med Imaging Radiat Oncol, 2008, 52(5): 458–462. DOI:10.1111/j.1440-1673.2008.01990.x |
| [6] | Battafarano RJ, Fernandez FG, Ritter J, et al. Large cell neuroendocrine carcinoma:an aggressive form of non-small cell lung cancer[J]. J Thorac Cardiovasc Surg, 2005, 130(1): 166–172. DOI:10.1016/j.jtcvs.2005.02.064 |
| [7] | Montaudon M, Latrabe V, Pariente A, et al. Factors influencing accuracy of CT-guided percutaneous biopsies of pulmonary lesions[J]. Eur Radiol, 2004, 14(7): 1234–1240. DOI:10.1007/s00330-004-2250-3 |
| [8] |
李凤, 谢雪梅, 徐洪涛.
CT引导经皮肺穿刺活检诊断效果评估和并发症原因分析[J]. 西部医学, 2015, 27(10): 1572–1574.
DOI:10.3969/j.issn.1672-3551.2015.10.039 Li F, Xie XM, Xu HT. Diagnostic efficiency of CT-guided percutaneous for lung biopsies[J]. Med J West China, 2015, 27(10): 1572–1574. DOI:10.3969/j.issn.1672-3551.2015.10.039 |
| [9] | Yao X, Gomes MM, Tsao MS, et al. Fine-needle aspiration biopsy versus core-needle biopsy in diagnosing lung cancer:a systematic review[J]. Curr Oncol, 2012, 19(1): e16–e27. DOI:10.3747/co.19.871 |
| [10] | Beslic S, Zukic F, Milisic S. Percutaneous transthoracic CT guided biopsies of lung lesions; fine needle aspiration biopsy versus core biopsy[J]. Radiol Oncol, 2012, 46(1): 19–22. DOI:10.2478/v10019-012-0004-4 |
| [11] | Baselga J. Why the epidermal growth factor receptor? The rationale for cancer therapy[J]. Oncologist, 2002, 7(Suppl 4): S2–8. DOI:10.1634/theoncologist.7-suppl-4-2 |
| [12] |
高淑艳, 叶斌, 蒲高波.
CT引导下经皮肺穿刺活检并发症的相关因素研究[J]. 临床肺科杂志, 2013, 18(12): 2258–2259.
DOI:10.3969/J.issn.1009-6636.2013.12.061 Gao SY, Ye B, Pu GB. Research of related factors of CT-guided percutaneous lung biopsy complications[J]. J Clin Pulm Med, 2013, 18(12): 2258–2259. DOI:10.3969/J.issn.1009-6636.2013.12.061 |
| [13] | Collins LG, Haines C, Perkel R, et al. Lung cancer:diagnosis and management[J]. Am Fam Physician, 2007, 75(1): 56–63. |
| [14] |
潘清, 陈卉, 马宇晶, 等.
影像学诊断评价中的参数法ROC曲线分析[J]. 中国医学影像技术, 2011, 27(8): 1694–1697.
Pan Q, Chen H, Ma YJ, et al. Parametric ROC curve analysis for the performance evaluation of radiological diagnosis[J]. Chin J Med Imaging Technol, 2011, 27(8): 1694–1697. |
 2018, Vol. 42
2018, Vol. 42


