2. 300072 天津, 天津大学生命科学学院
2. School of Life Sciences, Tianjin University, Tianjin 300072, China
甲状腺未分化癌(anaplastic thyroid cancer,ATC)是目前人类致死性最高的实体恶性肿瘤之一,虽然它的发病率低,但恶性度高,且目前尚无有效治疗手段[1]。131I核素治疗是经典的治疗分化型甲状腺癌的有效方法之一,但在非摄碘性肿瘤中的应用明显受限[2]。既往研究结果证实,热休克蛋白90抑制剂17-丙烯胺基-17-去甲氧基格尔德霉素(17-allylamino-17-demethoxygeldanamycin,17-AAG)和哺乳动物雷帕霉素靶蛋白(mammalian rapamycin target protein,mTOR)抑制剂Torin2均可明显抑制ATC增殖并诱导其凋亡[3-4]。但将多种水溶性差的靶向药物溶解并最大限度地降低正常组织毒性仍为亟待解决的问题。通过纳米载体将多种靶向治疗药物及核素共载,可有望解决上述难题并实现同时作用于多分子靶点的目的,增强其抗肿瘤活性。本研究拟构建一种新型的表面修饰胎牛血清白蛋白(bovine serum albumin,BSA)、标记131I、共载17-AAG与Torin2的多功能介孔二氧化硅(mesoporous silica,mSiO2)纳米载体,并对其表征、释药动力学及胞内核素摄取定量等方面进行相关研究。
1 材料与方法 1.1 主要材料RPMI 1640培养基购自美国Corning公司,胎牛血清、Torin2购自美国Sigma公司,17-AAG购自美国Selleck公司。131I由北京原子高科股份有限公司提供。ATC细胞系FRO为日本长崎大学山下俊一教授惠赠。JEOL-100CXⅡ型透射电子显微镜产自日本电子光学公司,已经过计量质控的1261型γ计数仪产自澳大利亚LKB公司,1260 Infinity型高效液相色谱仪产自美国安捷伦公司。
1.2 (17-AAG+Torin2)@mSiO2-BSA的构建及表征 1.2.1 (17-AAG+Torin2)@mSiO2-BSA的构建采用传统的模板法制作mSiO2纳米载体[5]。按照浓度比为1:1对17-AAG与Torin2两种药物进行装载,将硅球进行氨基化修饰后连接BSA。制备好的纳米载体置于-20℃保存备用。
1.2.2 (17-AAG+Torin2)@mSiO2-BSA的基本表征通过透射电镜和动态光散射对纳米载体的形貌、粒径和粒径分布进行表征分析。
1.2.3 (17-AAG+Torin2)@mSiO2-BSA的载药量及包封率将浓度为0.03125、0.06250、0.12500、0.25000、0.50000 mg/mL的17-AAG溶液及浓度为0.03125、0.06250、0.25000、0.50000、1.00000 mg/mL的Torin2溶液分别在335 nm及317 nm处测定特征紫外吸光度值,建立两种药物的标准曲线并通过拟合方程计算得出纳米载体的载药量及包封率,计算方法如下。
| $ 载药量(\% ) = (投药量-上清液药量 )/纳米载体的质量\times 100\% $ | (1) |
| $ 包封率 (\% ) = ( 投药量-上清液药量 )/ 投药量 \times 100\% $ | (2) |
将包载17-AAG和Torin2的纳米载体置于释放介质(pH7.4的PBS缓冲液)中,间隔特定时间后每次取样1 mL,用高效液相色谱法分析并计算17-AAG和Torin2的浓度,以纯药的释放度作对照。每组平行3个样本,取平均值。
1.4 131I标记(17-AAG+Torin2)@mSiO2-BSA采用氯胺T法进行131I标记[6]。取适量10 mg/mL载药纳米载体加入50 μL(5 mg/mL)的氯胺T及37 MBq Na131I溶液,反应60 s,加入50 μL(5 mg/mL)偏重亚硫酸钠终止反应。测定混合物的放射性活度后,以5000 r/min离心8 min,离心半径5 cm,重复3次以提纯标记物。测定产物的标记率及放化纯度。
1.5 (17-AAG+Torin2)@mSiO2-BSA-131I的ATC胞内摄取定量实验将FRO细胞以2.5×105个/孔接种于24孔板,每孔分别加入1.11 MBq的131I-NaI、(17-AAG+Torin2)@mSiO2-BSA-131I,分别培养0.5、1、3、5、7、9、11 h后冲洗并裂解细胞,用γ计数仪测量放射性计数。
1.6 统计学方法采用SPSS19.0统计学软件进行分析,对符合正态性分布的实验数据采用x±s表示,核素胞内摄取定量实验所得数据经检测为方差不齐,组间均数比较采用独立样本t′检验。P<0.05为差异有统计学意义。
2 结果 2.1 (17-AAG+Torin2)@mSiO2-BSA的构建及基本表征本研究成功构建了多功能纳米载体(17-AAG+Torin2)@mSiO2-BSA,并经动态光散射分析显示,mSiO2和(17-AAG+Torin2)@mSiO2-BSA的有效直径约为170~250 nm和200~300 nm;透射电镜结果显示纳米载体的分散性好,具有理想的球形形态(图 1)。

|
图 1 纳米载体的透射电镜图 Figure 1 Transmission electron microscopy images of the nanoparticles 图中,A:mSiO2;B:(17-AAG+Torin2)@mSiO2-BSA;mSiO2:介孔二氧化硅;17-AAG:17-丙烯胺基-17-去甲氧基格尔德霉素;BSA:胎牛血清白蛋白。 |
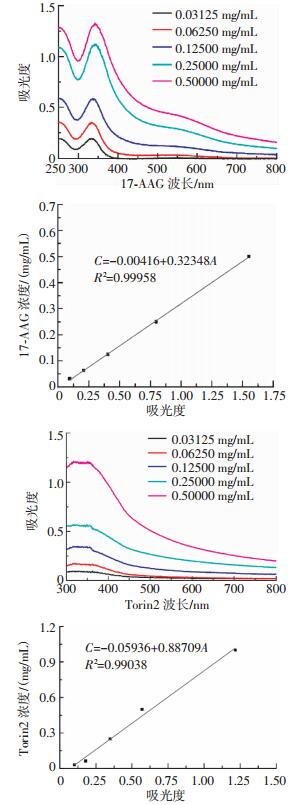
将所测不同浓度17-AAG及Torin2的紫外吸光度值(A)与浓度(C)建立药物的标准曲线,通过线性拟合所得17-AAG及Torin2的标准曲线拟合方程分别为C=-0.00416+0.32348A、R2=0.99958及C=-0.05936+0.88709A、R2=0.99038,证明两种药物的标准曲线有较高的线性相关程度(图 2),代入公式(1)、(2)得到mSiO2仅装载单药时分别对17-AAG及Torin2的载药量及包封率,并通过计算间接得到(17-AAG+Torin2)@mSiO2-BSA对17-AAG及Torin2的载药量分别为(7.31±0.22)%和(6.04±0.79)%,包封率分别为(86.21±1.32)%和(85.17±2.05)%。
|
图 2 17-AAG及Torin2的紫外吸收波长与标准曲线 Figure 2 UV absorbance and standard curves of 17-AAG and Torin2 图中,17-AAG:17-丙烯胺基-17-去甲氧基格尔德霉素。 |
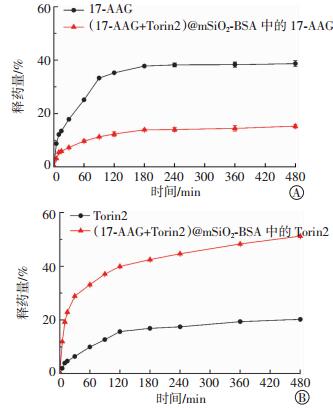
体外药物释放曲线(图 3)显示,17-AAG和Torin2、纳米载体包裹的17-AAG和Torin2在480 min时的累积释放量分别为(38.69±0.15)%、(20.20±0.13)%、(15.26±0.28)%和(51.20±0.09)%,且基本均在180 min后保持缓慢平稳释放。
|
图 3 载药纳米载体(17-AAG+Torin2)@mSiO2-BSA的体外药物释放曲线 Figure 3 In vitro drug release behavior of the nanoparticles 图中,17-AAG:17-丙烯胺基-17-去甲氧基格尔德霉素;mSiO2:介孔二氧化硅;BSA:胎牛血清白蛋白。 |
经薄层层析法测定证实131I已成功标记到(17-AAG+Torin2)@mSiO2-BSA上,且所得产物的标记率为66.31%~78.25%,放化纯度高达98.80%~99.42%。
2.4 (17-AAG+Torin2)@mSiO2-BSA-131I的ATC胞内摄取定量实验(17-AAG+Torin2)@mSiO2-BSA-131I可被ATC细胞快速摄取,且于3 h时达摄取高峰,5 h后基本保持动态平衡,FRO细胞对纳米载体携带的131I摄取量明显高于Na131I溶液(t=32.63~109.31,均P < 0.01)(表 1)。
| 表1 ATC细胞系FRO在不同时间点的胞内放射性计数(x±s)(×102 CPM) Table 1 Counts per minute of 131I in the FRO cells at different times(x±s)(×102 CPM) |
ATC患者肿瘤细胞无法主动摄碘而不能按传统的方法进行131I治疗,而分子靶向治疗又存在不良反应大及肿瘤耐药等问题[7]。纳米载体可通过肿瘤部位的增强渗透与滞留效应实现被动靶向,聚集在肿瘤周围,增加局部药物浓度或放射性活度,以实现对肿瘤的治疗作用[8]。在甲状腺癌的治疗中,将多种靶向治疗药物及核素通过纳米载体共载,一方面可实现同时作用于多分子靶点的目的,另一方面可利用纳米载体的靶向性及缓释性,增强其抗肿瘤活性,有效逆转肿瘤耐药的发生[9]。但目前为止,纳米载体共载131I并联合装载多种靶向药物的相关研究甚少。有学者制备了一种新型具有酸敏感性能的阿霉素前药纳米粒,并经体外研究发现其具有良好的抗脑胶质瘤作用[10]。闫岩等[11]制备得到包载17-AAG的聚氰基丙烯酸正丁酯纳米粒,并证实其可对肝癌、黑色素瘤、宫颈癌、乳腺癌等多种肿瘤细胞产生较好的抗肿瘤活性。此外,还有相关研究显示,同时包载紫杉醇及阿霉素的重组高密度脂蛋白纳米载体对肝癌的治疗具有明显优势[8]。Li等[12]通过131I-EGFR-BSA-PCL(其中,EGFR:表皮生长因子受体;PCL:聚乙内酯)纳米脂质体对多种肿瘤细胞如肺癌、乳腺癌、结肠癌、鳞状细胞癌的体内外研究发现,其在肿瘤的治疗及显像上具有独特优势。
热休克蛋白90抑制剂17-AAG可明显抑制ATC细胞增殖、诱导细胞凋亡[3]。研究发现,经一定浓度的17-AAG作用后,还可进一步提高转染钠/碘转运体基因的ATC细胞的摄碘率,且明显延迟碘的外流,提高细胞内碘的滞留率[13]。mTOR抑制剂Torin2可通过使mTOR表达的基因沉默而阻断mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)的活性,进一步导致Akt、4E-BP1和Bad等的失活,以及cyclinD1的下调,诱导ATC等肿瘤细胞凋亡[4]。鉴于此两种药物的不同抗肿瘤机制,将其联合应用可有望从多通路发挥协同抗肿瘤作用。mSiO2是一种具有超高比表面积、较大孔容量、形貌和尺寸可控等特点的新型的无机生物材料,硅酸盐和硅铝酸盐是构成硅基介孔材料的骨架。mSiO2纳米材料具有较高的化学稳定性、良好的生物相容性,且合成简易、价格低廉,因而在生物医药领域被广泛关注和应用[5]。
本研究制备了一种新型的共载131I及17-AAG、Torin2的mSiO2多功能纳米载体,为了提供碘标记位点且同时又能够增加纳米载体的生物相容性和体内药学性能,将BSA修饰于其表面,并经测定结果证实该纳米载体具有较好的粒径分布、球形结构及较高的标记率、放化纯度。本研究采用经典的氯胺T标记核素方法[6],该种标记方法具有标记率高、标记方法简单易行、重复性好、试剂价格低廉且易获取等优点。其原理为氧化剂氯胺T可在水溶液中产生次氯酸,使阴离子131I、125I等在碘化反应中产生一种具有强氧化性的带正电荷的碘原子,并可取代酪氨酸酚环上羟基位的氢,从而通过取代反应生成碘化后的标记产物。本研究所得标记产物的标记率及放化纯度与其他研究相比,已处于较高水平[14]。
体外药物释放实验结果显示,该纳米载体对17-AAG、Torin2均具有理想的缓释功能,均可在约3 h内快速达到最高的释放率水平,继而保持缓慢平稳释放。17-AAG较纳米载体包裹后的17-AAG具有更大的释药量,可能与载体内部装载的药物需额外从其内部扩散到外水相相关,但也提示纳米载体内部仍有部分药物尚未释放出来,提示其有明显的缓释能力,可减少用药次数并降低因多次用药所致的药物不良反应等[11]。Torin2的释放较纳米载体包裹后的Torin2药物释放缓慢,释药量少,可能为Torin2在mSiO2纳米载体中有较高的溶解度所致。原来以结晶状态存在的药物分子由于纳米材料的空间限制,转变为以非晶体或无定形的形式存在,导致药物溶解度提高,达到有效作用浓度的时间缩短,从而能更有效地发挥抗肿瘤作用[15]。
核素胞内摄取定量实验结果显示,FRO细胞可明显快速地摄取(17-AAG+Torin2)@mSiO2-BSA-131I,细胞对其携带的131I摄取量明显高于Na131I溶液中的131I,其原因可能为FRO细胞本身无摄131I的能力,标记于纳米载体上的131I可通过纳米载体的靶向作用而随其同时被细胞更多地摄取[12]。
综上所述,利用纳米载体的诸多特性,将多种分子靶向药物联合应用与核素治疗相结合的(17-AAG+Torin2)@mSiO2-BSA-131I具有良好的载体表征参数及缓释药物能力,并可快速而明显地被ATC细胞摄取并滞留其内部,从而有望发挥明显的杀伤肿瘤细胞功效,成为治疗ATC的新方法。进一步的研究应证实此两种药物联合应用后的协同作用及(17-AAG+Torin2)@mSiO2-BSA-131I对肿瘤细胞具有更为明显的杀伤能力。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 张月倩负责研究方案的提出、数据的收集与统计、实验的实施、论文的撰写;王任飞、王汉杰负责研究方案的提出、数据的收集与统计、论文的撰写;贾强负责实验的指导;张瑞国负责实验的实施;谭建、常津负责实验的指导、论文的修订。
| [1] | Akaishi J, Sugino K, Kitagawa W, et al. Prognostic factors and treatment outcomes of 100 cases of anaplastic thyroid carcinoma[J]. Thyroid, 2011, 21(11): 1183–1189. DOI:10.1089/thy.2010.0332 |
| [2] | Haugen BR, Alexander EK, Bible KC, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1–133. DOI:10.1089/thy.2015.0020 |
| [3] | Kim SH, Kang JG, Kim CS, et al. 17-Allylamino-17-demethoxygeldanamycin and herbimycin a induce cell death by modulating β-catenin and PI3K/AKT signaling in FRO anaplastic thyroid carcinoma cells[J]. Anticancer Res, 2015, 35(10): 5453–5460. |
| [4] | Sadowski SM, Boufraqech M, Zhang L, et al. Torin2 targets dysregulated pathways in anaplastic thyroid cancer and inhibits tumor growth and metastasis[J]. Oncotarget, 2015, 6(20): 18038–18049. DOI:10.18632/oncotarget.3833 |
| [5] | He Q, Ma M, Wei C, et al. Mesoporous carbon@silicon-silica nanotheranostics for synchronous delivery of insoluble drugs and luminescence imaging[J]. Biomaterials, 2012, 33(17): 4392–4402. DOI:10.1016/j.biomaterials.2012.02.056 |
| [6] | Ickenstein LM, Edwards K, Sjöberg S, et al. A novel 125I-labeled daunorubicin derivative for radionuclide-based cancer therapy[J]. Nucl Med Biol, 2006, 33(6): 773–783. DOI:10.1016/j.nucmedbio.2006.06.002 |
| [7] | Smith N, Nucera C. Personalized therapy in patients with anaplastic thyroid cancer:targeting genetic and epigenetic alterations[J]. J Clin Endocrinol Metab, 2015, 100(1): 35–42. DOI:10.1210/jc.2014-2803 |
| [8] | Rui M, Xin Y, Li R, et al. Targeted biomimetic nanoparticles for synergistic combination chemotherapy of paclitaxel and doxorubicin[J]. Mol Pharm, 2017, 14(1): 107–123. DOI:10.1021/acs.molpharmaceut.6b00732 |
| [9] | Zolata H, Afarideh H, Davani FA. Triple therapy of HER2+ cancer using radiolabeled multifunctional iron oxide nanoparticles and alternating magnetic field[J]. Cancer Biother Radiopharm, 2016, 31(9): 324–329. DOI:10.1089/cbr.2016.2068 |
| [10] |
刘金剑, 张玉民, 杨翠红, 等.
酸敏感阿霉素前药纳米粒的合成及其在治疗脑胶质瘤中的作用[J]. 天津医药, 2016, 44(1): 33–37.
Liu JJ, Zhang YM, Yang CH, et al. Synthesis of acid-sensitive doxorubicin prodrug nanoparticle and its application in brain glioma treatment[J]. Tianjin Med J, 2016, 44(1): 33–37. DOI:10.11958/20150109 |
| [11] |
闫岩, 王玉记, 吴建辉, 等.
17-AAG聚氰基丙烯酸正丁酯纳米粒的制备及抗肿瘤活性研究[J]. 首都医科大学学报, 2015, 36(2): 178–184.
Yan Y, Wang YJ, Wu JH, et al. Construction and studies on anticancer activity of 17-AAG poly-butylcyanoacrylate nanoparticles[J]. J Capit Univ Med Sci, 2015, 36(2): 178–184. DOI:10.3969/j.issn.1006-7795.2015.02.005 |
| [12] | Li W, Liu Z, Li C, et al. Radionuclide therapy using 131I-labeled anti-epidermal growth factor receptor-targeted nanoparticles suppresses cancer cell growth caused by EGFR overexpression[J]. J Cancer Res Clin Oncol, 2016, 142(3): 619–632. DOI:10.1007/s00432-015-2067-2 |
| [13] |
王任飞, 谭建, 李玮, 等.
17-AAG对转染NIS基因的未分化甲状腺癌摄碘动力学的影响[J]. 中华核医学与分子影像杂志, 2012, 32(4): 281–285.
Wang RF, Tan J, Li W, et al. The effect of 17-AAG on iodine uptake kinetics of NIS-transfected anaplastic thyroid cancer cells[J]. Chin J Nucl Med Mol Imaging, 2012, 32(4): 281–285. DOI:10.3760/cma.j.issn.2095-2848.2012.04.010 |
| [14] | Ren F, Chen R, Wang Y, et al. Paclitaxel-loaded poly(n-butylcyanoacrylate) nanoparticle delivery system to overcome multidrug resistance in ovarian cancer[J]. Pharm Res, 2011, 28(4): 897–906. DOI:10.1007/s11095-010-0346-9 |
| [15] | Jia L, Shen J, Li Z, et al. Successfully tailoring the pore size of mesoporous silica nanoparticles:exploitation of delivery systems for poorly water-soluble drugs[J]. Int J Pharm, 2012, 439(1/2): 81–91. DOI:10.1016/j.ijpharm.2012.10.011 |
 2017, Vol. 41
2017, Vol. 41


