2. 361003,厦门大学附属第一医院乳腺外科;
3. 361003,厦门大学附属第一医院放射科;
4. 100191,北京大学医学同位素研究中心
2. Department of Breast Surgery,the First Affiliated Hospital of Xiamen University,Xiamen 361003,China;
3. Department of Radiology,the First Affiliated Hospital of Xiamen University,Xiamen 361003,China;
4. Medical Isotopes Research Center,Peking University,Beijing 100191,China
乳腺癌作为临床常见恶性肿瘤,严重威胁全球女性健康,目前已是20~59岁女性患者死亡的首位原因[1]。美国癌症协会2015年报告显示,在所有女性肿瘤中,乳腺癌发病率位居首位(29%),病死率居第二位(15%)[2]。国内乳腺癌发病率也是逐年增高,目前手术仍是治疗乳腺癌最有效的方法,而尽早诊断乳腺癌可以明显降低病死率[3-5]。
目前钼靶检查仍是检测乳腺癌的首选方法,然而其具有局限性,有文献报道其假阴性率高达34%,这将会延误治疗和带给患者虚假的安全感[6]。针对这个现状,研究者多年来利用各种放射性药物标记的核素显像对乳腺癌的诊断进行了诸多探索[7-11]。
众所周知,肿瘤的生长和转移都依赖于肿瘤新生血管,大量研究也证实肿瘤血管形成与肿瘤转移及患者预后密切相关,其中整合素αvβ3在肿瘤新生血管生成及转移中发挥了重要作用[12-14]。多种恶性肿瘤细胞表面高度表达整合素,其中也包括乳腺癌[15-16]。含有精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid,RGD)的小分子多肽能够与αvβ3受体特异性结合,对其具有高度的选择性与较强的亲和力,从而能够通过特异性地显示肿瘤及其新生血管而达到检测肿瘤的目的。北京大学医学同位素研究中心研制的99Tcm-联肼尼克酰胺-3聚乙二醇-精氨酸-甘氨酸-天冬氨酸环肽二聚体(99Tcm-HYNIC-3PEG4-E[c(RGDf K)2])(简称99Tcm-3PRGD2)是一种新型RGD二聚体,相对那些单环RGD,其对整合素αvβ3受体的结合能力明显提高,体内的药代动力学性能也得到改善,这对提高诊断的灵敏度和特异度具有重要意义[17-21]。目前已证实99Tcm-3PRGD2对肺癌及乳腺癌诊断显示出很好的灵敏度[22-25]。在已有的动物实验及临床研究中均未见严重的不良反应[26-27]。
但对比99Tcm-3PRGD2整合素受体显像与钼靶定性诊断乳腺癌价值的研究报道尚不多,而且对99Tcm-3PRGD2 整合素受体显像尚缺乏细化研究。本研究着眼于此,对比了不同99Tcm-3PRGD2 整合素受体显像方法对诊断效能的影响,同时也比较了99Tcm-3PRGD2 SPECT/CT显像与钼靶检查在定性诊断乳腺(尤其是致密型乳腺)癌中的价值差异。
1 资料与方法 1.1 一般资料选取2014年8月至2015年12月厦门大学附属第一医院乳腺外科入院患者84例,均为女性,年龄30~72岁,平均年龄(48.3±10.1)岁。全部患者均接受了乳腺包块切除术或进行了细针穿刺细胞学检查,以术后或细针穿刺获得的病理组织学结果作为诊断“金标准”。术前2周内每一例患者都进行了99Tcm-3PRGD2 整合素受体显像和钼靶检查。具体入组标准及排除标准见表 1。本研究获得了厦门大学附属第一医院伦理委员会批准,入选患者均签署了知情同意书。
| 表1 本研究患者入组标准及排除标准 Table 1 Inclusion and exclusion criteria of study |
每例患者常规采用上下位(CC位)和内外斜位(MLO位)进行摄影,必要时加拍病灶局部加压放大和(或)切线位摄片,检查设备是美国Hologic公司MDNG-2121数字平板乳腺机。所获影像由3名专职放射科医师依据美国放射学会乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)分级诊断标准[28]进行评分,最终评分取三者平均值,阅片时不参考其他检查结果。具体评分标准如下,0分:钼靶单一检查无法全面评价病变,需要进一步检查;1分:钼靶检查结果阴性,未见异常;2分:良性征象;3分:倾向于良性病变,需短期内随访;4分:恶性可疑,建议活检;5分:高度恶性病变可能;6分:已经病理证实为恶性。BI-RADS评分≥4分被认定为阳性结果。另外依据乳腺密度将检查对象分为“脂肪型”、“混杂型”和“致密型”3种类型,以便作进一步细致分析。
1.3 99Tcm-3PRGD2 整合素受体显像RGD试剂盒由北京大学医学同位素研究中心提供,99Tcm标记RGD由厦门大学附属第一医院核医学科完成,具体标记方法及质量控制参考药品使用说明书及相应文献[27],放化纯度经高效液相色谱仪测定≥95%后方可使用。满足质控要求的显像剂用生理盐水稀释至370 MBq/mL(10 mCi/mL),注射放射性活度为14.8 MBq/kg(0.4 mCi/kg),注射部位取乳腺占位对侧的肘静脉。
注射显像剂后2 h、4 h分别进行显像(含全身显像及胸部SPECT/CT显像)。扫描仪为荷兰Philips公司BrightView XCT,配置低能平行孔准直器。患者取仰卧位,双手抱头,以乳腺病灶为视野中心。先采集CT扫描数据,扫描范围选择3个体位,以使CT扫描视野与SPECT扫描视野完全吻合,扫描电压120 keV,电流10 mA,层厚3 mm。随后同机进行SPECT扫描,共64帧,每帧32 s,矩阵为64×64。所有数据采集后由Philips Extended BrillianceTM Workspace(EBW-NM 2.0AB)后台自带软件进行融合及半定量分析。
1.4 图像判读图像判读由3位副高及以上职称的核医学科医师独立进行。全身显像诊断采用目测法;SPECT/CT显像诊断采用半定量分析,除了自带CT影像,未参考钼靶及其他相关检查结果。目测法以病灶摄取程度大于纵隔本底为阳性;半定量分析依据同机CT显示占位实际边缘勾画ROI,本底采用镜像方法勾画正常乳腺组织,采用机器自带软件计算病灶容积最大计数(Tmax)、病灶容积平均计数(Tmean)、本底平均计数(B),计算Tmax /B值及Tmean /B值。最后结论目测法取多数意见,半定量值取其平均值。以Tmax /B值作为99Tcm-3PRGD2 SPECT/CT显像区分乳腺良恶性占位的诊断指标,以Tmax /B值>3.0作为乳腺癌阳性诊断的阈值标准。
1.5 统计学方法采用SPSS 22.0软件进行统计学分析。组间差异所采用的统计学方法因原始数据类型不同而各异。对计量资料及半定量比值采用t检验,原始数据均服从正态分布和方差齐性,计量资料以x±s表示。其中,同一病灶2 h、4 h显像比较采用自身对照t检验,每对数据的差值服从正态分布和方差齐性;对率的比较采用卡方检验,因总样本量≥40,采用Pearson卡方检验。以P<0.05表示差异有统计学意义。
2 结果 2.1 临床资料结果84例入组病例共发现病灶88个,有4例表现为双侧乳腺占位(双侧乳腺癌2例、乳腺癌伴对侧良性结节2例),病灶最大径范围为1.0~5.3 cm,平均(2.7±1.3) cm。70例进行了乳腺肿块切除术,另14例进行了细针穿刺细胞学检查,其中,61例患者(63个病灶)被证实为乳腺癌,23例患者(25个病灶)被证实为良性疾病(表 2)。依据钼靶结果分类有60例(恶性42例、良性18例)被定义为致密型乳腺。
| 表2 88个乳腺占位病灶的病理学分型及不同显像方法的诊断结果(例) Table 2 Pathology classification on 88 breast occupying lesions and the results of different imaging method(case) |
乳腺癌99Tcm-3PRGD2摄取率(Tmax和Tmean)均明显高于良性占位(t=2.09~2.66,均P<0.05);Tmean /B 值及Tmax /B值也表现出类似结果(t=2.34~3.19,均P<0.05),且Tmax /B值的差异更为明显(t=3.19,P<0.01)。但对于同一病灶2 h、4 h显像各半定量指标比较均无统计学意义(t=0.63~1.25,均P>0.05)(表 3)。
| 表3 88个乳腺占位病灶的Tmax 和Tmean 特征 Table 3 Characteristics of Tmax and Tmean in 88 breast occupying lesions |
我们细致对比了不同显像时间、不同分析方法对诊断效能的影响,结果提示无论是全身显像还是胸部SPECT/CT显像,采用2 h或4 h显像均有相似的诊断效能(χ2=0.076~0.209,均P>0.05)。SPECT/CT显像较全身显像对乳腺癌有更好的诊断效能,差异有统计学意义(χ2=3.927,P<0.05);对胸部SPECT/CT显像而言,采用Tmax /B值>3.0阈值可以获得更佳的诊断效能,差异有统计学意义(χ2=5.136,P<0.05)(表 4)。
| 表4 不同显像条件下99Tcm-3PRGD2整合素受体显像对乳腺癌诊断效能的比较 Table 4 Compare the diagnostic efficiency under different conditions of 99Tcm-3PRGD2 integrin receptor imaging |
我们对比了两种方法对乳腺癌(特别是致密型乳腺背景下的乳腺癌)诊断效能的影响。若对全部入组病例综合比较,二者诊断效能比较无统计学意义(χ2=0.833,P>0.05);若对致密型乳腺的乳腺癌患者进行单独分析,钼靶检查有9例假阴性(图 1),而99Tcm-3PRGD2 SPECT/CT只有2例,后者的准确率高于前者,差异有统计学意义(χ2=4.341,P<0.05)(表 5)。
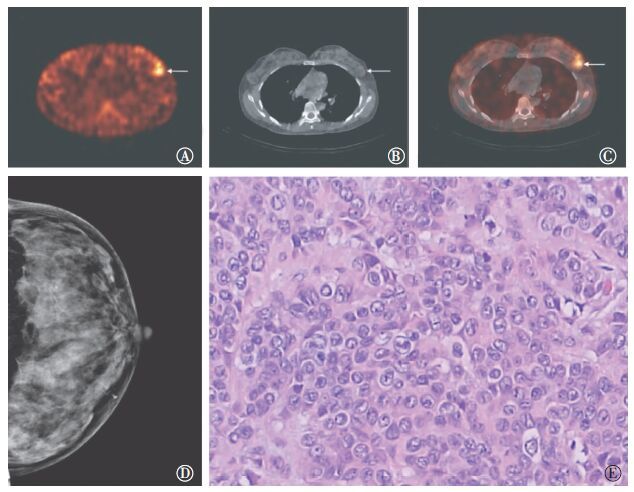
|
图 1 99Tcm-3PRGD2 SPECT/CT诊断乳腺癌真阳性病例。患者女性,44岁,确诊为“左乳腺癌”。图中,A:99Tcm-3PRGD2 SPECT断层图(4 h显像),左乳病灶如图箭头所示,Tmax/B值为7.63;B:同机CT断层图,可见左乳肿块(箭头所示),边界尚规整,最大径2.2 cm;C:SPECT/CT融合图,左乳病灶如图箭头所示;D:左乳钼靶图(CC位),左乳呈大片混杂致密腺体影,未见确切肿物影,未见明显恶性钙化及增粗血管,乳腺影像报告和数据系统(BI-RADS)分级为1级;E:病理图,诊断为“左乳浸润性导管癌”,2~3级,苏木精-伊红染色,放大倍数为20×10。 Figure 1 A representative true-positive detection of breast cancer lesion using 99Tcm-3PRGD2 SPECT/CT imaging |
| 表5 99Tcm-3PRGD2 SPECT/CT显像与钼靶检查对乳腺癌定性诊断效能的比较 Table 5 Compare the diagnostic efficiency of 99Tcm-3PRGD2 SPECT/CT imaging and mammography |
钼靶检查是目前临床进行乳腺癌筛查的首选方法,但由于是平面显像,对一些致密型乳腺患者的诊断存在局限性。99Tcm-3PRGD2是一种新型整合素受体显像剂,近年来被引入临床,其在诊断肺癌和乳腺癌的一些初步研究中显示出了良好的诊断效能[22-25, 27]。然而显像中选择不同的方法学对乳腺癌的诊断效能有无影响尚缺乏细致研究,本研究即着眼于此,对显像中采用不同方法学对乳腺癌诊断效能的影响进行了深入分析,并与钼靶检查进行了对比研究。
有证据表明对于直径<1 cm的乳腺癌,核素显像的灵敏度是很低的,来自欧洲的多中心研究发现其灵敏度仅有26%~56%[29-30]。但这种低灵敏度往往与SPECT本身有限的空间分辨率有关,并不能真实评价核素显像剂本身的优劣。鉴于以上原因,我们直接选择了病灶直径>1 cm的患者入组,以便更客观地评估99Tcm-3PRGD2整合素受体显像的效能。
由于胸部的本底非常低,99Tcm-3PRGD2整合素受体显像获得了很高的图像对比度。采用SPECT/CT显像的诊断效能明显高于全身显像,这与SPECT/CT拥有更高的空间分辨率和同机CT给予占位病灶更多的形态学证据有关(扫描仪自带平板CT虽不是诊断级CT,但在病灶定位及更准确地勾画占位边缘中均有明显优势),也与某些良性占位虽有一定程度的99Tcm-3PRGD2摄取,但通过半定量分析选择合适的阈值能有效排除这些弱阳性病例有关。因此我们建议有条件的单位应将SPECT/CT显像作为首选方法。
SPECT/CT显像中乳腺癌99Tcm-3PRGD2摄取率(Tmax、Tmean、Tmean/B值及Tmax/B值)均明显高于良性占位,且Tmax/B值的差异更为明显,这与某些病灶内有坏死或不均质组织,不易通过平均计数来评价有关。我们采用了最大容积技术获取了病灶的最大计数,是反映病灶99Tcm-3PRGD2摄取程度最客观的数据,所以选择了Tmax/B值作为诊断乳腺癌最终的半定量分析指标,保证了诊断的高灵敏度。
有文献报道采用T/B值>1.5作为阈值时,99Tcm-3PRGD2 SPECT显像对肺癌的诊断即可有很好的诊断效能[19]。我们对比了Tmax/B值>3.0及Tmax/B值>1.5两种阈值所对应的诊断效能,发现无论是2 h或4 h显像,以Tmax /B值>1.5为阈值时的特异度非常低,无法满足诊断要求,而以Tmax /B值>3.0为阈值时则可以很好地解决这个问题。究其原因,可能是我们为了能更客观准确地反映占位的最大放射性浓聚程度,Tmax计算是采用最大容积计数,而非某一层面的最大放射性计数;另一原因也可能与不同类型肿瘤摄取程度的差异有关。至于显像时间的选择,无论2 h还是4 h显像,通过数据分析,对乳腺癌诊断效能的差异没有统计学意义,这点对临床工作选择合适的显像时间提供了依据,可以使患者更舒适地接受检查。
我们将99Tcm-3PRGD2 SPECT/CT显像(4 h)与钼靶检查对全部入组病例进行诊断效能的综合比较,结果发现二者之间的差异没有统计学意义。若将二者联合使用,则诊断灵敏度、特异度及准确率可以提升至98.4%、92.0%及96.6%。相较于灵敏度,本研究的特异度较低,分析原因可能是αvβ3受体高表达不仅见于各型恶性肿瘤和肿瘤新生血管,在炎症性血管增生及相关过程中也有高表达[31-32],也有研究证实中性粒细胞、单核细胞及血管平滑肌细胞上均有αvβ3受体表达[33]。本研究结果中出现的4例假阳性(纤维腺瘤、纤维囊性病、肉芽肿性小叶型乳腺炎及浆细胞乳腺炎各1例)也证实了上述观点。
若对致密型乳腺的乳腺癌患者进行单独分析,钼靶检查有9例假阴性,而99Tcm-3PRGD2 SPECT/CT只有2例,二者之间的诊断效能差异有统计学意义(χ2=4.341,P<0.05)。通过对二者各自特点分析可以解释以上结果。钼靶虽是临床一线检查,其仍有以下不足:①对于致密型乳腺尤其是位于乳腺深部的病灶容易漏诊;②在严重乳腺增生背景下会削弱其诊断效能。而99Tcm-3PRGD2 SPECT/CT显像具备以下优势:①由于99Tcm-3PRGD2对恶性占位的高度选择性,早期诊断乳腺癌包括多中心及不均质在内的病灶有很高的灵敏度;②在同机CT提供的准确定位信息下,对致密型乳腺及深部病灶有很好的诊断效能;③两侧乳腺可以同时显像。
本研究的局限性包括两个方面,一是病灶99Tcm-3PRGD2摄取率与组织学αvβ3受体表达程度相关性有待验证;二是病灶99Tcm-3PRGD2摄取率与患者术后是否可以进行抗血管新生分子靶向治疗的相关性仍需进一步研究。
综上,99Tcm-3PRGD2整合素受体显像尤其是SPECT/CT显像是定性诊断乳腺癌的灵敏方法,联用钼靶能进一步提高对乳腺癌诊断的准确率。Tmax/B值是半定量分析的优先指标。2 h或4 h显像均可达到满意的诊断效能。99Tcm-3PRGD2 SPECT/CT显像对致密型乳腺占位的定性诊断具有独到优势,建议考虑优先选用。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 陈贵兵负责研究命题的设计、研究过程的实施、数据的获取分析、论文的起草撰写等;欧阳忠负责临床病例的提供、术后病理结果获取及病例随访;韩成坤负责入组病例的钼靶资料收集分析;黄劲雄和何小江负责入组病例核医学显像及图像判读;王凡负责研究药物的提供及方法学指导;贾兵负责放射性药物标记指导;吴华负责研究命题的提出、论文的最终审阅。
| [1] | Desantis C, Ma JM, Bryan L, et al. Breast cancer statistics, 2013[J]. CA Cancer J Clin, 2014, 64(1): 52–62. DOI:10.3322/caac.21203 |
| [2] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. DOI:10.3322/caac.21254 |
| [3] | Sun Q. Multidisciplinary comprehensive therapy of breast cancer surgical treatment of the core role model[J]. Chin J Breast Dis (Electronic Version), 2012, 6(1): 9–15. |
| [4] | Eifel P, Axelson JA, Costa J, et al. National institutes of health consensus development conference statement:adjuvant therapy for breast cancer, November 1-3, 2000[J]. J Natl Cancer Inst, 2001, 93(13): 979–989. DOI:10.1093/jnci/93.13.979 |
| [5] | Buscombe JR, Cwikla JB, Holloway B, et al. Prediction of the usefulness of combined mammography and scintimammography in suspected primary breast cancer using ROC curves[J]. J Nucl Med, 2001, 42(1): 3–8. |
| [6] | Murphy IG, Dillon MF, Doherty AO, et al. Analysis of patients with false negative mammography and symptomatic breast carcinoma[J]. J Surg Oncol, 2007, 96(6): 457–463. DOI:10.1002/jso.20801 |
| [7] | Liberman M, Sampalis F, Mulder DS, et al. Breast cancer diagnosis by scintimammography:a meta-analysis and review of the literature[J]. Breast Cancer Res Treat, 2003, 80(1): 115–126. DOI:10.1023/A:1024417331304 |
| [8] |
王健, 宋秀宇, 徐文贵, 等.
乳腺癌放射性核素分子成像研究进展[J]. 国际医学放射学杂志, 2015, 38(4): 361–365.
Wang J, Song XY, Xu WG, et al. The research progress of radionuclide molecular imaging for breast cancer[J]. Int J Med Radiol, 2015, 38(4): 361–365. DOI:10.3874/j.issn.1674-1897.2015.04.Z0411 |
| [9] |
何小江, 黄劲雄, 陈贵兵, 等.
99mTc-奥曲肽和X线钼靶诊断乳腺癌[J]. 中国医学影像技术, 2009, 25(10): 1892–1895.
He XJ, Huang JX, Chen GB, et al. 99mTc-octreotide scintigraphy and planar X-ray mammography diagnosis of breast cancer[J]. Chin J Med Imaging Technol, 2009, 25(10): 1892–1895. DOI:10.3321/j.issn:1003-3289.2009.10.044 |
| [10] |
张金山, 邓念英, 李舜, 等.
99Tcm-octreotide显像在乳腺癌诊断中的应用[J]. 中华核医学杂志, 2004, 24(1): 24–26.
Zhang JS, Deng NY, Li S, et al. Primary application of 99Tcm-octreotide imaging in the diagnosis of breast cancer[J]. Chin J Nucl Med, 2004, 24(1): 24–26. DOI:10.3760/cma.j.issn.2095-2848.2004.01.008 |
| [11] |
黄为昆, 李国新, 齐德林.
乳腺癌及腋淋巴结转移99Tcm-tetrofosmin与99Tcm-MIBI显像的对比研究[J]. 中华核医学杂志, 2001, 21(2): 95–96.
Huang WK, Li GX, Qi DL. A clinical comparative study of 99Tcm-tetrofosmin with 99Tcm-MIBI in breast carcinoma and axillary lymph node metastases[J]. Chin J Nucl Med, 2001, 21(2): 95–96. DOI:10.3760/cma.j.issn.2095-2848.2001.02.015 |
| [12] | Haubner RH, Wester HJ, Weber WA, et al. Radiotracer-based strategies to image angiogenesis[J]. Q J Nucl Med, 2003, 47(3): 189–199. |
| [13] |
江泽飞, 邵志敏, 徐兵河.
人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识[J]. 中华肿瘤杂志, 2010, 32(2): 158–160.
Jiang ZF, Shao ZM, Xu BH. Diagnosis and treatment of HER-2-positive breast cancer:expert consensus of the chinese anti-cancer association[J]. Chin J Oncol, 2010, 32(2): 158–160. DOI:10.3760/cma.j.issn.0253-3766.2010.02.018 |
| [14] | Hood JD, Cheresh DA. Role of integrins in cell invasion and migration[J]. Nat Rev Cancer, 2002, 2(2): 91–100. DOI:10.1038/nrc727 |
| [15] | Desgrosellier JS, Cheresh DA. Integrins in cancer:biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2010, 10(1): 9–22. DOI:10.1038/nrc2748 |
| [16] | Niu G, Chen X. Why integrin as a primary target for imaging and therapy[J]. Theranostics, 2011, 1(1): 30–47. DOI:10.7150/thno/v01p0030 |
| [17] | Shi JY, Wang LJ, Kim YS, et al. 99mTcO(MAG2-3G3-dimer):a new integrin αvβ3-targeted SPECT radiotracer with high tumor uptake and favorable pharmacokinetics[J]. Eur J Nucl Med Mol Imaging, 2009, 36(11): 1874–1884. DOI:10.1007/s00259-009-1166-1 |
| [18] | Wang L, Shi J, Kim YS, et al. Improving tumor-targeting capability and pharmacokinetics of 99mTc-labeled cyclic RGD dimers with PEG4 linkers[J]. Mol Pharm, 2009, 6(1): 231–245. DOI:10.1021/mp800150r |
| [19] | Shi J, Kim YS, Chakraborty S, et al. 2-Mercaptoacetylglycylglycyl (MAG2) as a bifunctional chelator for 99mTc-labeling of cyclic RGD dimers:effect of technetium chelate on tumor uptake and pharmacokinetics[J]. Bioconjug Chem, 2009, 20(8): 1559–1568. DOI:10.1021/bc9001739 |
| [20] | Liu Z, Jia B, Shi J, et al. Tumor uptake of the RGD dimeric probe 99mTc-G3-2P4-RGD2 is correlated with integrin αvβ3 expressed on both tumor cells and neovasculature[J]. Bioconjug Chem, 2010, 21(3): 548–555. DOI:10.1021/bc900547d |
| [21] | Jia B, Liu Z, Zhu Z, et al. Blood clearance kinetics, biodistribution, and radiation dosimetry of a kit-formulated integrin αvβ3-selective radiotracer 99mTc-3PRGD2 in non-human primates[J]. Mol Imaging Biol, 2011, 13(4): 730–736. DOI:10.1007/s11307-010-0385-y |
| [22] | Zhu Z, Miao W, Li Q, et al. 99mTc-3PRGD2 for integrin receptor imaging of lung cancer:a multicenter study[J]. J Nucl Med, 2012, 53(5): 716–722. DOI:10.2967/jnumed.111.098988 |
| [23] | Liu L, Song Y, Gao S, et al.99mTc-3PRGD2 scintimammography in palpable and nonpalpable breast lesions[J/OL].Mol Imaging, 2014, 13:1-7[2016-08-03].https://www.ncbi.nlm.nih.gov/pubmed/?term=24825112.DOI:10.2310/7290.2014.00010. |
| [24] | Ma Q, Chen B, Gao S, et al.99mTc-3P4-RGD2 scintimammography in the assessment of breast lesions:comparative study with 99mTc-MIBI[J/OL].PLoS One, 2014, 9(9):e0108349[2016-08-03].http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0108349.DOI:10.1371/journal.pone.0108349. |
| [25] | Chen Q, Ma Q, Chen M, et al.An exploratory study on 99mTc-RGD-BBN peptide scintimammography in the assessment of breast malignant lesions compared to 99mTc-3P4-RGD2[J/OL].PLoS One, 2015, 10(4):e0123401[2016-08-03].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4388716.DOI:10.1371/journal.pone.0123401. |
| [26] | Zhou Y, Kim YS, Chakraborty S, et al. 99mTc-labeled cyclic RGD peptides for noninvasive monitoring of tumor integrin αVβ3 expression[J]. Mol Imaging, 2011, 10(5): 386–397. DOI:10.2310/7290.2011.00006 |
| [27] | Ma Q, Ji B, Jia B, et al. Differential diagnosis of solitary pulmonary nodules using 99mTc-3P4-RGD2 scintigraphy[J]. Eur J Nucl Med Mol Imaging, 2011, 38(12): 2145–2152. DOI:10.1007/s00259-011-1901-2 |
| [28] | Percha B, Nassif H, Lipson J, et al. Automatic classification of mammography reports by BI-RADS breast tissue composition class[J]. J Am Med Inform Assoc, 2012, 19(5): 913–916. DOI:10.1136/amiajnl-2011-000607 |
| [29] | Palmedo H, Schomburg A, Grünwald F, et al. Technetium-99m-MIBI scintimammography for suspicious breast lesions[J]. J Nucl Med, 1996, 37(4): 626–630. |
| [30] | Scopinaro F, Schillaci O, Ussof W, et al. A three center study on the diagnostic accuracy of 99mTc-MIBI scintimammography[J]. Anticancer Res, 1997, 17(3B): 1631–1634. |
| [31] | Pichler BJ, Kneilling M, Haubner R, et al. Imaging of delayed-type hypersensitivity reaction by PET and 18F-galacto-RGD[J]. J Nucl Med, 2005, 46(1): 184–189. |
| [32] | Mcdonald DM, Choyke PL. Imaging of angiogenesis:from microscope to clinic[J]. Nat Med, 2003, 9(6): 713–725. DOI:10.1038/nm0603-713 |
| [33] | Horton MA. The αvβ3 integrin "vitronectin receptor"[J]. Int J Biochem Cell Biol, 1997, 29(5): 721–725. DOI:10.1016/S1357-2725(96)00155-0 |
 2017, Vol. 41
2017, Vol. 41


