由于环境污染和大气雾霾等因素的影响,我国癌症的发病率和死亡率逐年上升,并成为危害人类生命的“第二号杀手”. 据统计,2015年我国有429.2万新发癌症病例和281.4万死亡病例[1-4]. 然而,常规化疗中的抗癌药物存在一些关键性的问题: (1) 药物在体内非特异性分布,对肿瘤细胞和正常细胞同时起毒副作用;(2) 肿瘤细胞存在耐药性;(3) 肿瘤组织部位化疗药物浓度低、疗效差[5-8]. 刺激−响应性纳米药物控释体系集传感、处理及执行功能于一体,能传感病灶信号,并做出响应,控制药物定位定时定量地释放,达到药物控制智能化的目的,从而为新型抗癌药物在不对人体产生毒副作用的情况下最大化地发挥效用提供了一个有力的契机.
在不同类型的刺激−响应性纳米药物控释体系中,pH响应聚合物纳米载药胶束体系是近年来国内外药物控释领域最热门的研究[9-10]. Lee等[11]合成了聚(L−组氨酸)−聚(乙二醇)嵌段共聚物并用于制备pH敏感性载药胶束. 由于氨基在肿瘤细胞外pH值(pH=7.2)下质子化,组氨酸重复单元中的疏水咪唑基团变为亲水性,触发了抗癌药物在肿瘤组织的释放. Ko[12]以迈克尔加成法制备了一种用于药物靶向输送的pH敏感和可生物降解的聚乙二醇−聚(β−氨基酯)共聚物,并通过溶剂蒸发法制备DOX负载胶束. 在体外药物释放试验中,DOX分子在酸性条件下迅速从pH响应性聚合胶束中释放,并定位于细胞核内. 通过评估pH响应性聚合物胶束在B16F10荷瘤小鼠体内的抗肿瘤活性发现,与游离DOX相比,携带DOX的pH响应性聚合物胶束能显著抑制肿瘤的生长并延长小鼠的存活时间. 杨友强等[13-14]以季戊四醇为起始原料,设计合成了pH响应的星型4/6臂聚合物聚己内酯−b−聚甲基丙烯酸N,N−二乙氨基乙酯−b−聚甲基丙烯酸单甲氧基聚乙二醇酯及其组装胶束用于抗癌药物的控制释放. 研究发现该星型共聚物具有低的临界胶束浓度(2.2~4.0 mg/L)和pH依赖性质. 但是,在pH为7.4时,40%的DOX从胶束释放,对正常细胞产生副作用. 金刚烷是一种高度对称的笼状烷烃,具有无毒无味、生物相容性好、稳定性高的特点,其已广泛应用于功能材料、生物医药以及纳米技术等领域[15]. 本文采用独特亲脂性和超疏水性的金刚烷替代传统的季戊四醇,合成了pH响应星状聚合物Ad-(PCL-b-PDEAEMA-b-PPEGMA)4,其自组装DOX负载胶束具有良好的稳定性,并且能够有效地控制DOX的释放.
1 实验部分 1.1 试剂与仪器ε−己内酯(ε-CL,上海麦克林生化科技有限公司,质量分数99%)用CaH2干燥48 h后,减压蒸馏收集馏分,4A分子筛干燥备用;甲基丙烯酸二乙氨基乙酯(DEAEMA,安耐吉化学试剂,质量分数99%)和甲基丙烯酸单甲氧基聚乙二醇酯(PEGMA,Mn=500,安耐吉化学试剂,质量分数99%)过碱性氧化铝柱除阻聚剂;三乙胺(TEA,阿拉丁试剂,AR)用CaH2干燥过夜后,常压蒸馏收集馏分,4A分子筛干燥备用;四氢吠喃(THF,安耐吉化学试剂,AR):加入适量的Na和二苯甲酮进行回流,等变蓝色后收集馏分,4A分子筛干燥备用;甲苯(天津市致远试剂,AR)加入4A分子筛干燥备用;阿霉素∙盐酸(DOX·HCl),2−溴异丁酰溴,辛酸亚锡(Sn(Oct)2),五甲基二亚乙基三胺(PMDETA),溴化铜(CuBr2),正己烷,芘均为分析纯.
AVANCE III 400 MHz核磁共振仪,瑞士Bruker公司;Waters 1525/2414凝胶渗透色谱仪,美国Waters公司;TalosF200S场发射透射电子显微镜,美国FEI公司;CTFD-10冷冻干燥机,青岛永合创信电子科技有限公司;FluoroMax-4荧光光谱仪,美国HORIBA Jobin Yvon公司;Zeta PALS Zeta电位及粒度分析仪,美国Brookhaven公司;UV-6000紫外-可见光谱仪,上海元析仪器有限公司;PHS-3C pH计;FA2004电子天平.
1.2 实验方法本实验以1,3,5,7−四羟基金刚烷Ad-(OH)4作为四官能团引发剂,在其三维四臂方向开展ε-CL的开环聚合反应,得到金刚烷基疏水性聚合物,随后通过2−溴异丁酰溴改性,以及DEAEMA和PEGMA的ARGET ATRP聚合技术制备pH响应星状聚合物Ad-(PCL-b-PDEAEMA-b-PPEGMA)4,具体合成步骤如图1所示.
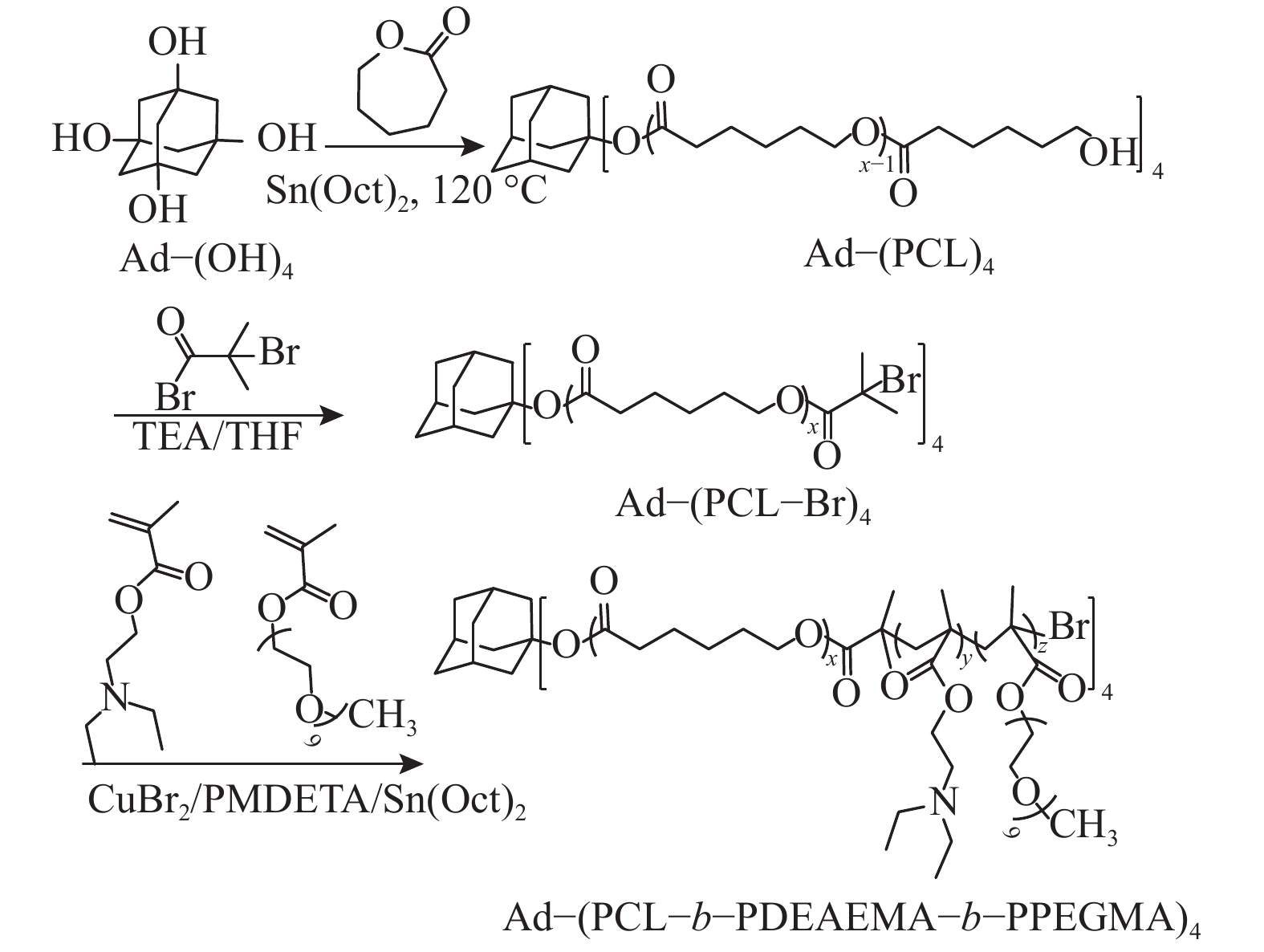
|
图 1 星状聚物Ad-(PCL-b-PDEAEMA-b-PPEGMA)4的合成路线 Figure 1 Synthetic route of star polymer Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 |
将Ad-(OH)4(0.126 g,0.63 mmol)加入到含有磁力搅拌子的100 mL反应瓶中,用氩气(Ar)吹扫3次. 在Ar保护下依次加入ε-CL (6.32 g,55.4 mmol)和Sn(Oct)2的甲苯溶液(其中Sn(Oct)2含量为0.008 g),于120 °C下反应24 h. 反应结束后,通过旋蒸除去甲苯,将粗产物溶于THF中,用10倍过量的正己烷沉淀后过滤,产物在40 °C的真空烘箱中干燥24 h.
1.2.2 Ad-(PCL-Br)4的合成取100 mL的烧瓶,将搅拌子,Ad-(PCL)4(3 g,0.256 mmol)、无水THF(20 mL)和TEA(0.71 mL,5.11 mmol)依次加入到烧瓶中. 在剧烈搅拌和冰浴条件下,将2−溴异丁酰溴(0.60 mL,5.11 mmol)逐滴加到烧瓶中. 先在冰浴下反应5 h后,室温继续反应24 h. 随后,通过中性氧化铝柱除去反应产生的季铵盐,然后旋蒸将大部分THF除去. 将所得溶液逐滴加入到冷的正己烷中,产物于40 °C下真空干燥24 h.
1.2.3 Ad-(PCL-b-PDEAEMA-b-PPEGMA)4的合成在氩气下将Ad-(PCL-Br)4(1.5 g,0.12 mmol)和催化剂CuBr2(0.027 g,0.12 mmol)加入100 mL干燥Schlenk烧瓶中. 用注射器依次将THF(18 mL),单体DEAEMA(1.6 g,8.64 mmol),配体PMDETA(0.05 mL,0.24 mmol)加入反应瓶. 充分搅拌后,将Sn(Oct)2 (0.097 g,0.24 mmol) 的THF(2 mL)溶液加入到烧瓶中,继续搅拌一段时间后于65 °C下反应. 反应进行4 h后,加入单体PEGMA(1.92 g,3.84 mmol)进行连续聚合. 反应结束后,将混合溶液冷却至室温,并用THF稀释. 通过中性氧化铝柱除去催化剂,并将溶液在旋转蒸发器上浓缩. 将所得溶液逐滴加入到正己烷中沉淀,产物在40 °C下真空干燥24 h.
1.3 载药胶束的制备DOX为模型药物,采用透析技术制备Ad-(PCL-b-PDEAEMA-b-PPEGMA)4自组装胶束. 具体步骤如下:称取DOX·HCl (20 mg)溶于20 mL DMSO,加入2倍摩尔量的TEA,搅拌过夜得到DOX. 40 mg Ad-(PCL-b-PDEAEMA-b-PPEGMA)4溶于20 mL的DMSO中,在剧烈搅拌下将DOX加入溶液中. 将混合溶液转移到透析袋(MwCO=3.5 kDa)中,首先将透析袋置于磷酸盐缓冲液(pH 7.4)中透析5 h,然后用去离子水继续透析48 h,采用0.45 μm过滤器去除溶液中的大聚集体,最后冷冻干燥. 经计算Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束的载药量为10.5%,包封率为31.6%.
1.4 表征及性能测试 1.4.1 1H NMR表征采用瑞士Bruker公司生产的AVANCE III 400 MHz超导傅里叶核磁共振波谱仪分析聚合物的化学组成及结构. 其中,氯仿(CDCl3)作为氘代试剂,四甲基硅烷(TMS)作为内标,测试温度为25 °C.
1.4.2 聚合物的GPC分析采用美国Waters公司生产的Waters 1525/2414凝胶渗透色谱仪进行聚合物的分子量(Mn)以及分布系数(PDI)分析. 其中,THF(色谱纯)作为洗脱剂(1.0 mL/min),单分散聚苯乙烯(PS)作为标样.
1.4.3 荧光光谱测定以芘作为探针,采用荧光光谱分析Ad-(PCL-b-PDEAEMA-b-PPEGMA)4在水溶液自组装胶束的形成. 在暗室下,分别取0.1 mL芘/丙酮溶液(6×10–5 mol/L)加入多个棕量瓶中,挥发掉丙酮后向棕量瓶中加入一定量的聚合物母液和去离子水配制成0.000 1~0.1 mg/mL的待测溶液,并在暗示下平衡24 h以备测试. 测试条件:荧光扫描范围为240~350 nm,发射波长为373 nm,扫描间隔为4 nm. 将I335与I333比值对聚合物浓度的对数作图,曲线突变点即Ad-(PCL-b-PDEAEMA-b-PPEGMA)4的CMC值.
1.4.4 动态光散射(DLS)将40 mg Ad-(PCL-b-PDEAEMA-b-PPEGMA)4溶解于20 mL DMSO中,随后转移到透析袋中(MwCO=3.5 kDa),用磷酸盐缓冲液(pH 7.4)透析48 h. 所得溶液通过0.45 μm过滤器过滤以除去大聚集体,使用NaOH或HCl(0.1 mol/L)调节胶束溶液的pH值,静置半天后在室温下通过DLS测试不同pH下的粒径.
1.4.5 透射电子显微镜将载药Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束分散于无水乙醇中,超声处理后将乙醇溶液滴加至300目的普通碳支持膜上,在空气中晾干后采用TalosF200S观察载药胶束的形貌.
1.4.6 药物释放研究在暗室下,称取5 mg冻干载药胶束分散在5 mL磷酸盐缓冲液(pH 7.4,6.8)或乙酸缓冲液(pH 5.0)中,将分散后的溶液转移到透析袋中(MwCO=3.5 kDa),将透析袋放入40 mL磷酸盐缓冲液或醋酸缓冲液后在37 °C和100 r/min的振荡水浴中搅拌. 在一定时间间隔内取出4 mL溶液,立即加入相同体积的新鲜缓冲液以保持溶液的总体积不变. 采用UV-9600分光光度计监测在480 nm处溶液的吸光度,按照累积释药式(1)计算DOX的累计释放量(Er). 每个实验重复3次.
| $ {E_ {\rm{r}}}= \frac{{{V_ {\rm{e}}}\sum\limits_1^{n - 1} {{C_i}} + {V_0}{C_n}}}{{{m_ {\rm{DOX}}}}} \times 100\%.$ | (1) |
式中,mDOX表示胶束中的DOX量;Ve是缓冲溶液的体积(Ve=4 mL);V0是释放介质的体积(V0=45 mL);Ci是第i次取样时样品的浓度.
2 结果与讨论 2.1 Ad-(PCL-b-PDEAEMA-b-PPEGMA)4的合成与表征Ad-(PCL-b-PDEAEMA-b-PPEGMA)4及其前驱体的凝胶渗透色谱表征结果如图2和表1所示. 由图可知,聚合物的分子量分布特点为对称的单峰分布,表明ROP和ARGET ATRP反应具有良好的可控性. 表1列出了聚合物的数均分子量Mn和分布系数PDI,可以看出聚合物的分子量分布较窄,并且随着反应的进行,分子量逐渐增大.
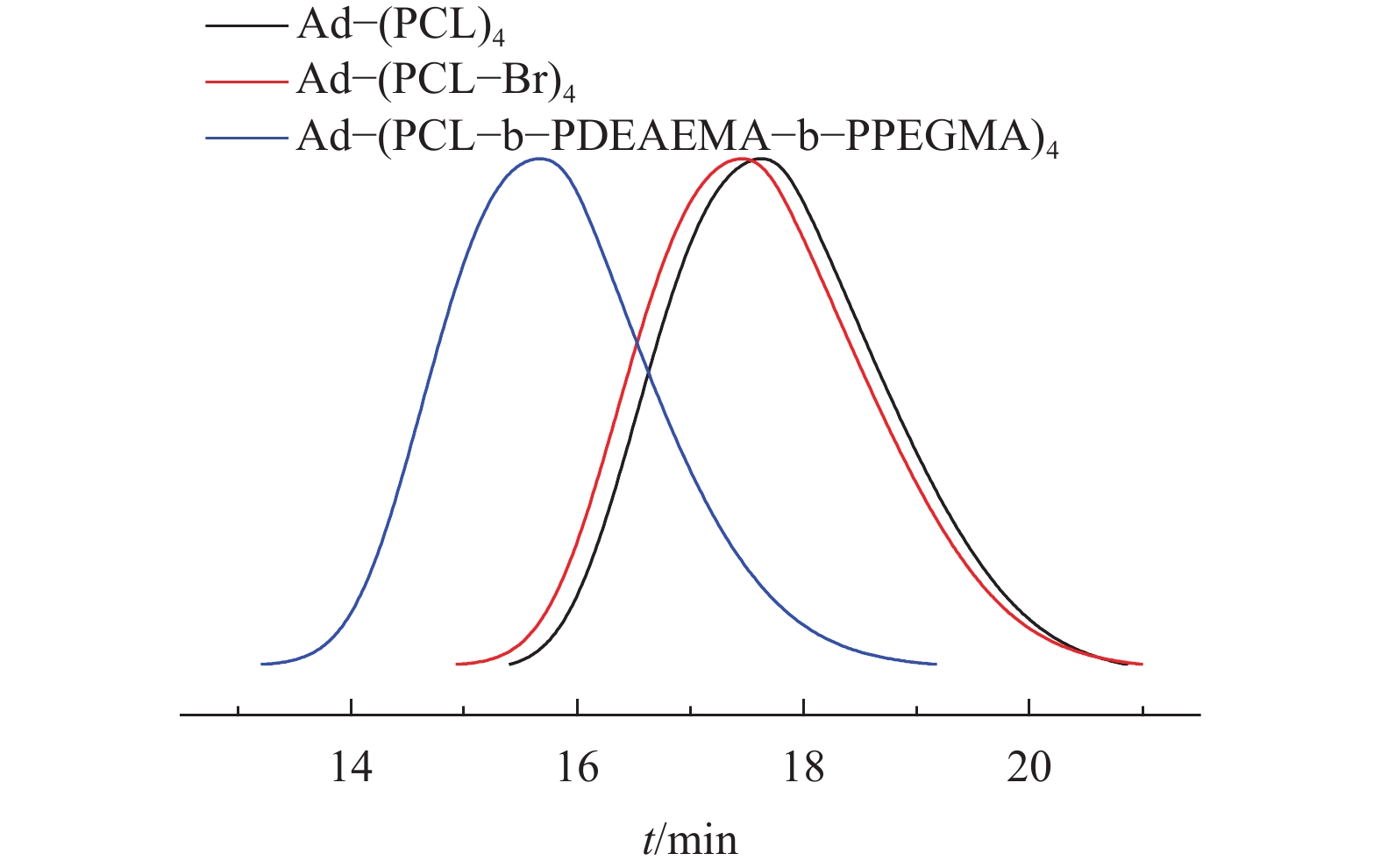
|
图 2 Ad-(PCL-b-PDEAEMA-b-PPEGMA)4及其前驱体的GPC谱图 Figure 2 GPC of Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 and its precursor |
| 表 1 Ad-(PCL-b-PDEAEMA-b-PPEGMA)4及其前驱体的合成结果 Table 1 Synthesis results of Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 and its precursor |
Ad-(PCL-b-PDEAEMA-b-PPEGMA)4及其前驱体的核磁共振氢谱图如图3所示. 由图可知,图3(a)存在4个主峰:4.06,2.31,1.65以及1.38处的特征峰分别归属于(—CH2—O—),(—CH2—CO—),(—O—CH2—CH2—CH2—CH2—CH2—CO—)和(—CH2—CH2—CH2—)质子,另外,金刚烷质子的峰与(—CH2—CH2—CH2—)质子的峰重合. Ad-(PCL-Br)4的1H-NMR光谱中,见图3(b),3.65处归属于Ad-(PCL)4末端羟基的峰完全消失,而1.93处出现归属于(—C(CH3)2—Br)质子的特征峰,这表明成功制备了Ad-(PCL-Br)4. 在图3(c)所示的Ad-(PCL-b-PDEAEMA-b-PPEGMA)4的1 H-NMR谱图中,除了来自Ad-(PCL-Br)4的峰之外,0.89和 1.81分别为甲基丙烯酸酯骨架(—CCH3)和(—CH2—)质子特征峰;在2.70和4.06处的峰归属于DEAEMA单元的(—CH2CH2—)质子;在1.04和2.58处的峰被指定为DEAEMA单元的(—CH2CH3)质子;在3.38,3.64和4.31处的峰分别是PEGMA单元的(—OCH3),(—OCH2—CH2O—)和(—COO—CH2—)质子的特征共振.
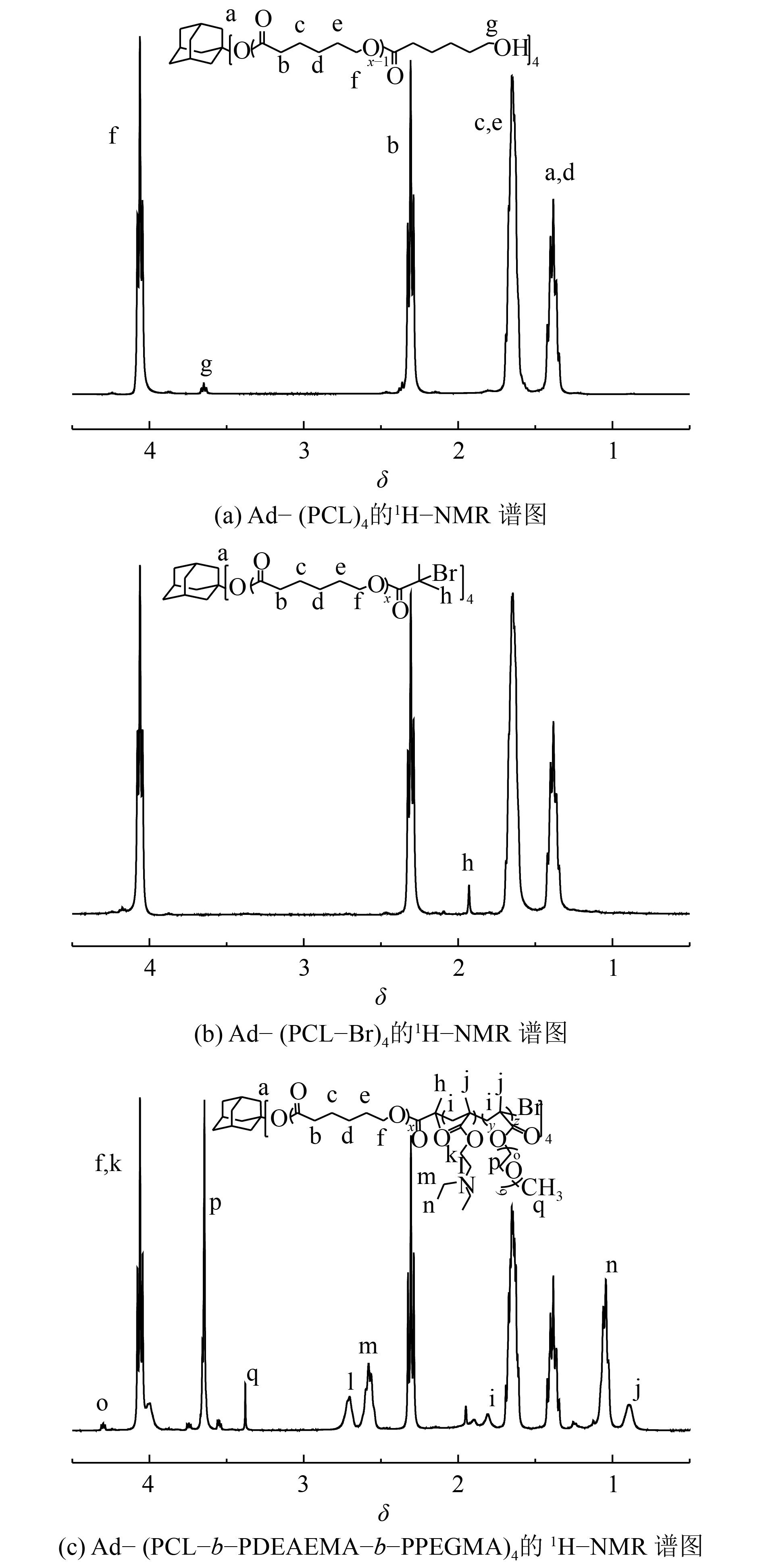
|
图 3 Ad-(PCL-b-PDEAEMA-b-PPEGMA)4及其前驱体的1H-NMR谱图 Figure 3 1H-NMR spectra of Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 and its precursor |
一般认为,低CMC值的两亲聚合物会使胶束在血液循环系统中保持稳定,并阻止化疗药物在到达癌细胞之前释放[4]. 采用芘作为荧光探针,测试其在不同浓度的聚合物溶液中的荧光光谱,从而得到聚合物的CMC值,荧光光谱分析结果如图4所示. Ad-(PCL-b-PDEAEMA-b-PPEGMA)4在水溶液中的CMC值为3.4 mg/L,表明该星状聚合物胶束在溶液中具有良好的稳定性,这有利于胶束在人体循环过程中被稀释到极低浓度时也能保持结构的完整.
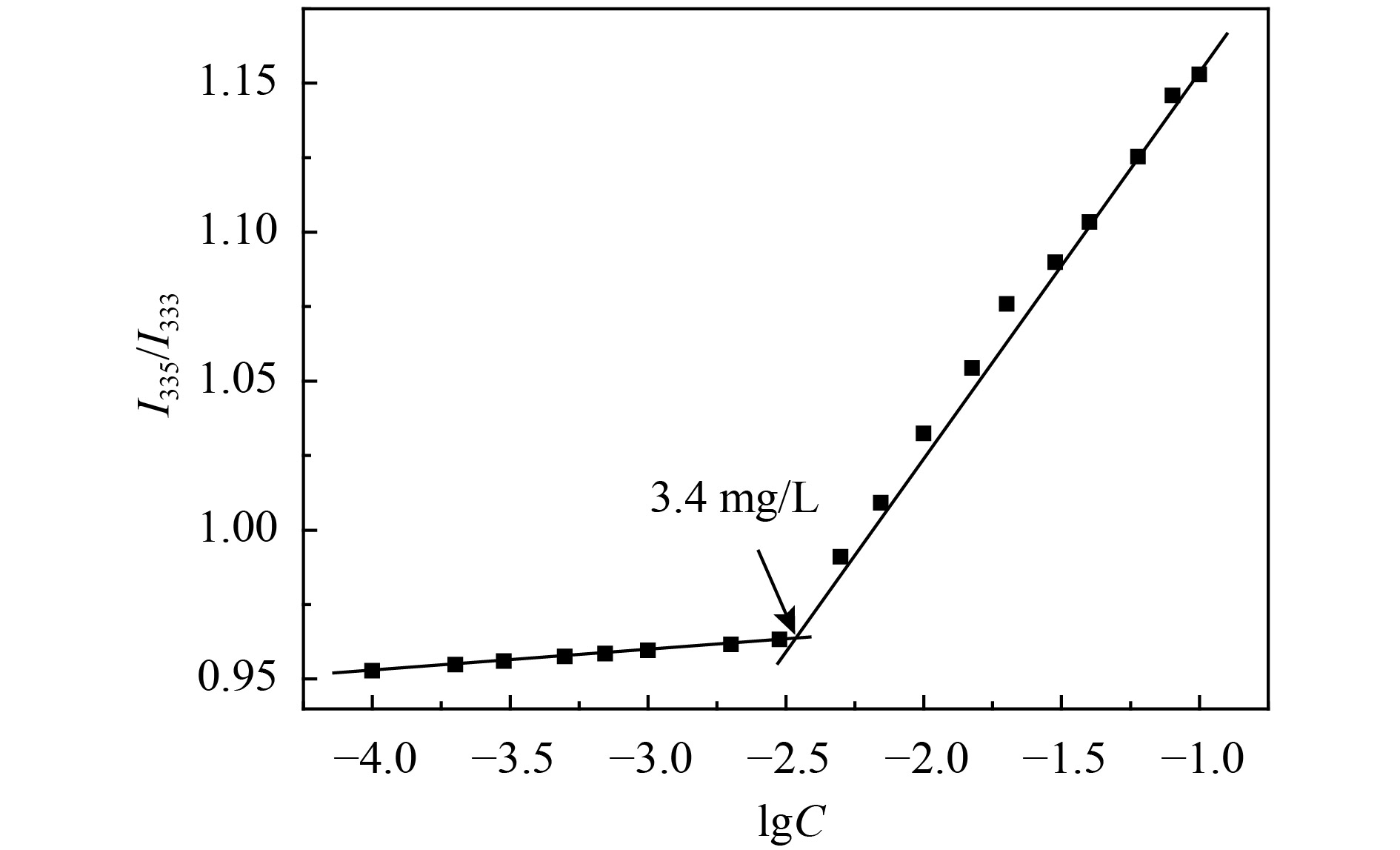
|
图 4 强度比(I335/I333)随水溶液中聚合物浓度的对数变化的曲线图 Figure 4 Graphs of intensity ratios (I335/I333) as function of logarithm of polymeric concentrations in aqueous solution |
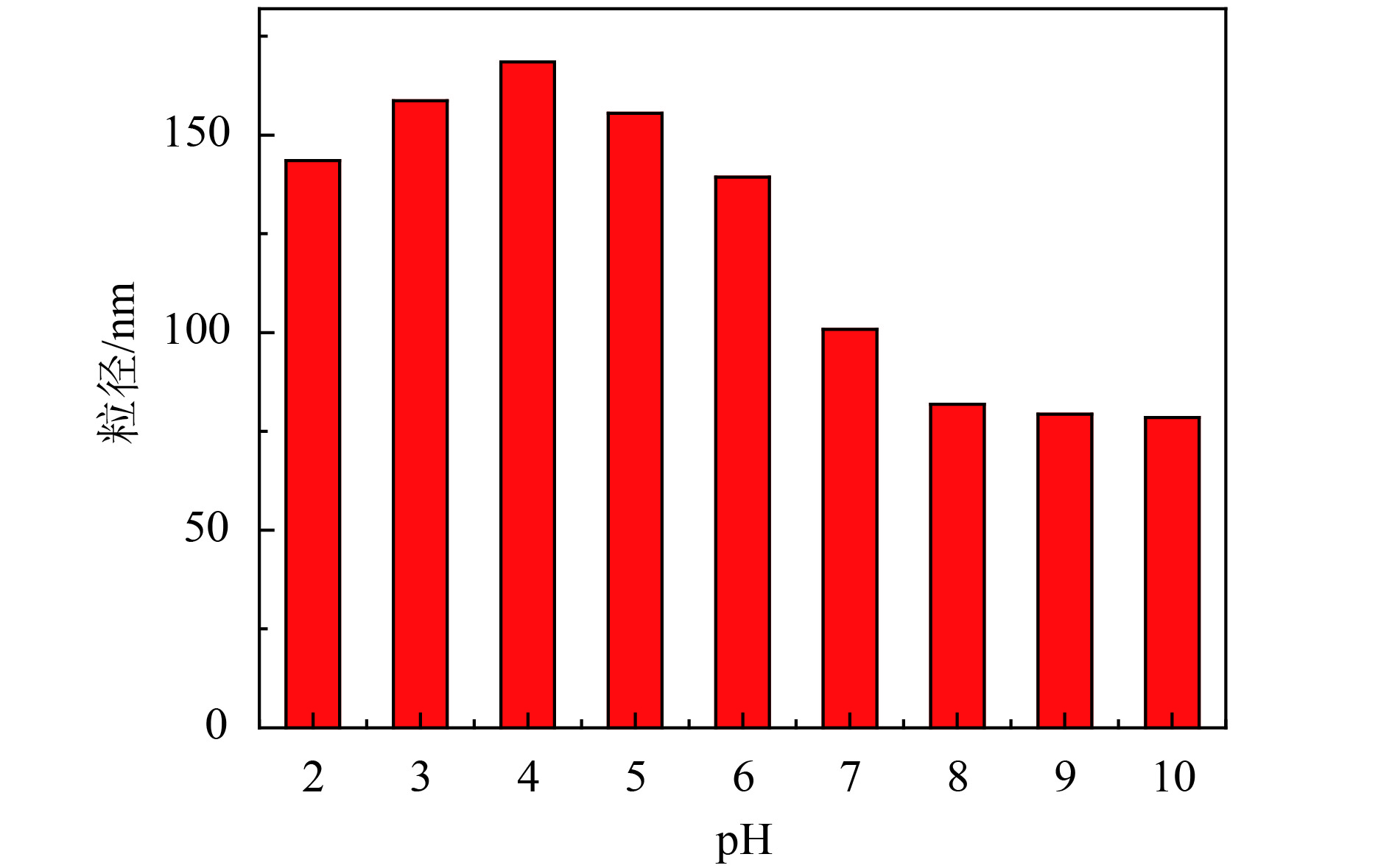
图5为空白聚合物胶束在水溶液中的粒径随pH的变化情况. 由图可知,胶束的粒径在pH 8~10范围内基本保持不变,当pH从8降至4时,粒径逐渐变大,并在pH=4时到达最大值,继续降低溶液的pH,胶束粒径逐渐变小. 这主要是因为在中性或碱性条件下,PDEAEMA侧链的叔氨基完全去质子化并且在PCL内核周围形成一层疏水层,胶束的结构紧密;在酸性条件下,PDEAEMA侧链的叔氨基逐渐质子化,静电排斥作用增加,胶束膨胀以平衡增加的静电排斥[16];当pH下降到小于4时,静电排斥大于胶束内疏水相互作用,胶束结构轻微解离,导致胶束的粒径减少[17].
|
图 5 pH对Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束粒径的影响 Figure 5 Effects of pH on the particle size of Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 micelles |
结合DOX后,由DLS测定DOX负载Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束的粒径,结果如图6所示. 由图可知该星状聚合物载药胶束的粒径分布系数(PDI)为0.078,平均直径约为159.0 nm,胶束尺寸接近脂蛋白和病毒等天然介观体系的尺寸,表明该聚合物胶束具有作为药物输送系统的独特的生理特性. 采用透射电镜观察载药胶束的形貌,结果如图7所示. TEM图像显示胶束为核−壳结构的球形颗粒,直径约50 nm,这与DLS的数据不符. 这是由于TEM测试是在没有溶剂的情况下获得的,而DLS是在溶液中测试的[18].

|
图 6 DOX负载Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束的尺寸分布 Figure 6 Particle size distribution of drug-loaded Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 micelles |

|
图 7 DOX负载Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束的透射电镜图 Figure 7 TEM of drug-loaded Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 micellles |
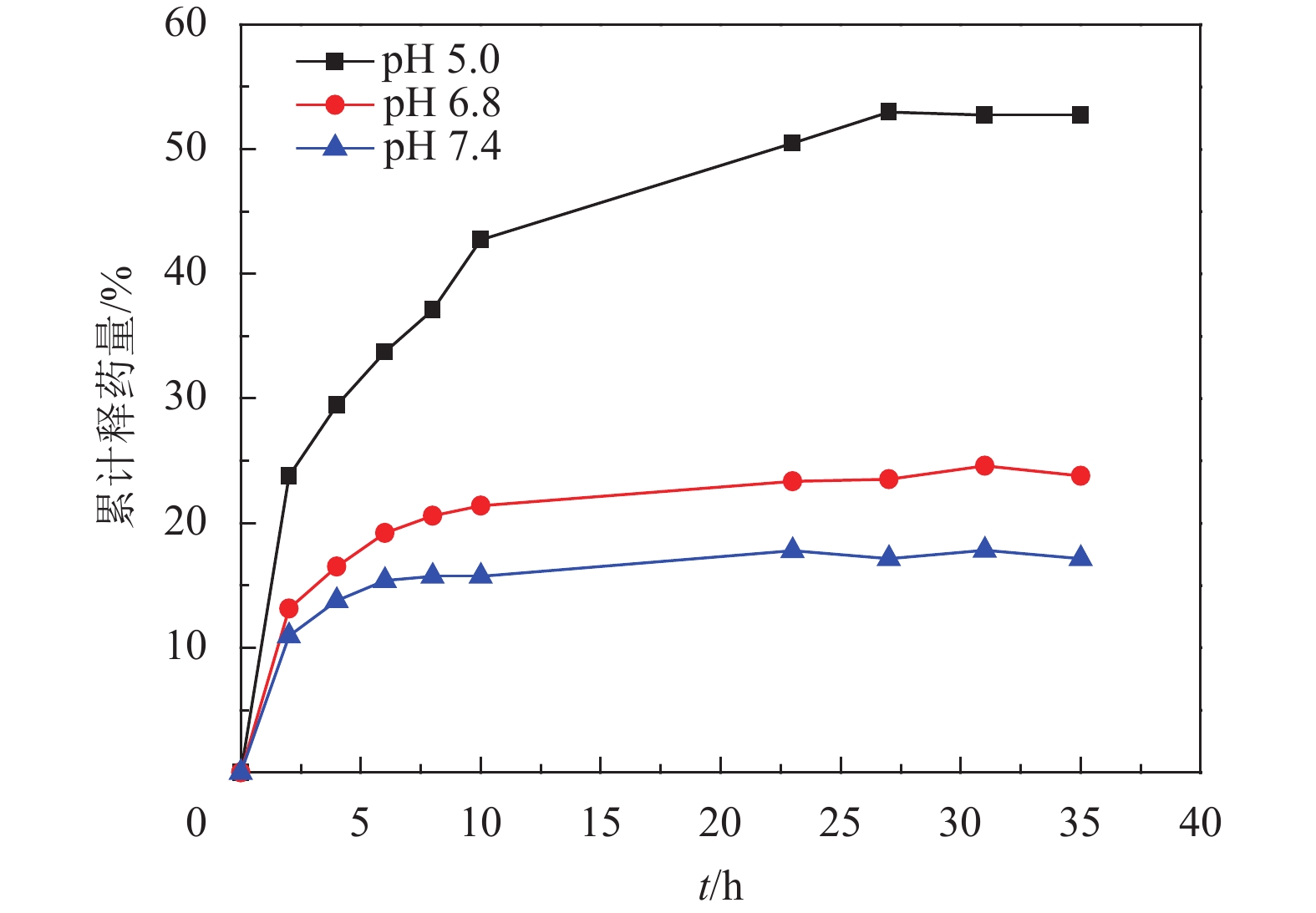
图8为不同pH值下,载药胶束的体外药物释放情况. 由图可知,当pH=7.4时,只有17%的DOX从Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束释放;在pH=6.8下,DOX从聚合物胶束中的释放速率略有提高,35 h仅增加10%,pH降至5.0时,53%的DOX从聚合物胶束迅速释放. 这表明该聚合物胶束对内涵体/溶酶体pH的敏感性,从这个角度来看,Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束纳米颗粒可以减少药物的过早释放,这一特性有益于癌症的治疗.
|
图 8 DOX负载的Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束的DOX释放曲线 Figure 8 Drug release profiles of DOX from DOX-loaded Ad-(PCL-b-PDEAEMA-b-PPEGMA)4 |
根据肿瘤组织的pH特异性,设计了pH响应星状聚合物Ad-(PCL-b-PDEAEMA-b-PPEGMA)4. 结合ROP和ARGET ATRP方法成功合成了分子量分布窄(PDI<1.30)、结构明确的聚合物. 该聚合物自组装胶束具有良好的稳定性(CMC=3.4 mg/L). 由于PDEAEMA的氨基质子化,胶束的粒径显示出pH依赖性. DOX的体外释放结果表明,当pH=7.4时,药物的累积释放量为17%,说明胶束可以有效地降低药物的突释. 因此,pH响应Ad-(PCL-b-PDEAEMA-b-PPEGMA)4胶束具有特异性递送抗癌药物的潜能.
| [1] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J].
CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132.
DOI: 10.3322/caac.21338. |
| [2] |
JIAGGE E, BENSENHAVER J M, OPPONG J K, et al. Global surgical oncology disease burden: addressing disparities via global surgery initiatives: the university of michigan international breast cancer registry[J].
Annals of Surgical Oncology, 2015, 22(3): 734-740.
DOI: 10.1245/s10434-014-4345-7. |
| [3] |
MCGUIRE S. World cancer report 2014. Geneva, Switzerland: World Health Organization, international agency for research on cancer[J].
Advances in Nutrition: An International Review Journal, 2016, 7(2): 418-419.
DOI: 10.3945/an.116.012211. |
| [4] |
OWEN S C, CHAN D P Y, SHOICHET M S. Polymeric micelle stability[J].
Nano Today, 2012, 7(1): 53-65.
DOI: 10.1016/j.nantod.2012.01.002. |
| [5] |
GRECO F, VICENT M J. Combination therapy: opportunities and challenges for polymer-drug conjugates as anticancer nanomedicines[J].
Advanced Drug Delivery Reviews, 2009, 61(13): 1203-1213.
DOI: 10.1016/j.addr.2009.05.006. |
| [6] |
GUO J W, GAO X L, SU L N, et al. Aptamer-functionalized PEG-PLGA nanoparticles for enhanced anti-glioma drug delivery[J].
Biomaterials, 2011, 32(31): 8010-8020.
DOI: 10.1016/j.biomaterials.2011.07.004. |
| [7] |
PEER D, KARP J M, HONG S, et al. Nanocarriers as an emerging platform for cancer therapy[J].
Nature Nanotechnology, 2007, 2(12): 751-760.
DOI: 10.1038/nnano.2007.387. |
| [8] |
SAW P E, PARK J, JON S, et al. A drug-delivery strategy for overcoming drug resistance in breast cancer through targeting of oncofetal fibronectin[J].
Nanomedicine: Nanotechnology, Biology and Medicine, 2017, 13(2): 713-722.
DOI: 10.1016/j.nano.2016.10.005. |
| [9] |
KANAMALA M, WILSON W R, YANG M M, et al. Mechanisms and biomaterials in pH-responsive tumour targeted drug delivery: a review[J].
Biomaterials, 2016, 85(1): 152-167.
|
| [10] |
KARIMI M, ESLAMI M, SAHANDI-ZANGABAD P, et al. pH-sensitive stimulus-responsive nanocarriers for targeted delivery of therapeutic agents[J].
Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology, 2016, 8(5): 696-716.
DOI: 10.1002/wnan.1389. |
| [11] |
LEE E S, SHIN H J, NA K, et al. Poly(L-histidine)-PEG block copolymer micelles and pH-induced destabilization[J].
Journal of Controlled Release, 2003, 90(3): 363-374.
DOI: 10.1016/S0168-3659(03)00205-0. |
| [12] |
KO J, PARK K, KIM Y S, et al. Tumoral acidic extracellular pH targeting of pH-responsive MPEG-poly(β-amino ester) block copolymer micelles for cancer therapy[J].
Journal of Controlled Release, 2007, 123(2): 109-115.
DOI: 10.1016/j.jconrel.2007.07.012. |
| [13] |
YANG Y Q, ZHAO B, LI Z D, et al. pH-sensitive micelles self-assembled from multi-arm star triblock co-polymers poly(ε-caprolactone)-b-poly(2-(diethylamino)ethyl methacrylate)-b-poly(poly(ethylene glycol) methyl ether methacrylate) for controlled anticancer drug delivery[J].
Acta Biomaterialia, 2013, 9(8): 7679-7690.
DOI: 10.1016/j.actbio.2013.05.006. |
| [14] |
杨友强. pH响应聚合物及其胶束给药系统: 制备和结构性能关系[D]. 广州: 华南理工大学化学与化工学院, 2012.
|
| [15] |
柳滢春, 郭建维, 罗涛, 等. (乙烯基咔唑-对金刚烷基苯乙烯)共聚物的合成与光致发光性能[J].
广东工业大学学报, 2018, 35(1): 73-76.
LIU Y C, GUO J W, LUO T, et al. A study of the preparation and photoluminescence of copolymers of Vinyl Carbazole and 4-(1-adamantyl) Styrene[J]. Journal of Guangdong University of Technology, 2018, 35(1): 73-76. DOI: 10.12052/gdutxb.170136. |
| [16] |
WU H, ZHU L, TORCHILIN V P. pH-sensitive poly(histidine)-PEG/DSPE-PEG co-polymer micelles for cytosolic drug delivery[J].
Biomaterials, 2013, 34(4): 1213-1222.
DOI: 10.1016/j.biomaterials.2012.08.072. |
| [17] |
YANG C F, XIAO J Y, XIAO W F, et al. Fabrication of PDEAEMA-based pH-responsive mixed micelles for application in controlled doxorubicin release[J].
RSC Advances, 2017, 7(44): 27564-27573.
DOI: 10.1039/C7RA04358A. |
| [18] |
JIANG J, LIU Y, GONG Y, et al. pH-induced outward movement of star centers within coumarin-centered star-block polymer micelles[J].
Chemical Communications, 2012, 48(88): 10883-10885.
DOI: 10.1039/c2cc35680e. |
 2019, Vol. 36
2019, Vol. 36

