2. 巴黎第七大学 ITODYS实验室,法国 巴黎 75013
2. ITODYS Lab, Paris Diderot, Paris 75013, France
皮肤衰老主要表现为皮肤变薄,松弛容易产生皱纹等[1-2]. 丝聚蛋白是角质层的重要成分,影响角质层的生成、皮肤屏障以及保水能力与皮肤衰老紧密相关[3]. I、III型胶原蛋白的减少是造成皮肤松弛与皱纹生成的主要原因[4]. 通过含药血清作用于人成纤维衰老细胞[5-6]或测试衰老动物服用口服液后动物体内衰老相关指标的变化评价口服液的延衰效果已多次被报道[7-9]. 但通过与人体皮肤相近的组织工程皮肤,对含药血清进行延衰评价,尚未见报道. 本研究基于含药血清可提高二维人衰老成纤维细胞存活率的实验基础上,进一步在表皮模型与三维真皮衰老模型,对复方黄芪口服液的延缓衰老的药理作用进行研究,同时为口服类美容产品的体外研究,提供了一种新的有效方法.
1 材料酶标仪、CO2细胞培养箱(Thermo Fisher公司);低速台式离心机、高速台式离心机(湘仪仪器有限公司);倒置荧光显微镜IX73(日本奥林巴斯公司);病理切片机(德国徕卡仪器有限公司);包埋机(武汉俊杰电子有限公司).
健康SD大鼠,体重180~200 g,SPF级,雌雄各半由广州中医药大学实验动物中心提供,试验动物合格证号:SCXK(粤)2013-0034 ;人原代成纤维细胞系(美国Life- line公司);Episkin表皮模型(上海安肤诺公司).
复方黄芪口服液(实验批号:20160928,由广东工业大学天然药物与绿色研究所提供,临用时用蒸馏水稀释至生药含量为10 g/mL);Matrigel(美国BD公司);丝聚蛋白抗体(Abcam公司);人胶原蛋白I、III型Elisa试剂盒(美国TSA公司);高糖DMEM培养基、胎牛血清、胰蛋白酶(Gibco公司);磷酸缓冲溶液,青霉素、链霉素(Hyclone公司);丝裂霉素(上海美伦生物公司);4%多聚甲醛溶液、Triton 100、四甲基偶氮唑盐、二甲基亚砜、DAPI、正常羊血清、柠檬酸(索莱宝公司);BCA蛋白定量试剂盒(Thermo Fisher公司);二甲苯、无水乙醇(国药集团化学试剂有限公司).
2 方法 2.1 血清的制备将12只SD大鼠,随机分为两组,即含药血清组与不含药血清组,雌雄各半,各组大鼠体重无统计学差异(P>0.05),分别灌胃剂量为5 g/kg的复方黄芪口服液与等量生理盐水连续7 d,每天1次. 最后1天灌胃2 h后,用乙醚麻醉SD大鼠,无菌条件下,采用心脏穿刺法采血,血样静置2 h,血块收缩后,3 000 r·min–1离心10 min,取上层清液,56 ℃ 灭活30 min,置于–20 ℃冰箱备用.
2.2 MTT实验96孔板中每孔接种5×103 个人原代成纤维细胞,在37 ℃,5% 体积分数CO2的细胞培养箱中培养24 h后,模型组、不含药血清组、含药血清组换用浓度为200 nmol·L–1丝裂霉素的无血清DMEM培养基作用于人原代成纤维细胞,空白对照组换用DMEM完全培养基继续培养,48 h后不含药血清组与含药血清组换用含10% 的不含药血清与含药血清的DMEM培养基作用于细胞,空白对照组与模型组换液继续培养,24 h后每孔分别加入10 μL用磷酸缓冲盐溶液(PBS)配制的5 mg·L–1无菌四甲基偶氮唑盐(MTT)溶液,将孔板放入细胞培养箱孵育4 h后,弃去孔板的液体,每孔分别加入100 μL DMSO溶解紫色结晶,用酶标仪于570 nm下测量OD值,计算细胞存活率.
2.3 血清作用于Episkin表皮模型评价丝聚蛋白的变化将购得的由人原代角质细胞构建的Episkin表皮模型用含10% 胎牛血清、不含药血清与含药血清的DMEM培养基在37 ℃,5% CO2细胞培养箱进行气液培养7 d,每2 d更换1次培养基. 第8 d将所有Episkin表皮模型用PBS清洗3次后,4% 多聚甲醛固定30 min,冲洗3次后,乙醇梯度脱水,石蜡包埋,再用组织切片机将样品进行切片,将石蜡切片放入二甲苯中脱蜡,乙醇梯度脱水,柠檬酸(PH=6)中进行抗原修复,加入自发荧光淬灭剂5 min,PBS冲洗3次,每次10 min,正常羊血清封闭30 min,PBS冲洗3次,用PBS稀释的人丝聚蛋白抗体4 ℃避光孵育过夜,再用PBS冲洗3次,加入二抗避光孵育2 h,用PBS冲洗3次,加入100 μg·mL–1 DAPI避光孵30 min,PBS冲洗3次,每次至少15 min,封片后用奥林巴斯IX73倒置荧光显微镜分别在330~380 nm、510~560 nm激光波长下取像,采用Image J软件进行图像分析.
2.4 血清作用于三维真皮模型评价人胶原I、III型蛋白的变化将Matrigel从–20 ℃ 取出置于冰上融化后,于24孔Transwell嵌套培养板上室加入30 μL Matrigel放入37 ℃,5% CO2的细胞培养箱中1 h,铺被上室,用DMEM完全培养基重悬人成纤维细胞,获得细胞密度为1×105 mL–1的细胞悬液,按细胞悬液与Matrigel 1∶2(v/v)的体积比将细胞冰上重悬混匀,置冰上5~10 min消除气泡,再接种150 μL至己铺被的24孔Transwell嵌套培养板上室,放入37 ℃,5% CO2的细胞培养箱中1 h,之后补充DMEM完全培养基浸没培养5 d,每2 d换液1次. 第6 d,模型组、不含药血清与含药血清组更换成200 nmol·L–1丝裂霉素(MMC)的无血清DMEM培养基连续培养2 d,空白对照组换用DMEM完全培养基继续培养,第8 d,不含药血清组与含药血清组换用10%含对应血清的DMEM培养基,其余组用DMEM完全培养基继续培养7 d,每2 d换液1次. 第15 d,收集组织样品,匀浆器匀浆后,于冰上加入过量的细胞裂解液,在4 ℃下,12 000 r/min离心5 min,收集上清液,用BCA蛋白检测试剂盒将组织样品的进行总蛋白定量,取相同浓度的蛋白样品用人胶原I、III蛋白Elisa试剂盒检测实验各组人胶原I、III型蛋白的含量.
2.5 统计学分析数据资料(
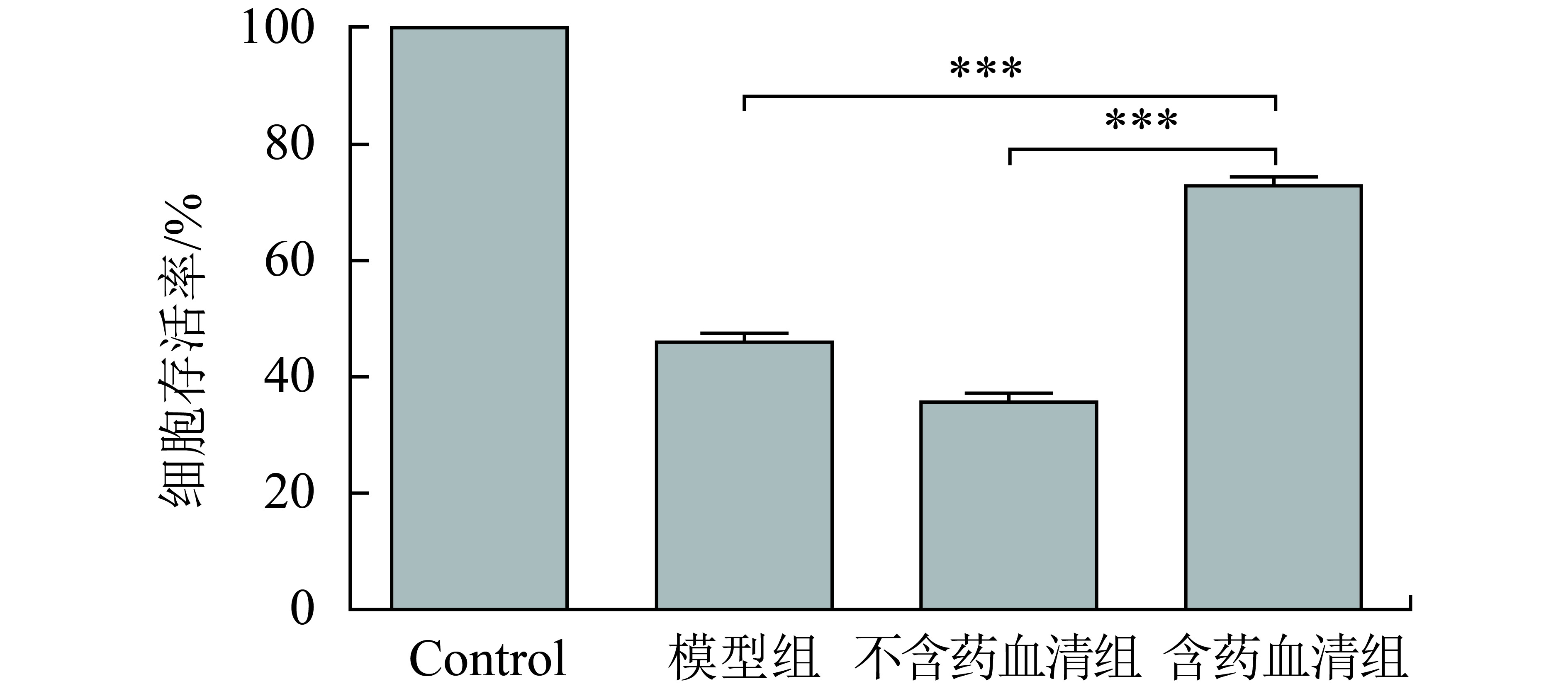
以DMEM完全培养基培养的人成纤维细胞为空白对照,不含药血清和含药血清组分别作用于200 nmol·L–1丝裂霉素(MMC)干预48 h的人成纤维细胞24 h后,由图1可见,含药血清组相比于不含药血清组与模型组,细胞存活率高,可显著促进MMC干预后的人成纤维细胞细胞增殖(P<0.05). 不含血清组不仅对MMC干预的人成纤维细胞没有增殖促进作用,且相比于模型组,细胞存活率下降,细胞数量减少.
|
图 1 血清对人成纤维衰老细胞的增殖影响(与含药血清组比较 *** P<0.001) Figure 1 The effect of serum on the proliferation of human aging fibroblasts |
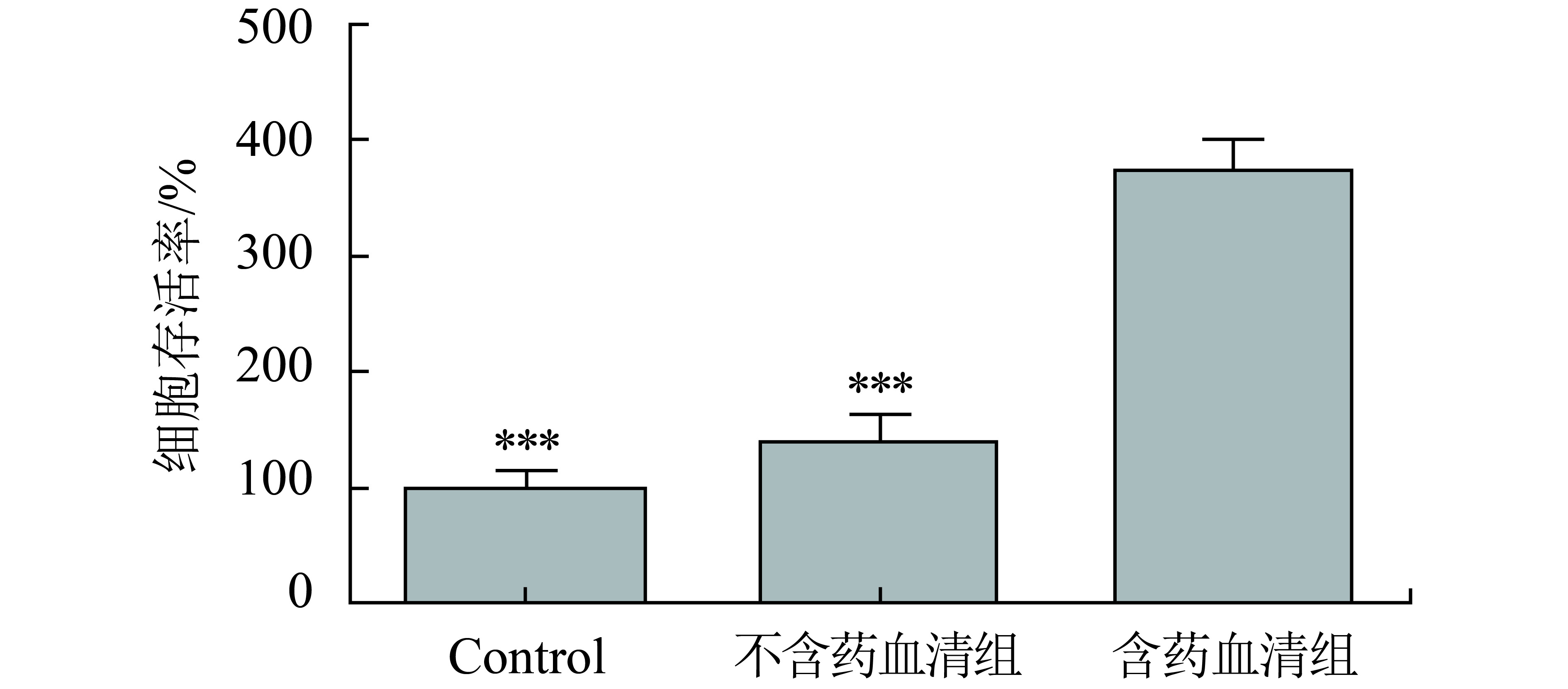
丝聚蛋白对角质层的形成、皮肤屏障与保水能力密切相关,从图2和图3可看出,含药血清组绿色荧光强度明显较高于空白对照组与不含药血清组,通过ImageJ进行绿色荧光强度统计见图3,含药血清组绿色荧光强度分别是不含药血清组、空白对照组的2.6倍和3.4倍,差异显著(P<0.001),而空白对照组与不含药血清组之间无明显差异,进一步证明了含药血清可促进表皮层丝聚蛋白的形成从而提高皮肤屏障,防止皮肤水分流失,延缓皮肤老化.

|
图 2 丝聚蛋白在实验各组Episkin模型中的表达(绿色标记丝聚蛋白,蓝色标记细胞核,n=3,bar=100 μm, (a)、(b)和(c)组分别为空白对照组、不含药血清组和含药血清组) Figure 2 Inverted fluorescence microscope observation of filaggrin expression in Episkin model (green marker is filaggrin, blue marker is nucleus, n=3, bar=100 μm) (a), (b) and (c) group are control group, non medicated serum group and medicated serum group,respectively. |
|
图 3 各组Episkin模型丝聚蛋白的含量(与含药血清组相比,***P<0.001) Figure 3 The content of filaggrin in Episkin model of each group |
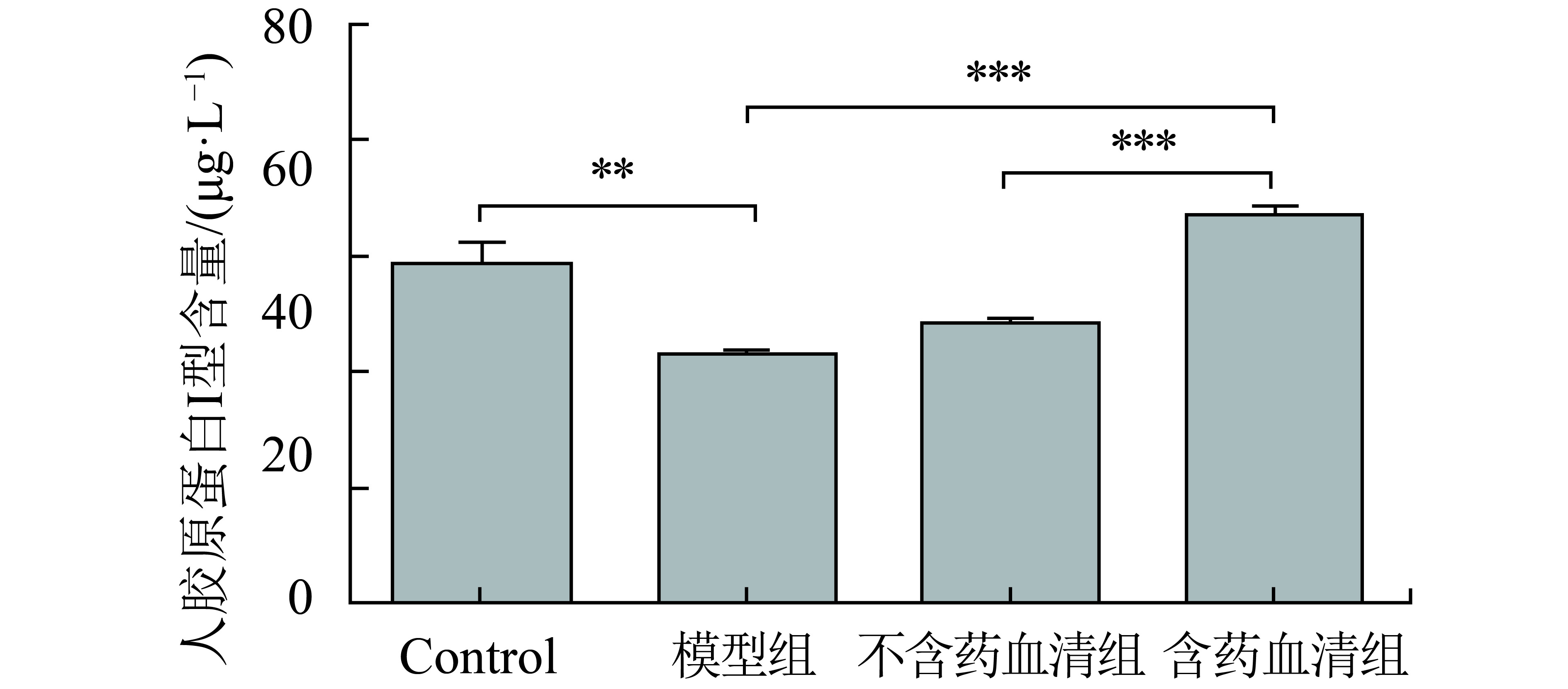
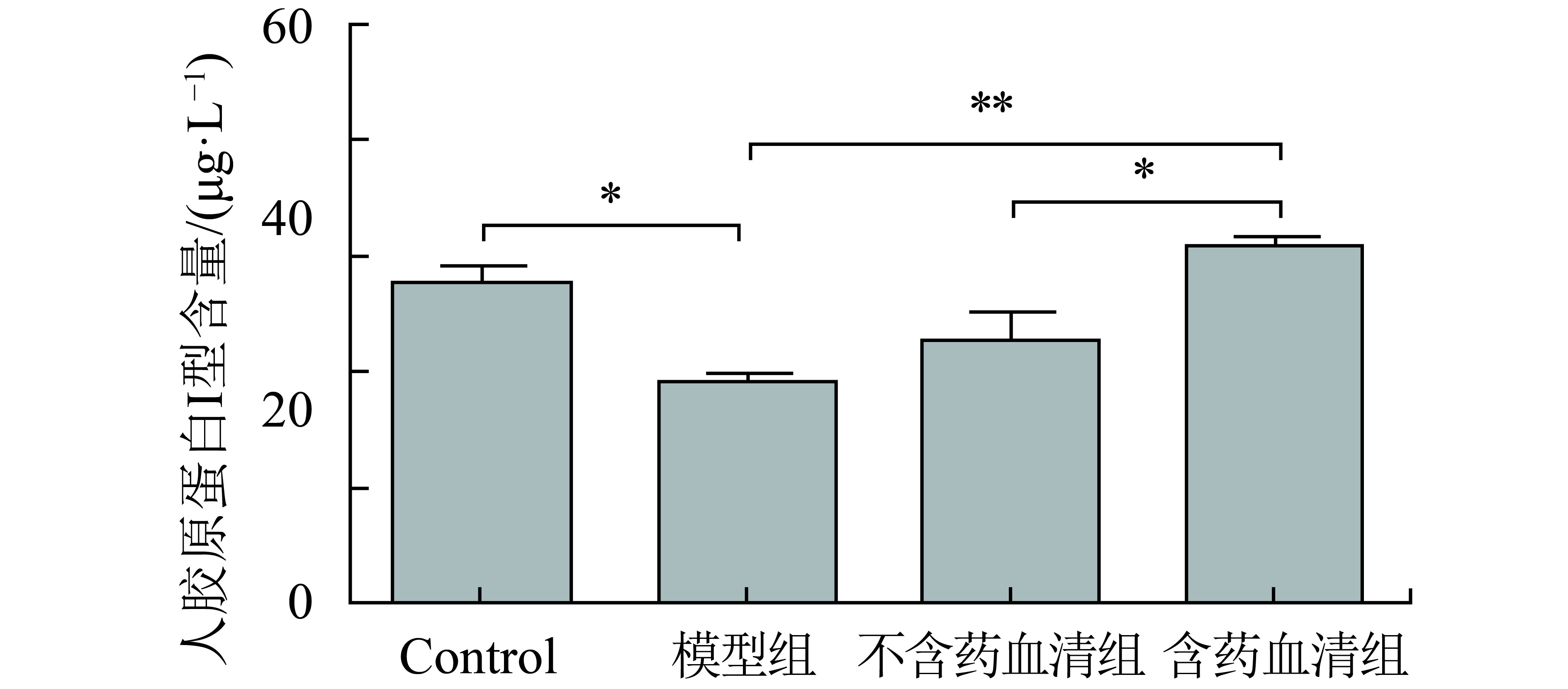
Elisa试剂盒测试结果见图4和图5,空白对照组人胶原蛋白I、III型的表达与衰老模型组相比均有显著性差异(P<0.01与P<0.05),与人体内皮肤衰老过程中人胶原蛋白I、III型含量减少的现象相一致. 含药血清组相比不含药血清组与模型组,人胶原蛋白I、III型含量均有不同程度的显著性增加,特别是人胶原蛋白III型,差异明显(P<0.001). 实验表明,含药血清可提高人胶原I、III型的表达,从而提高皮肤支撑力,减少皱纹的产生,延缓皮肤衰老.
|
图 4 三维真皮人胶原蛋白I型表达含量(**P<0.01;***P<0.001) Figure 4 The expression of human collagen type I in 3D human dermal skin model |
|
图 5 三维真皮人胶原蛋白III型的含量(*P<0.05;**P<0.01) Figure 5 The expression of human collagen type III in 3D human dermal skin model |
中药一般经过口服给药后经过消化道、肠道菌群作用后,部分被吸收进入血液,通过血液运输到器官,发挥功效. 中药血清药理学,可模拟药物的体内代谢过程实现体外实验的有效性,作为中药复方研究中所采用的重要实验方法之一,经过多年的发展已被广泛认可并应用[10].
针对中药对皮肤抗衰老的研究,目前大多数究主要采用含药血清作用于二维细胞进行衰老指标分析或采用D-半乳糖动物衰老模型,对服用中药后的动物的组织样品、血清等进行分析[11-13]. 许多中药已通过现代医学的手段被证实具有抗衰老的作用并应用于皮肤抗衰的口服产品中[14-15]. 本研究的复方黄芪口服液主要成分为黄芪与胶原蛋白肽,具有美容养颜,延缓衰老的作用. 黄芪为扶正固本的中药,对于人成纤维细胞活力的提升以及提升I、III型蛋白的合成,降低与衰老相关的β-半乳糖苷酶(SA-β-gal)酶的表达等机理研究已被证实[16-17]. 胶原蛋白肽的抗衰老机理研究也已被报道[18].
本研究基于血清药理学的方法,验证了含药血清在二维人成纤维衰老细胞实验的有效性后,开创性地采用了组织工程皮肤模型进行功效评价. 组织工程皮肤有稳定的机械性能,能为细胞生长提供三维生长环境以及细胞外基质(ECM),弥补了二维细胞生长缺乏完整的三维微环境的缺陷,且采用人体皮肤细胞,具有与人体内皮肤相近的组织形态与功能,是皮肤科学研究体内体外实验的有效手段[19-20].
二维细胞衰老模型实验中,含药血清组细胞的存活率高,相比于灌胃等量生理盐水获得的不含药血清组与模型组,差异显著(P<0.001),有利于促进人成纤维细胞增殖生长. Episkin表皮模型中,荧光强度统计结果表明,含药血清组丝聚蛋白表达量分别是不含药血清组、模型组的2.6倍和3.4倍,差异明显(P<0.001),可促进表皮丝聚蛋白的表达,促进角质层生成,提升皮肤屏障功能与保水能力. 而组织工程真皮实验中,含药血清组相对比于不含药血清组对人胶原I型蛋白的提升作用明显(P<0.001),对人胶原III型蛋白的提升,也有一定的作用(P<0.01). 实验结果表明,复方黄芪口服液能明显促进人成纤维细胞增殖,提高表皮层丝聚蛋白的表达与真皮层人胶原蛋白I、III型蛋白的表达,从而促进角质层生成,提高皮肤屏障以及保水能力,增强真皮层的支撑力,减少皮肤皱纹的产生,达到皮肤延衰的功效.
本文将组织工程皮肤与中药血清学相结合,利用组织工程皮肤组织结构与功能与人体皮肤更接近且可进行组织、细胞与分子层面多维度分析的特点,验证了口服液功效,这也为口服中草药的体外检测提供了一个方法与思路,对中药现代化的发展有积极的作用.
| [1] |
NEWTON V L, MCCONNELL J C, HIBBERT S A, et al. Skin aging: molecular pathology, dermal remodelling and the imaging revolution[J].
Giornale Italiano Di Dermatologia E Venereologia, 2015, 150(6): 665-674.
|
| [2] |
RITTIÉ L, FISHER G J. Natural and sun induced aging of human skin[J].
Cold Spring Harbor Perspectives in Medicine, 2015, 5(1): a015370.
DOI: 10.1101/cshperspect.a015370. |
| [3] |
DOS S M, METRAL E, BOHER A, et al. In vitro 3-D model based on extending time of culture for studying chronological epidermis aging[J].
Matrix Biology Journal of the International Society for Matrix Biology, 2015, 47: 85-97.
DOI: 10.1016/j.matbio.2015.03.009. |
| [4] |
钟建桥, 胡念芳, 李利. 真皮干细胞与皮肤衰老关系的研究进展[J].
中国皮肤性病学杂志, 2010, 24(5): 479-48.
ZHONG J Q, HU N F, LI L. Advance in the relation between dermal stem cells and skin aging[J]. The Chinese Journal of Dermatovenereology, 2010, 24(5): 479-48. |
| [5] |
宋小平, 陈志武, 方安宁, 等. 银杏叶总黄酮延缓细胞衰老的实验研究[J].
中药材, 2009, 32(1): 100-102.
SONG X P, CHEN Z W, FANG A N, et al. Experimental study on effect of total flavone of ginkgo biloba on delaying cell senescence[J]. Journal of Chinese Medicinal Materials, 2009, 32(1): 100-102. DOI: 10.3321/j.issn:1001-4454.2009.01.033. |
| [6] |
胡作为, 沈自尹, 黄建华. 淫羊藿总黄酮保护衰老细胞端粒长度缩短的实验研究[J].
中国中西医结合杂志, 2004, 24(12): 1094-1097.
HU Z W, SHEN Z Y, HUANG J H. Experimental study on effect of epimedium flavonoids in protecting telomere length of senescence cells[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2004, 24(12): 1094-1097. DOI: 10.3321/j.issn:1003-5370.2004.12.012. |
| [7] |
石丽君, 吴铁, 吴志华. D-半乳糖诱导大鼠皮肤衰老的形态学与生化指标观察[J].
中华皮肤科杂志, 2005, 38(3): 165-167.
SHI L J, WU T, WU Z H. Morphology and biochemical parameters in rats with D-galactose induced skin ageing[J]. Chinese Journal of Dermatology, 2005, 38(3): 165-167. DOI: 10.3760/j.issn:0412-4030.2005.03.011. |
| [8] |
曹蕾, 陈逸青, 陈勤, 等. 西施口服液延缓小鼠皮肤衰老的作用[J].
中国医院药学杂志, 2016, 36(17): 1447-1451.
CAO L, CHEN Y Q, CHEN Q, et al. Antiaging effects of Xishi oral liquid on D-galactose induced aging mouse model[J]. Chinese Journal of Hospital Pharmacy, 2016, 36(17): 1447-1451. |
| [9] |
谢晓辉, 朱瑶, 窦智燕, 等. 一种复方口服美容液的抗衰老作用及毒理学实验研究[J].
中国美容医学, 2017, 26(5): 35-38.
XIE X H, ZHU Y, DU Z Y, et al. Experimental research on anti-aging effect and acute toxicity of a compound oral liquid[J]. Chinese Journal of Aesthetic Medicine, 2017, 26(5): 35-38. |
| [10] |
王喜军. 中药血清药物化学的研究动态及发展趋势[J].
中国中药杂志, 2006, 31(10): 789-792, 835.
WANG X J. Progress and future developing of the serum pharmacochemistry of traditional Chinese medicine[J]. China Journal of Chinese Materia Medica, 2006, 31(10): 789-792, 835. DOI: 10.3321/j.issn:1001-5302.2006.10.001. |
| [11] |
宋琳琳, 赵宏, 沙靖全, 等. 冬奇子口服液延缓皮肤衰老的实验研究[J].
时珍国医国药, 2012, 23(6): 1344-1346.
SONG L L, ZHAO H, SHA J Q, et al. Experimental study on anti-skin-aging action of Dongqi oral liquid[J]. Li Shizhen Medicine and Materia Medica Research, 2012, 23(6): 1344-1346. DOI: 10.3969/j.issn.1008-0805.2012.06.012. |
| [12] |
陈高敏, 王璐, 杜沛, 等. 麦冬多糖对中波紫外线损伤人皮肤成纤维细胞的保护作用[J].
中国组织工程研究, 2017, 21(32): 5183-5188.
CHEN G M, WANG L, DU P, et al. Poly saccharide from Ophiopogon japonicus protects against ultraviolet B damage to the human dermal fibroblasts [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(32): 5183-5188. DOI: 10.3969/j.issn.2095-4344.2017.32.017. |
| [13] |
倪庆纯, 郭健敏, 肖百全, 等. 两种中药组方对D-半乳糖诱导的衰老模型裸鼠皮肤的影响[J].
中草药, 2012, 43(9): 1808-1813.
YU Q C, GUO J M, XIAO B Q, et al. Effects of two prescriptions with Chinese herbal medicines on skin of aging nude mouse model reduced by D-galactose[J]. Chinese Traditional and Herbal Drugs, 2012, 43(9): 1808-1813. |
| [14] |
黄娅琳. 抗衰老中药的研究[J].
时珍国医国药, 2007, 18(3): 691-693.
HUANG Y L. Progress in studies of the anti-aging traditional Chinese drugs[J]. Li Shizhen Medicine and Materia Medica Research, 2007, 18(3): 691-693. DOI: 10.3969/j.issn.1008-0805.2007.03.110. |
| [15] |
张玲, 王文君. 中药延缓皮肤老化作用的研究进展[J].
中西医结合学报, 2009, 7(3): 276-279.
ZHANG L, WANG W J. Research advances of traditional Chinese medicine in delaying skin aging[J]. Journal of Chinese Integrative Medicine, 2009, 7(3): 276-279. |
| [16] |
王曦, 石钰, VIENNET C, 等. 黄芪甲苷对人皮肤成纤维细胞增殖和凋亡的影响[J].
中华医学美学美容杂志, 2006, 12(2): 93-97.
WANG X, SHI Y, VIENNET C, et al. Effects of astragaloside on growth activity and apoptosis of fibroblasts from human skin with and without wrinkle in vitro[J]. Chinese Journal of Medical Aesthetics and Cosmetology, 2006, 12(2): 93-97. DOI: 10.3760/cma.j.issn.1671-0290.2006.02.010. |
| [17] |
赵蕾, 魏晓东, 葛堂栋, 等. 黄芪血清对衰老细胞抗氧化作用及p16表达影响的研究[J].
黑龙江医药科学, 2006, 29(5): 4-5.
ZHAO L, WEI X D, GE T D, et al. Effects of Astragalus Root serum on senile cell anti-oxidation and p16 expression[J]. Heilongjiang Medicine and Pharmacy, 2006, 29(5): 4-5. DOI: 10.3969/j.issn.1008-0104.2006.05.002. |
| [18] |
王奕, 王静凤, 高森, 等. 日本刺参胶原蛋白多肽对紫外线诱导的光老化模型小鼠皮肤的保护作用[J].
中国药科大学学报, 2008, 39(1): 64-67.
WANG Y, WANG J F, GAO S, et al. Protective effect of collagen polypeptides from Apostichopus japonicus on the skin of photoaging-model mice induced by ultraviolet irradiation[J]. Journal of China Pharmaceutical University, 2008, 39(1): 64-67. DOI: 10.3321/j.issn:1000-5048.2008.01.016. |
| [19] |
ABACI H E, GUO Z, DOUCET Y, et al. Next generation human skin constructs as advanced tools for drug development[J].
Experimental Biology and Medicine, 2017, 242: 1657-1668.
DOI: 10.1177/1535370217712690. |
| [20] |
ALI N, HOSSEINI M, VAINIO S, et al. Skin equivalents: skin from reconstructions as models to study skin development and diseases[J].
British Journal of Dermatology, 2015, 173(2): 391-403.
DOI: 10.1111/bjd.13886. |
 2018, Vol. 35
2018, Vol. 35

