二氧化锰具有价格低廉和环境友好的特性,是一种重要的功能材料,被广泛用于催化氧化反应的催化剂(例如部分氧化,选择性氧化,催化燃烧等),重金属的吸附材料、超级电容器的电极材料、金属空气电池的电极催化剂等[1-3]. 二氧化锰具有丰富的晶型,如α-MnO2,β-MnO2,γ-MnO2,δ-MnO2等[4]. 上述不同晶型的二氧化锰的基本构筑单元都是[MnO6],因此可以通过控制[MnO6]的链接方式得到不同晶型的二氧化锰. 一般而言,较之其他晶型的二氧化锰,α-MnO2具有合适的孔道结构,丰富的氧物种,往往表现出优异的氧化还原特性,是一种重要的低温催化燃烧催化剂.
二氧化锰的性能受到晶型、形貌的影响. 因此,可控合成具有特定晶型或者形貌的二氧化锰一直是材料领域的研究热点之一. 就α-MnO2而言,常见的形貌有一维结构的纳米棒、纳米管和纳米线,以及三维结构的纳米球/花/海胆等. 不同形貌的α-MnO2其物理和化学性能往往存在差异,研究表明:与三维球状的α-MnO2相比,一维棒状结构的α-MnO2具有更佳的催化燃烧活性[5]. 在诸多的形貌中,α-MnO2纳米线具有重要的地位. 这是因为一维纳米线可以作为二维或者三维结构复杂/异质结构材料的基本组装单元[6],以之为基础,可以制备出具有新颖结构和性能的复合材料. 影响纳米线性能的基本参数之一是长度或者长径比. 例如,W18O49纳米线的光催化性能受到其长径比的影响[7];BaTiO3纳米线的介电性能也与其长度有关[8]. 因此,可以通过控制纳米线的长度或者长径比实现对其性能的控制. 至今,研究表明已经有数种方法可以得到α-MnO2纳米线,例如早在2002年,李亚栋等[9]就以硫酸锰和过硫酸铵为原料制备α-MnO2纳米线,此后,Qian等[10]也报道了以高锰酸钾和硫化铵为原料制备α-MnO2纳米线的方法,Suib等[11]以硫酸锰和过硫酸钾为原料在250 ℃下反应4 d得到α-MnO2超长纳米线. Yu等[12]则在较为温和的反应条件下,以硫酸锰、硫酸钾和醋酸钾为原料制备得到高质量的α-MnO2纳米线. 尽管关于α-MnO2纳米线的报道诸多,但是通过控制反应条件的实现对α-MnO2纳米线的长度控制,进而研究长度对α-MnO2催化性能的报道则不多见.
本研究论文通过巧妙的设计,以高锰酸钾和乙酸为原料,采用一步水热法制得α-MnO2,通过简单的控制乙酸的加入量可控合成具有不同长度的α-MnO2纳米线. 而后,选择二甲醚(DME)的催化燃烧为探针反应,考察了纳米线的长度对二甲醚催化燃烧性能的影响. 选择二甲醚催化燃烧作为探针反应,是因为二甲醚是一种多来源的新型绿色清洁能源[13],可以替代LPG广泛应用于民用、机车和汽车以及热电厂燃料. 采用催化燃烧的方式可以降低二甲醚起燃温度和提高完全燃烧的效率,降低污染物排放.
1 实验部分 1.1 实验过程称取0.50 g KMnO4加入聚四氟乙烯内胆中,依次加入30 ml的去离子水和0.7 ml的乙酸,搅拌均匀,将聚四氟乙烯内胆装入高压反应釜中,并放置于140 ℃的烘箱中反应12 h,待反应结束后将所得产物用去离子水和无水乙醇交互洗涤3次,然后将固体产物放置于60 ℃烘箱中干燥12 h,最后得到α-MnO2纳米线,简称α-MnO2-1. 通过改变乙酸的加入量(1.4 和2.1 ml)可以得到不同长度的α-MnO2纳米线,分别简记为α-MnO2-2和α-MnO2-3.
1.2 催化剂的表征物相结构表征采用Bruker D8型X-射线衍射仪,测试条件:Cu Ka辐射,管电压40 kV,管电流40 mA,扫描范围2θ为10°-80°,扫描速度为5°/min;采用德国 Carl Zeiss Ultra55型场发射扫描电子显微镜和日立透射电镜(JEOL)观察样品的尺寸、形貌以及分布情况;采用Auto Chem-Ⅱ型化学吸附仪(Micromeritics)进行程序升温还原测试(H2-TPR),催化剂预先在He气氛围中于150 ℃预处理2 h,然后切换成5 % H2/Ar混合气体作为还原气,气体流量为50 ml/min,以10 ℃ /min的升温速率进行还原;采用激光紫外拉曼光谱仪(法国Horiva Jobin Yvon)对材料的结构和骨架进行了表征分析,激发波长是633 nm,功率是0.24 mW.
1.3 催化燃烧性能测试二甲醚的催化燃烧测试在连续流动石英固定床反应装置中进行. 催化剂用量0.2 g (40-60目),将催化剂预先在He氛围下于250 ℃预处理1 h,然后降温至100 ℃待反应炉温度稳定后,开始通入二甲醚进行反应,n(二甲醚):n(氧气):n(氦气)=1:10:40,反应的空速为15 000 ml/h,反应在常压下进行. 反应产物由安捷伦气相色谱仪GC6820在线分析,并使用T10(二甲醚催化燃烧的起燃温度),T99(二甲醚催化燃烧的完全转化温度)作为催化性能的评价标准.
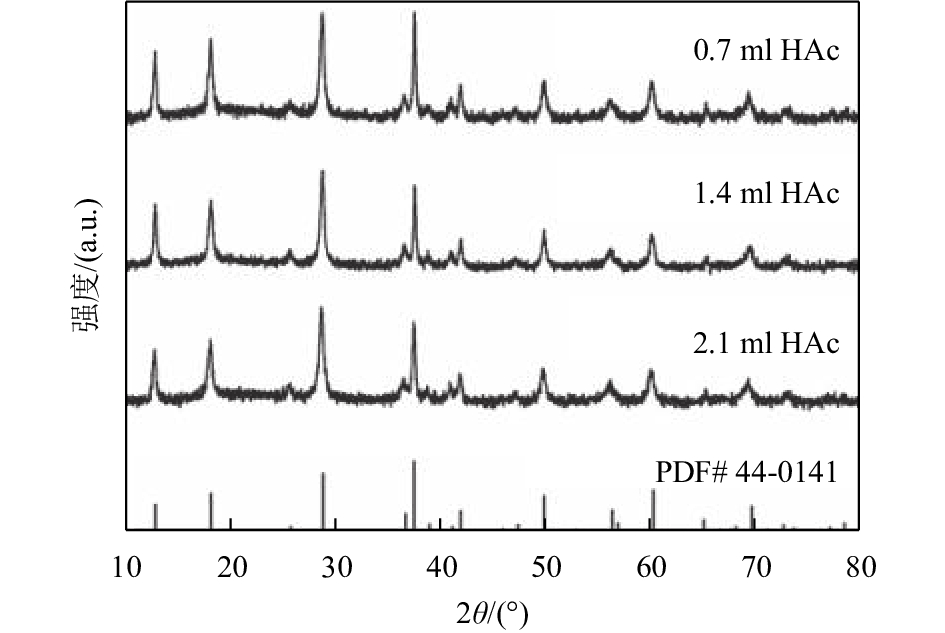
2 结果与讨论 2.1 结构表征图1为不同乙酸加入量(0.7 ml、1.4 ml和2.1 ml)条件下合成产物的XRD图,从图1中可以看出,所合成3个样品的衍射峰与 JCPDS标准卡片44-0141完全吻合,都属于四方相的α-MnO2(空间群为:I4/m,晶胞参数为a=b=0.978 nm,c=0.286 nm). 制备得到的3个α-MnO2样品的XRD图并无显著差异,没有任何的杂质峰,而且样品的特征峰高且尖锐,表明样品没有杂相,同时具有较好的结晶度.
|
图 1 不同乙酸加入量条件下合成产物的X射线衍射谱 Figure 1 XRD patterns of the obtained products using different amounts of CH3COOH |
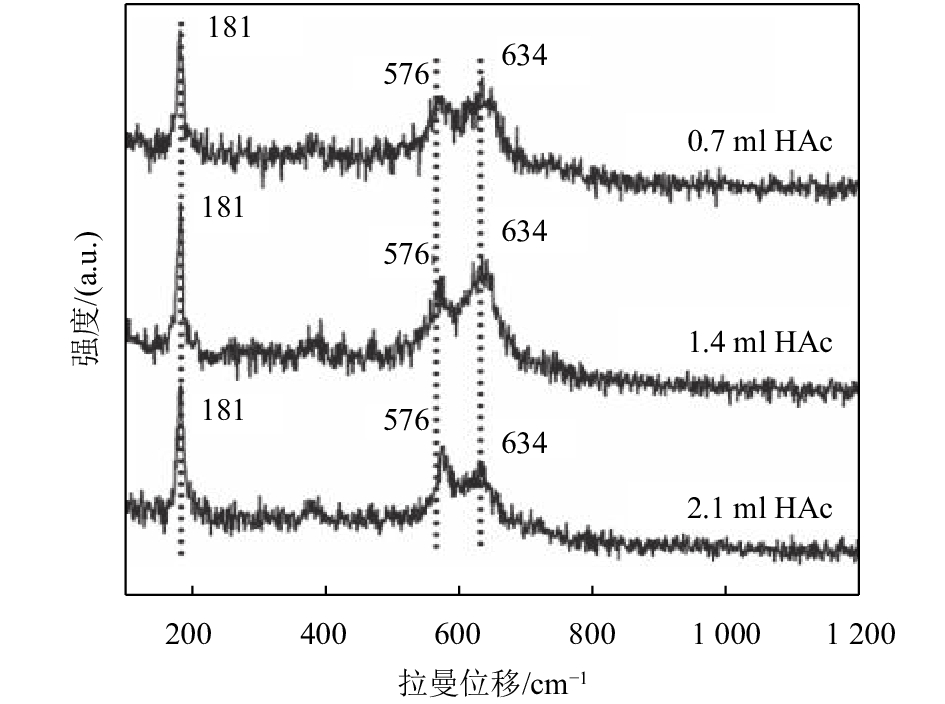
为了进一步验证制备样品的晶型结构,采用拉曼光谱对其进行了测试. 通常情况下,二氧化锰的拉曼光谱一般在180~450,450~550,550~700 cm–1处具有信号峰,它们分别对应二氧化锰的骨架振动,二氧化锰晶格中的Mn-O-Mn扭曲振动和锰氧八面体中的Mn-O键的拉伸振动[12, 14]. 如图2所示,3个α-MnO2样品均在181、576和634 cm–13处有振动峰,在181 cm–1具有较强的振动峰,对应于Mn-O-Mn的振动,而576和634 cm–1这两处振动峰是由[MnO6]的振动引起的,都是属于α-MnO2的特征振动峰.
|
图 2 不同乙酸加入量条件下合成产物的拉曼图谱 Figure 2 Raman spectra of the obtained products using different amounts of CH3COOH |
综合以上XRD和Raman的分析可知,不同含量乙酸不会对产物的晶型产生影响,合成的3个产物均为α-MnO2.
2.2 形貌表征图3为不同乙酸加入量条件下所合成α-MnO2的SEM图,从图中可以看出3个α-MnO2样品的形貌都是纳米线,随着乙酸量的增加,α-MnO2纳米线的长度呈现越来越短的趋势. 当乙酸加入量为0.7 ml时(如图3a所示),α-MnO2纳米线的长度约为6~10 μm,当乙酸加入量为1.4 ml时(如图3b所示),α-MnO2纳米线的长度约为4~8 μm,在透射电镜下取一根纳米线的观察,发现纳米线均一,表面较为平整,其直径约为30 nm;当乙酸加入量为2.1 ml时(如图3c所示),α-MnO2纳米线的长度约为1~3 μm. 通过调控乙酸的加入量,可以得到不同长度的α-MnO2纳米线,我们推测是以下几个原因:(1) 溶液中的乙酸根能够与α-MnO2的表面羟基形成氢键,会吸附在α-MnO2的表面,通过空间位阻效应阻止了α-MnO2纳米线侧面的进一步生长,而且α-MnO2是一种四方相的结构,此结构优先朝c轴方向生长,从而形成纳米线的形貌[12];(2) 由于乙酸加入量的增多,使得反应体系的酸度增加,提高了氧化还原反应的电动势,加快了α-MnO2纳米线的成核速率,从而也促进了纳米线在溶液中的晶化过程,进一步限制了α-MnO2纳米线在c轴方向上的生长[15]. 因此,在乙酸根的吸附作用下,通过调控乙酸的用量和酸度,能够可控合成不同长度的α-MnO2纳米线.

|
图 3 不同乙酸量制备的α-MnO2的SEM图. (a)0.7 ml;(b)1.4 ml;(c)2.1 ml和(d)TEM图 Figure 3 The SEM images of the obtained α-MnO2 using different amounts of CH3COOH: (a)0.7 ml CH3COOH, (b)1.4 ml CH3COOH, (c)2.1 ml CH3COOH, (d)TEM image: |
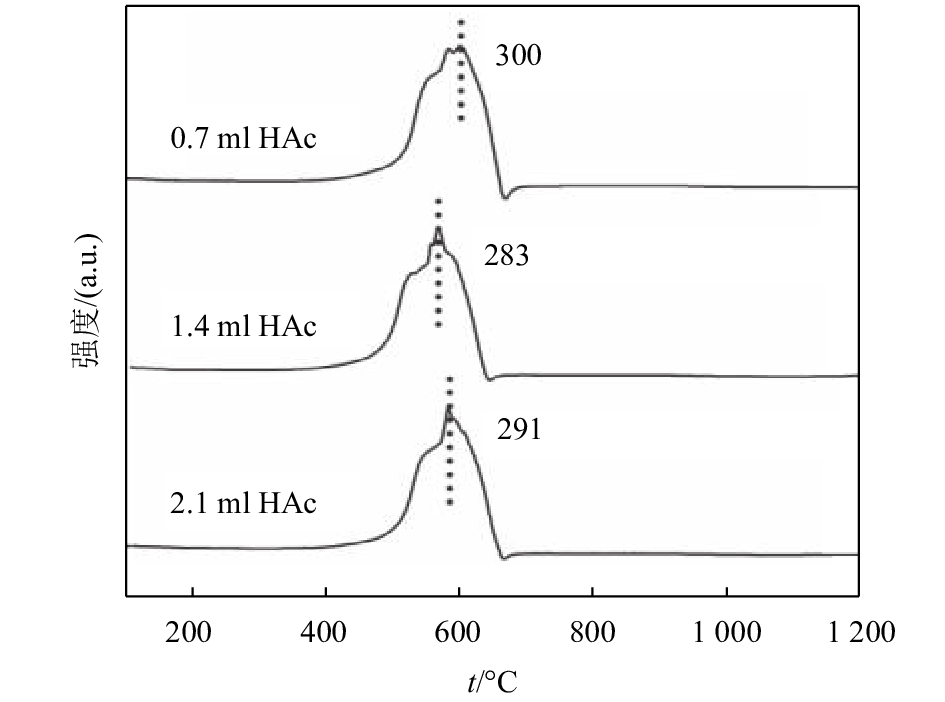
氧化还原性是催化剂的重要特性之一,可作为催化性能优劣的评价指标,采用H2-TPR技术测试了α-MnO2纳米线的氧化还原性能. 一般而言,MnO2的还原过程为:MnO2首先被还原为Mn3O4,而后被还原成Mn2O3,最后被还原成MnO[16-17]. 图4所示为不同乙酸量制备的α-MnO2纳米线的H2-TPR图,从中可以看出,所得3个样品的H2-TPR曲线相似,起始还原温度相近,都含有两个重叠的还原峰,该还原峰包括了锰的价态从+4到+2价的连续还原过程. 其中,α-MnO2-2的还原温度最低,为283 ℃;α-MnO2-3的还原温度为291 ℃;α-MnO2-1的还原温度最高,为300 ℃. 由此可知,1.4 ml乙酸条件下所制得的α-MnO2纳米线的催化活性最好,2.1 ml乙酸所制得的α-MnO2纳米线次之,0.7 ml乙酸所制得的α-MnO2纳米线最差. 这表明α-MnO2的长度对其氧化还原能力具有重要影响,适当长度的纳米线的氧化还原能力最佳.
|
图 4 不同乙酸量制备的α-MnO2纳米线的H2-TPR图 Figure 4 H2-TPR patterns of α-MnO2 nanowire prepared at different amounts of CH3COOH |
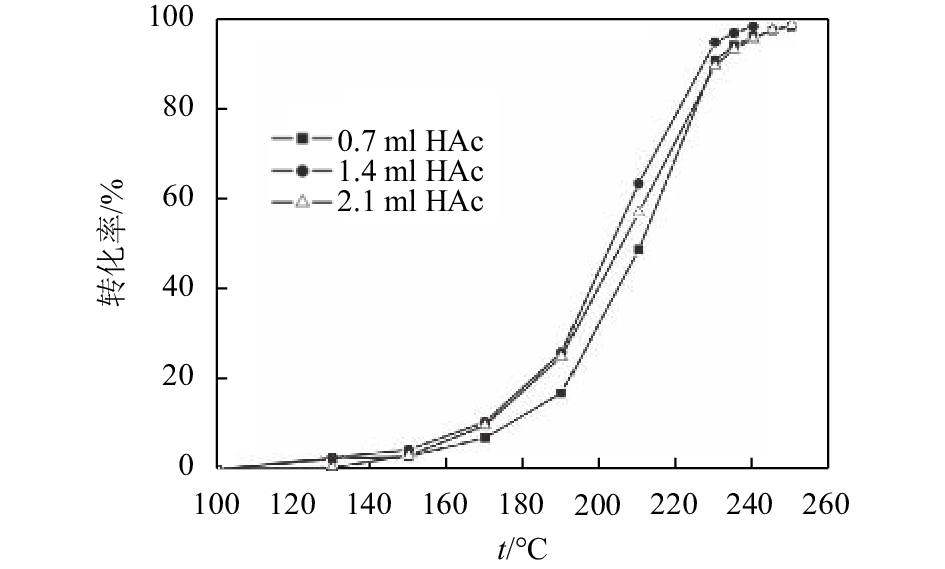
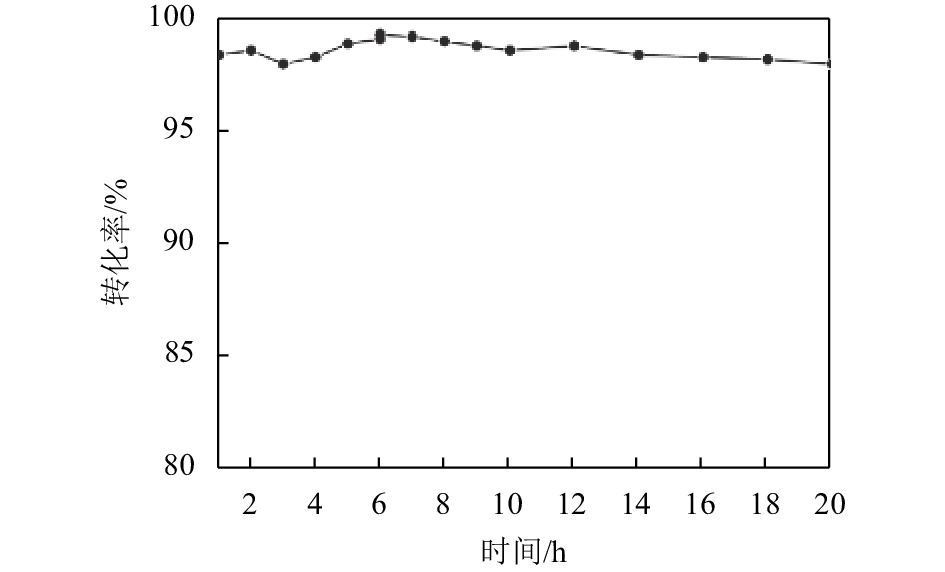
图5所示为不同乙酸量时制备的α-MnO2催化剂对二甲醚催化燃烧性能的影响,由此可以看出,3个样品对二甲醚均具有良好的催化燃烧活性,完全燃烧温度在240~250 ℃. 其中,1.4 ml乙酸制得的α-MnO2纳米线催化燃烧二甲醚的性能最好,具有较低的起燃温度,其T10和T99分别为167 ℃和240 ℃;2.1 ml乙酸制得的α-MnO2纳米线的活性次之,其T10和T99分别为170 ℃和250 ℃;0.7 ml乙酸制得的α-MnO2纳米线催化活性最差,其T10和T99分别为176 ℃和250 ℃. 催化燃烧的活性结果与H2-TPR还原性能结果一致. 为了评价催化剂的稳定性,对1.4 ml乙酸条件下制备的样品α-MnO2-2在240 ℃下进行了20 h的短期寿命测试,其结果如图6所示. 从图6可见,在测试的20 h内,催化剂的活性基本维持在99%附近波动,这表明该样品具有较好的寿命.
|
图 5 不同乙酸量制备的α-MnO2纳米线对二甲醚催化燃烧性能的影响 Figure 5 Effects of α-MnO2 nanowire prepared at different amounts of CH3COOH on catalytic combustion performance of DME |
|
图 6 1.4 ml HAc条件下制备的α-MnO2寿命测试 Figure 6 The stability of the α-MnO2 prepared with 1.4 ml HAc |
(1) 以高锰酸钾为相同锰源的前提下,通过控制乙酸的含量和酸度,可控合成出不同长度的纳米线,结合XRD和Raman等表征分析,推测可能由于体系中大量K+的诱导,反应最终产物为α-MnO2. SEM的结果表明纳米线的长度随着酸量和酸度的增加而降低.
(2) 实验所制得的3种长度不同的α-MnO2纳米线对二甲醚催化燃烧性能的结果与H2-TPR分析相对应,采用1.4 ml乙酸制得的α-MnO2纳米线具有适当的长度,催化燃烧活性最好,完全燃烧温度为240 ℃. 该催化剂同时表现出较为优异的稳定性,在20 h的短期寿命测试中,其活性基本不变.
| [1] |
SHEN X, DING Y, LIU J, et al. Synthesis, characterization, and catalytic applications of manganese oxide octahedral molecular sieve (OMS) nanowires with a 2 × 3 tunnel structure[J].
Chem Mater, 2004, 16(25): 5327-5335.
DOI: 10.1021/cm049291r. |
| [2] |
XU H, YAN N, QU Z, et al. Gaseous heterogeneous catalytic reactions over Mn-based oxides for environmental applications: A critical review[J].
Environ Sci Technol, 2017, 51(16): 8879-8892.
DOI: 10.1021/acs.est.6b06079. |
| [3] |
HOUSEL L M, WANG L, ABRAHAM A, et al. Investigation of α-MnO2 tunneled structures as model cation hosts for energy storage
[J].
Acc Chem Res, 2018, 51(3): 575-582.
DOI: 10.1021/acs.accounts.7b00478. |
| [4] |
符志伟, 程高, 林婷, 等. 二氧化锰制备及催化燃烧甲苯性能研究[J].
广东工业大学学报, 2016, 33(2): 85-90.
FU Z W, CEHNG G, LIN T, et al. The preparation of MnO2 and application in catalytic combustion of toluene [J]. Journal of Guangdong University of Technology, 2016, 33(2): 85-90. DOI: 10.3969/j.issn.1007-7162.2016.02.017. |
| [5] |
CHENG G, YU L, HE B, et al. Catalytic combustion of dimethyl ether over α-MnO2 nanostructures with different morphologies
[J].
Appl Surf Sci., 2017, 409: 223-231.
DOI: 10.1016/j.apsusc.2017.02.218. |
| [6] |
LONG Y, HUI J F, WANG P P, et al. α-MnO2 nanowires as building blocks for the construction of 3D macro-assemblies
[J].
Chem Commun, 2012, 48(47): 5925-5927.
DOI: 10.1039/c2cc32162a. |
| [7] |
LIU J, MARGEAT O, DACHRAOUI W, et al. Gram-scale synthesis of ultrathin tungsten oxide nanowires and their aspect ratio-dependent photocatalytic activity[J].
Adv Funct Mater, 2014, 24(38): 6029-6037.
DOI: 10.1002/adfm.201401261. |
| [8] |
TANG H, ZHOU Z, SODANO H A. Relationship between BaTiO3 Nanowire aspect ratio and the dielectric permittivity of nanocomposites
[J].
ACS Appl Mater Interfaces, 2014, 6(8): 5450-5455.
DOI: 10.1021/am405038r. |
| [9] |
WANG X, LI Y. Selected-control hydrothermal synthesis of α- and β-MnO2 single crystal nanowires
[J].
J Am Chem Soc, 2002, 124(12): 2880-2881.
DOI: 10.1021/ja0177105. |
| [10] |
GAO Y, WANG Z, WAN J, et al. A facile route to synthesize uniform single-crystalline-MnO2 nanowires
[J].
J Cryst Growth, 2005, 279(3-4): 415-419.
DOI: 10.1016/j.jcrysgro.2005.02.052. |
| [11] |
YUAN J, LIU X, AKBULUT O, et al. Superwetting nanowire membranes for selective absorption[J].
Nature Nanotechnology, 2008, 3(6): 332-336.
DOI: 10.1038/nnano.2008.136. |
| [12] |
LAN B, YU L, LIN T, et al. Multifunctional free-standing membrane from the self-assembly of ultralong MnO2 nanowires
[J].
ACS Appl Mater Interfaces, 2013, 5(15): 7458-7464.
DOI: 10.1021/am401774r. |
| [13] |
VOLNINA E A, KIPNIS M A, KHADZHIEV S N. Catalytic chemistry of dimethyl ether (review)[J].
Pet Chem, 2017, 57(5): 353-373.
DOI: 10.1134/S0965544117050139. |
| [14] |
GAO T, FJELLVÅG H, NORBY P. A comparison study on Raman scattering properties of α-and β-MnO2[J].
Anal Chim Acta, 2009, 648(2): 235-239.
DOI: 10.1016/j.aca.2009.06.059. |
| [15] |
VILLEGAS J C, GARCES L J, GOMEZ S, et al. Particle size control of cryptomelane nanomaterials by use of H2O2 in acidic conditions
[J].
Chem Mater, 2005, 17(7): 1910-1918.
DOI: 10.1021/cm048391u. |
| [16] |
SUN M, LAN B, LIN T, et al. Controlled synthesis of nanostructured manganese oxide: crystalline evolution and catalytic activities[J].
CrystEngComm, 2013, 15(35): 7010-7018.
DOI: 10.1039/c3ce40603b. |
| [17] |
WANG J, LI J, ZHANG P, et al. Understanding the " seesaw effect” of interlayered K+ with different structure in manganese oxides for the enhanced formaldehyde oxidation
[J].
Appl Catal, B, 2018, 224: 863-870.
DOI: 10.1016/j.apcatb.2017.11.019. |
 2018, Vol. 35
2018, Vol. 35

