2. 华南师范大学 分析测试中心,广东 广州 510006
2. Analysis and Testing Center, South China Normal University, Guangzhou 510006, China
微生物燃料电池(MFCs)作为一种新型绿色能源技术,可以利用细菌氧化分解有机污染物,实现污水处理和产能双重目标,为我们面临的环境和能源问题提供了理想的解决方案[1-3]. 这项绿色技术已经引起了国内外许多研究学者的关注. 然而,MFCs的产电效率低限制了其实际应用. 低性能的阳极材料和高成本的构建是MFCs大规模实际应用的两个主要障碍[4-5].
在MFCs中,阳极是细菌生长的载体,并且可以传输有机污染物分解产生的电子,对MFCs的性能具有决定性的影响. MFCs性能低下的主要原因可能是由于阳极上的细菌负载量不足[6]. 因此,理想的阳极材料应具有良好的导电性,生物相容性,高表面积,无腐蚀性和廉价等特点[7]. 碳基材料,如碳毡、碳纸、碳布是目前最常用的商业阳极材料,然而它们的表面相对光滑不利于产电细菌的附着,EET的效率较低[8-12],所以限制了它们的性能. 为了提高MFCs的性能,研究者们对这些碳基材料进行了各种修饰或改性,其中包括对导电材料[13-15]、碳纳米管(CNTs)[16-17]和贵金属[18]或碳基材料的表面处理[19-20]进行了广泛的研究. 尽管这些改性可以大大提高MFCs的性能,但是对于MFCs的实际应用而言,这些修饰或改性的成本过高. 因此,开发高性能、低成本的阳极材料对实现MFCs的实际应用至关重要.
通常用于纺织物的棉花是一种低成本的天然产品,它主要是由纤维素构成的[21]. 通过简单的碳化处理,就可以将棉纤维直接转化为碳化棉纤维,还将保留纺织物的机械性能和结构相容性,并产生高导电性的碳化纤维[22-24]. 因此,由于它们良好的柔韧性和多孔性,棉基材料作为电极材料已经引起了研究者们广泛的关注[25]. 通常,废棉纺织物被作为垃圾处理,其回收率很低,造成了严重的资源浪费和环境污染. 如果这些废旧棉纺织物能够有效回收利用,既节约资源,又能减少环境污染问题.
本文首次采用生活中常见的廉价废旧棉纺织物为原料,通过简单的碳化处理,成功地制备出一种新颖的生物兼容的,高导电的,多孔的,低成本的柔性电极,碳化棉织物电极(CCTs)作为微生物燃料电池的阳极材料. 采用FESEM,XRD,Raman,XPS和BET等表征手段对新型阳极材料进行了物理和形貌表征. 通过计时电流法(CA),循环伏安法(CV)和电化学阻抗谱(EIS)评估了其电化学性能. 并且将基于CCT阳极的单室MFC性能与基于商业碳毡阳极(Carbon felt,CF)的单室MFC性能进行了对比.
1 实验部分 1.1 电极材料的制备以常用废棉纺物为原料,经过简单的超声波清洗,干燥,碳化处理,制备出高导电的,多孔的碳化棉织物电极(CCTs). 先后用1 mol·L–1 NaOH和1 mol·L–1 HCl溶液超声波清洗废棉织物,然后在60 ℃下,将所清洗的废棉纺织物干燥24 h,最后在800~1 000 ℃下,将干燥的废棉纺织物在Ar气下碳化1 h. 待室温取出,并裁剪成2.0 cm×2.0 cm的大小. 分别将不同碳化温度的样品标记为CCT-800,CCT-900,CCT-1000.
1.2 电极材料的表征使用FESEM(ZESISS ULTRA 55)观察电极和生物膜的形貌,用于SEM表征的生物膜样品是根据文献[26]的方法制备. 元素分析是在能量色散X射线光谱仪(EDS, Oxford INCA Energy TEM 250)上进行的. 在ESCALAB 250(Thermo Fisher Scientific)上,使用单色AlKα辐射(1 486.6 eV)进行X射线光电子能谱(XPS)测试. 在D8 Advance X射线衍射仪上,用CuKα辐射(λ=1.540 5 nm)从10°~80°获得XRD图谱. 通过使用共焦显微镜拉曼光谱仪(Lab RAM Aramis)分析阳极碳材料的特性. 使用傅里叶变换红外光谱仪(FTIR, BRUKERTENSOR 27)分析材料的化学键. 在四探针电导率测量装置(RST-8)上记录电阻率分析. 通过Brunauer-Emmett-Teller(BET)方法计算电极材料的比表面积. 用孔隙率分析仪(Micromeritics, ASAP 2020)表征孔尺寸分布,并根据Barrett-Joyner-Halenda(BJH)吸附模型进行分析.
1.3 MFC构建如文献[27]所报道,构建体积为28 mL的有机玻璃材质的空气阴极圆柱形MFC. CCTs作为阳极(2.0 cm×2.0 cm×0.1 cm),并用钛丝连接. 为了启动MFCs实验,如先前文献[7]所述,在反应器中接种5.0 mL活化的厌氧污泥和23 mL含有乙酸钠(1 g·L–1)的培养基溶液. 培养基溶液包含了50 mM磷酸盐缓冲液(pH 7.0),维生素溶液(12.5 mL·L–1)和矿物质溶液(12.5 mL·L–1). 用1 000 Ω的外部电阻连接阳极和阴极,置于30 ℃的恒温箱中,培养一段时间. 采用数据釆集器,对阳极的输出电压进行实时监控. 通过改变MFC中的外部电阻从8 000 Ω~100 Ω来测量MFC的极化曲线. 功率密度P(W·m–2)计算公式如下:
| $\begin{array}{l}P={U^2}/RA.\end{array}$ |
其中,U (V),R(Ω)是输出电压以及该电压下的外阻,A为电极投影面积. 功率密度通过阳极的投影表面积(4.0 cm2)作为标准进行计算.
1.4 电化学测试采用三电极体系,在Solartron 1480 (Solartron Analytic)工作站上进行电化学测试:以MFC阳极CCT-1000作为工作电极,饱和甘汞电极 (SCE)作为参比电极,空气阴极作为对电极. 计时电流法(CA)在0.2 V(vs. SCE)下进行. 循环伏安(CV)在–0.6 V至0.3 V(vs.SCE)下进行,扫描速度为10 mV·s–1. 交流阻抗(EIS)是在开路电压下进行,频率范围为105~10–2 Hz,幅度为5 mV.
2 实验结果与讨论 2.1 CCTs电极的形貌表征利用扫描电子显微镜镜(FESEM)对CT和CCTs的形貌进行表征,以观察电极材料的表面形貌. 如图1(a)~(c)所示,CT主要由交织卷曲的纤维素条组成的,直径大概在5~10 μm之间. 通过简单的碳化处理之后,从图1(d)~(l) 中可以清楚地看出,随着碳化温度的升高,CCTs交织的纤维条变得更加纤细,而且表面越来越粗糙. CCTs粗糙的表面增加了用于细菌粘附的比表面积,同时也可能使细菌与阳极之间的相互作用更强,大大增加了细菌的负载量,从而使电子转移更快. 值得注意的是,仅仅在CCT-1000电极表面观察到了许多微小的孔洞,见图1(l),这可能更有利于细菌粘附和细菌胞外电子的传递.

|
图 1 CT (a, b, c)、CCT-800 (d, e, f)、CCT-900 (g, h, i)、CCT-1000 (j, k, l)在不同倍数下的SEM图 Figure 1 SEM images of CT (a, b, c), CCT-800 (d, e, f), CCT-900 (g, h, i), CCT-1000 (j, k, l) at various magnifications |
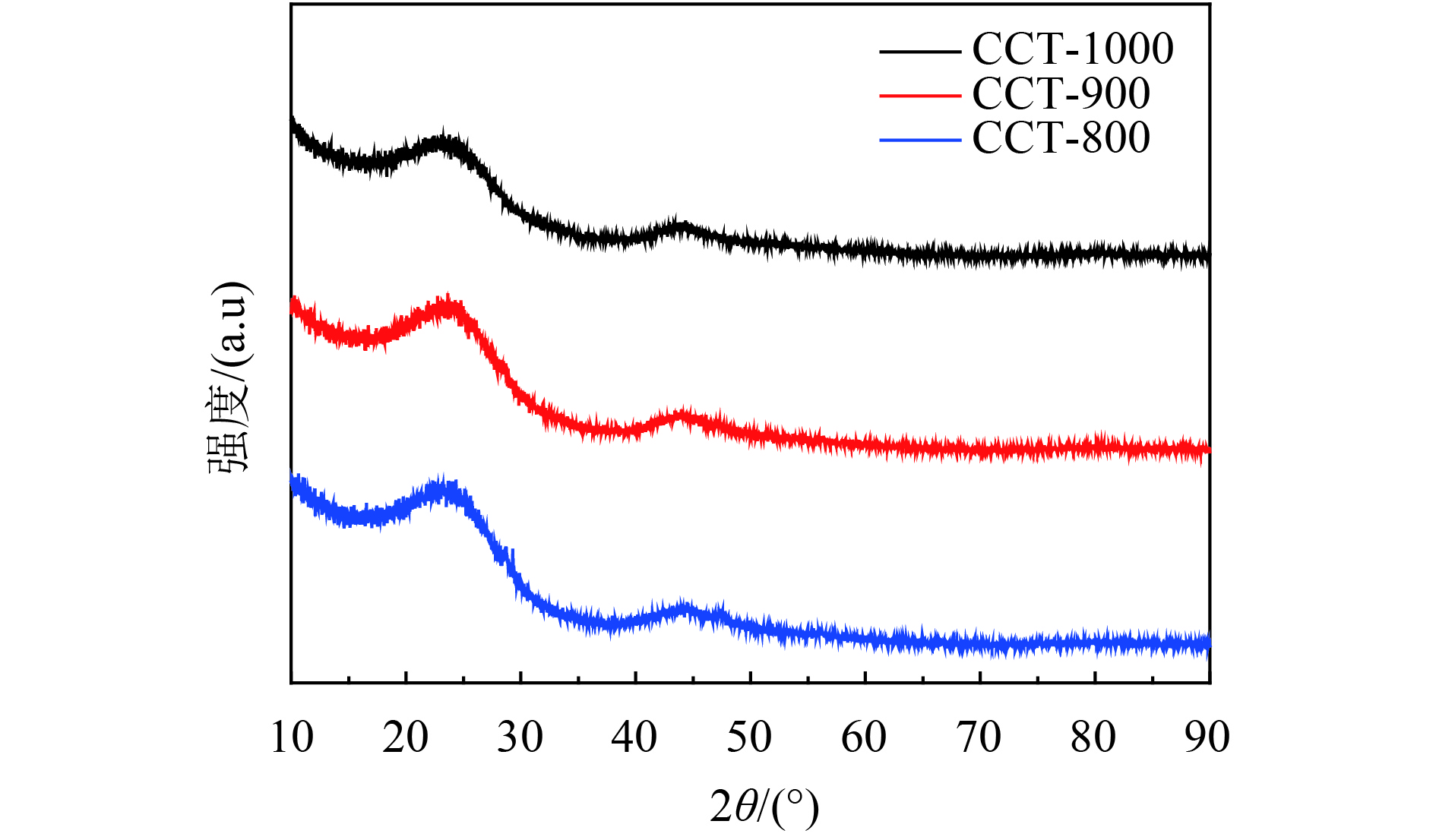
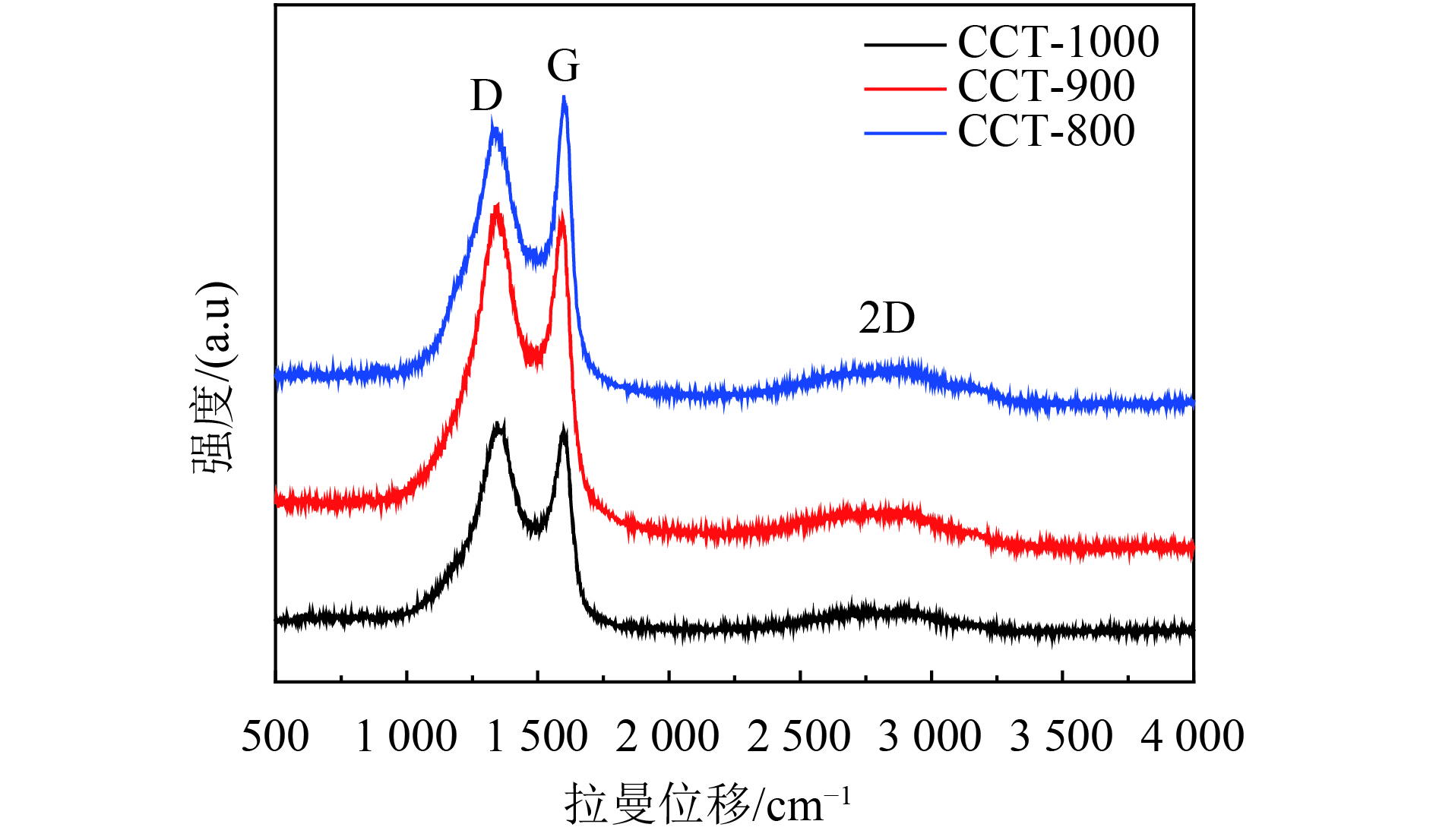
利用XRD对阳极材料的组成进行定性的分析. 结果如图2所示,所有的XRD图谱中,在2θ=22.51°处呈现相对尖锐的衍射峰,表明CCTs部分石墨的特征. 另外从图中可以看出,不同碳化温度的CCTs,其XRD图曲线相似. 为了分析不同温度处理的CCTs的特性,对样品进行了Raman的测试. 在CCTs的Raman光谱图中(图3),在1 360 cm–1和1 600 cm–1处显示了两个主峰,分别对应于D带和G带. 先前文献报道,D带与碳材料一系列结构缺陷相关[28],而G带与sp2C原子的平面内键合伸缩运动相关[29]. 另外,随着碳化温度的增加,CCT的ID/IG也增加. CCT-1000的D谱带的强度略高于G谱带的强度,这意味着在CCT-1000中出现了更多的无序石墨相[7, 30].
|
图 2 X射线衍射图 Figure 2 X-ray diffraction patterns |
|
图 3 拉曼光谱图 Figure 3 Raman spectra |
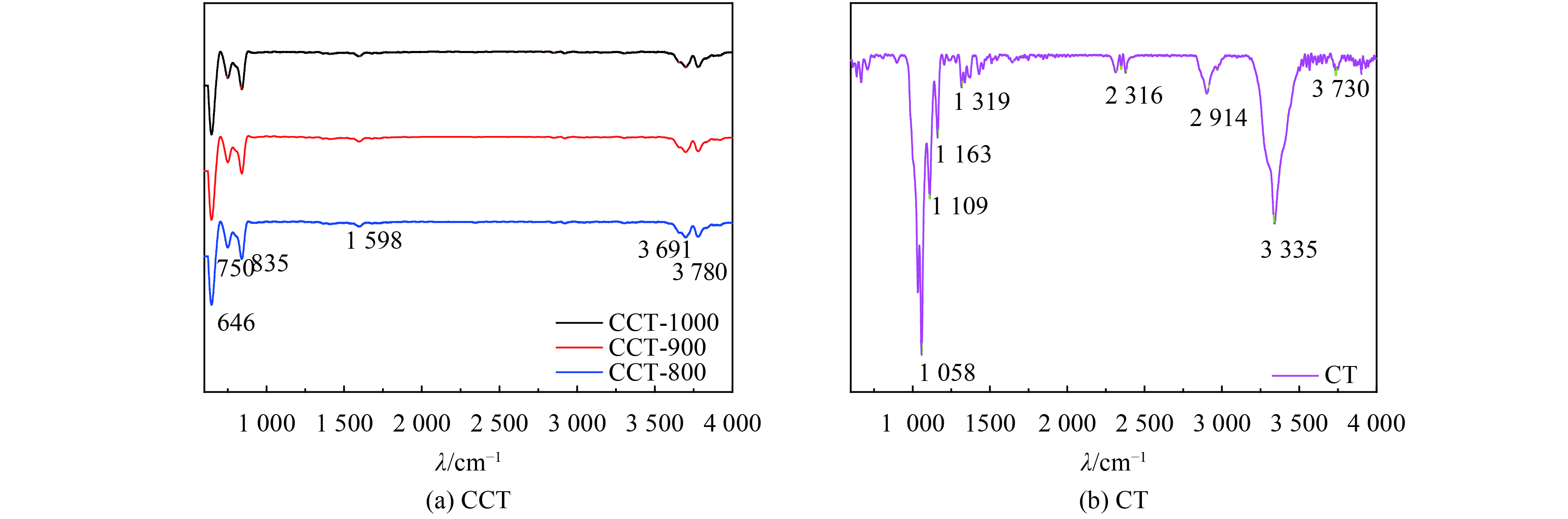
采用FTIR来确认CT和CCTs的化学成分. 如图4(b)所示,在CT的红外光谱图中,3 730 cm–1和3 334 cm–1处的宽峰可能归属于O-H的伸缩振动[31],而2 915 cm–1处的峰则归因于C-H的对称伸缩振动[32]. 在1 163 cm–1和1 319 cm–1处的峰对应于C-O的伸缩振动[23, 28]. 在1 109 cm–1和1 058 cm–1处的峰归因于C-O的振动[28]. 与CT的红外谱图相比,O-H的伸缩振动仍保留在的CCTs谱图中(图4(a)),对应于3 780 cm–1和3 699 cm–1附近的峰. 在1 598 cm–1处的峰值是由于C=C的振动. 835 cm–1和744 cm–1处的峰值归因于C-H的弯曲振动. CCTs谱图中增加了C=C和C-H振动,可能是由于碳化处理的结果.
|
图 4 CCTs及CT的傅立叶变换红外光谱图 Figure 4 Fourier transform infrared spectroscopy spectra of CCTs and CT |
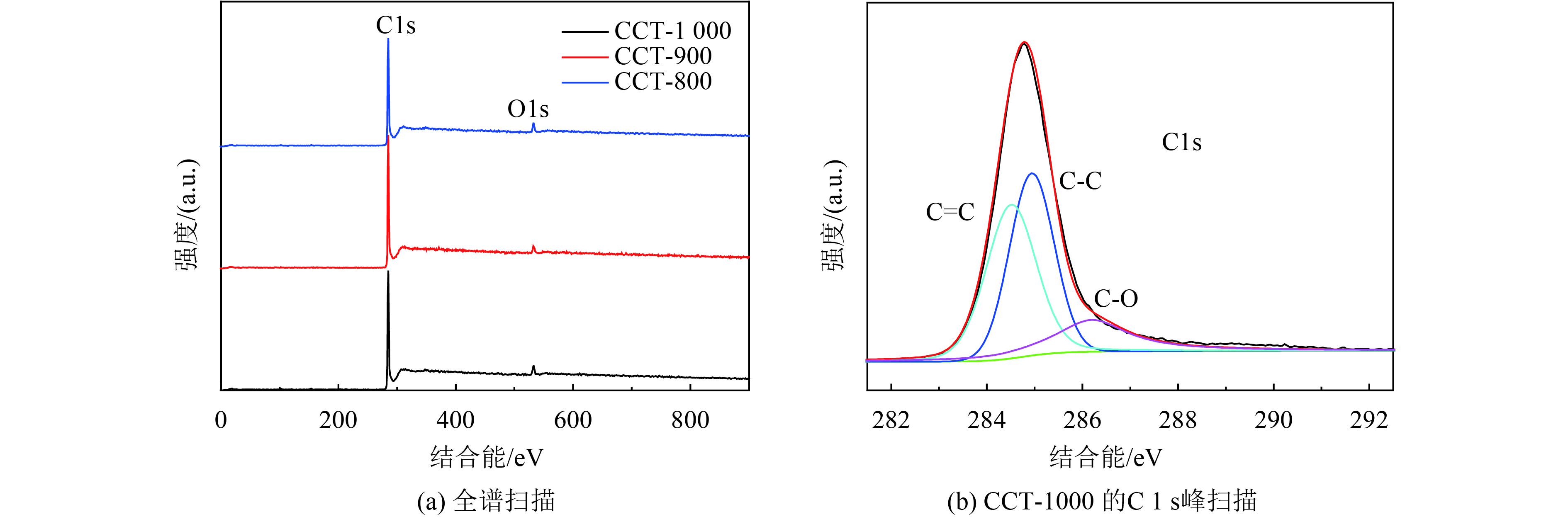
利用能量色散X射线光谱(EDS)对CCTs的元素成分进行分析,结果如表1所示. 根据EDS结果,CT主要含有C和O两种元素,以及少量的Ca,Si,S元素. 与碳化处理之后的材料相比,未处理CT与CCTs的元素组成是相似的. 从表中可以发现,仅仅是在含量百分比上的变化,CCTs主要含有C和极少含量的其他元素,意味着碳化处理后纤维素几乎完全被碳化. 最重要的是,在下面的MFCs实验中,所有元素都不会对细菌的生长产生有害的影响. 此外,为了进一步确认材料的元素组成,还对材料进行了X射线光电子能谱(XPS)的表征组成. 如图5所示,XPS结果与EDS分析结果一致. 在图5(a)所示的全XPS谱中,在CCTs中,仅仅C和O两种被检测到. 另外,CCT-1000的C1s谱图中(图5(b)),在284.5、284.9和286.2 eV处有3个峰,分别对应为C=C、C-C和C-O,也与FTIR分析结果一致.
| 表 1 不同碳化温度处理的CCTs的表面化学组成 Table 1 Surface chemical composition of resulted materials |
|
图 5 CCTs表面的XPS分析结果 Figure 5 X-ray photoelectron spectroscopy (XPS) survey |
电阻率对于电极材料是非常重要的. 通过四探针电导率仪来测量材料的导电性,测量结果如表2所示. 从表2中可以得知,CCT-1000的电阻率最低,为7.56 Ω·sq–1,略高于商用RVC[33],这足以满足电极材料的要求. 另外,很容易发现,随着碳化温度的升高,CCTs的电阻率越来越小,CCTs的电导率越来越好. 主要原因可能是由于碳化温度越较高,导致石墨化程度越高,导电性越好. 这结果也表明,1 000 ℃是使材料达到高电导率的最合适温度.
| 表 2 不同碳化温度处理的CCTs的导电性对比 Table 2 The electrical resistivity of different temperature processing of CCTs |
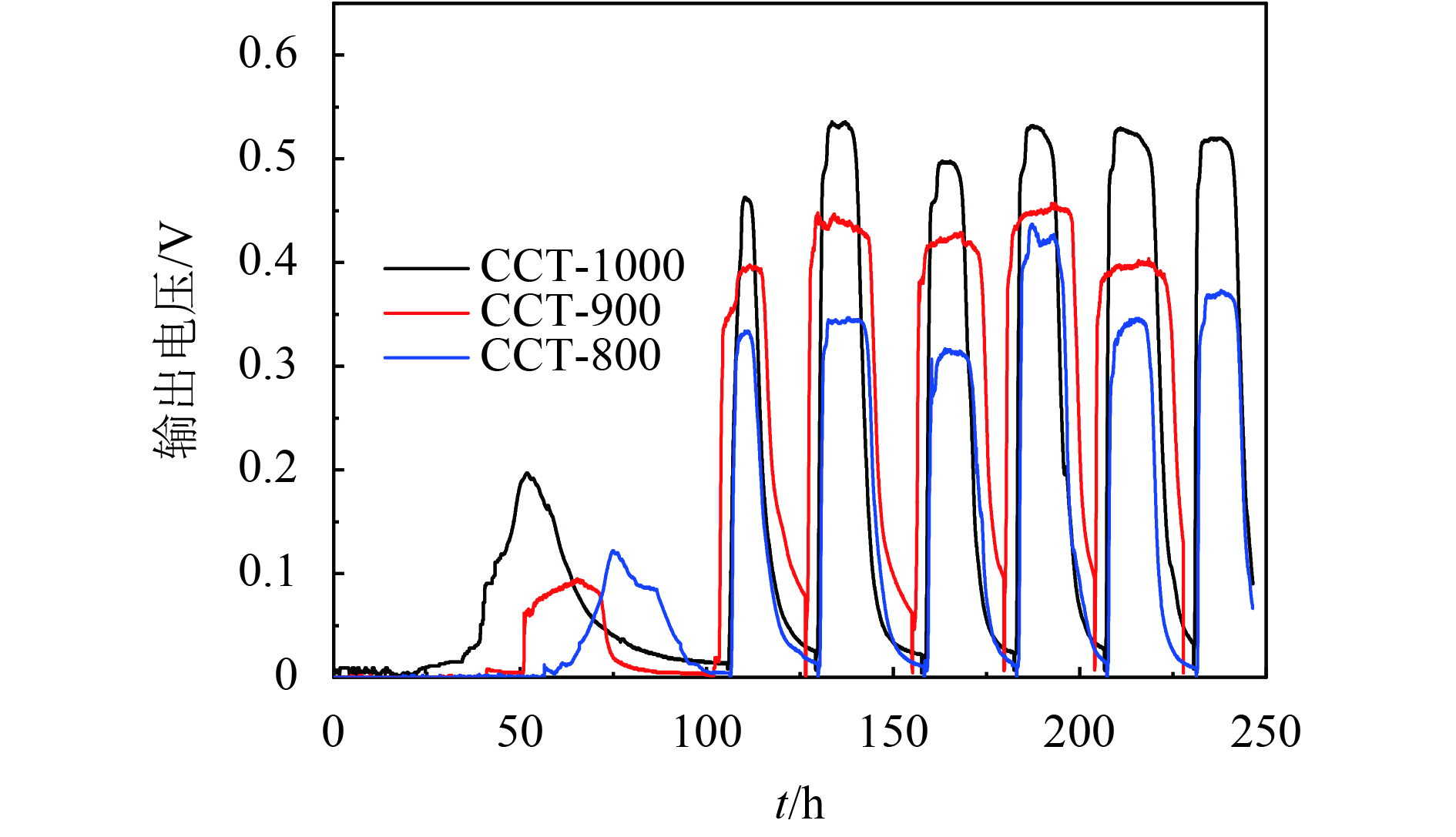
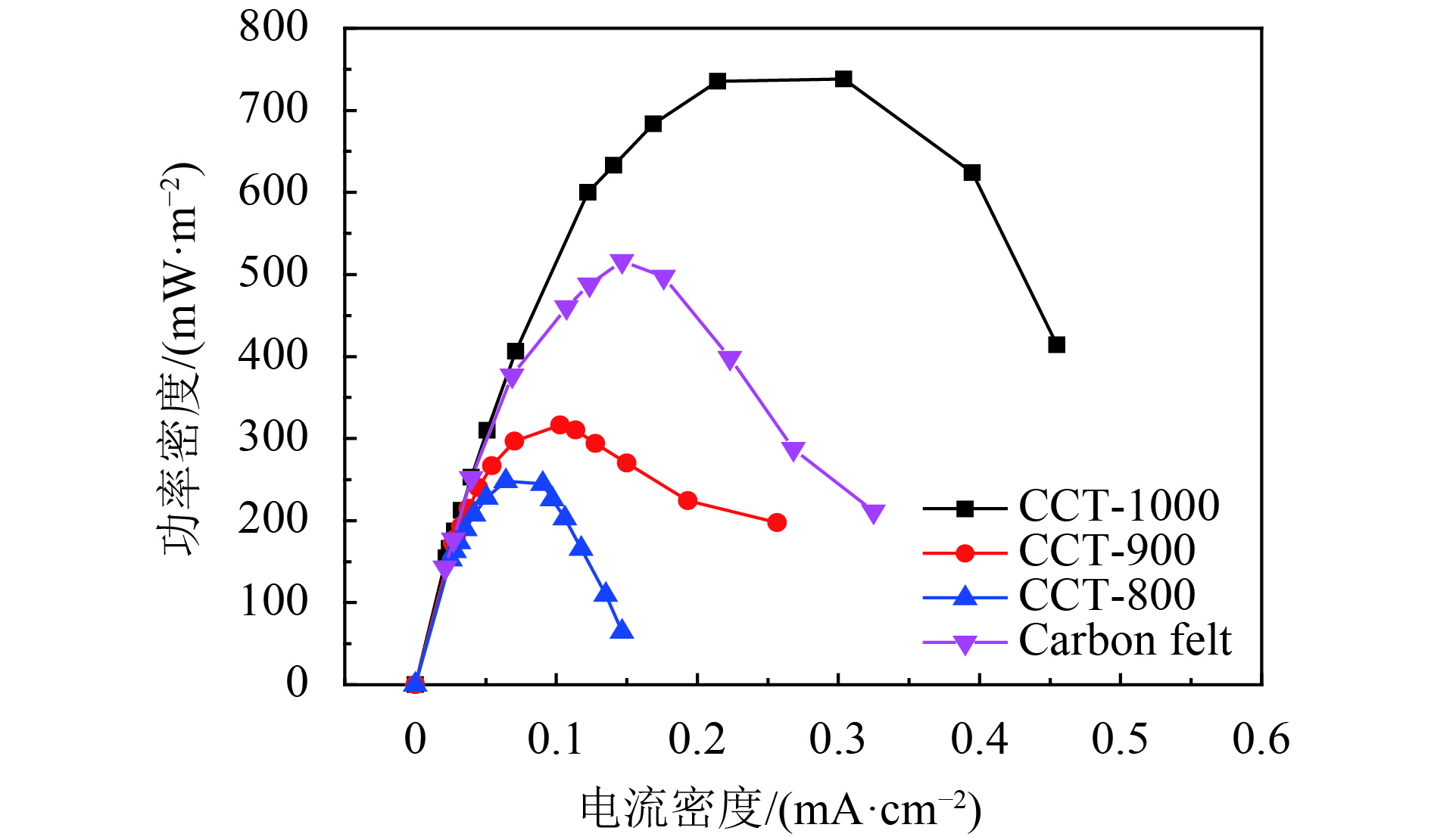
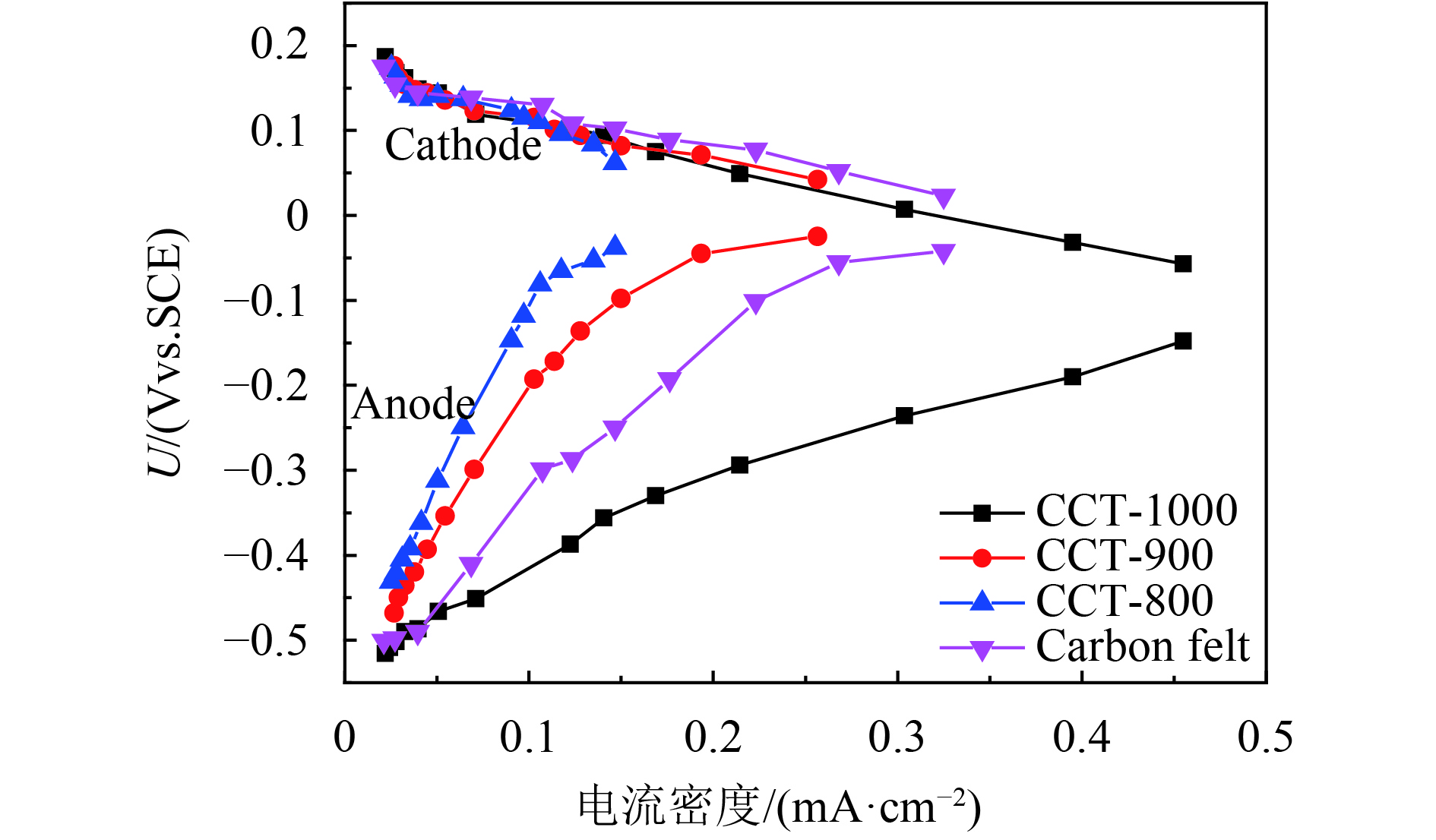
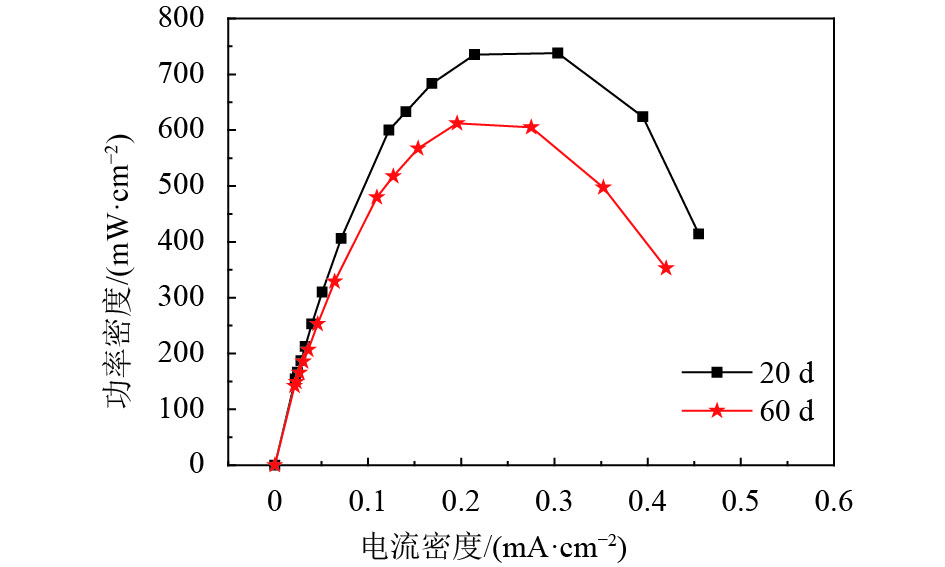
以不同碳化温度处理的CCTs作为MFCs阳极,用活化的厌氧污泥接种,乙酸作为电子供体,在外阻为1 000 Ω的条件下培养,经过3个循环周期,MFC的输出电压增加到0.3 V以上,这意味着MFC已成功启动[7, 34]. 如图6所示,经过140多个小时的培养之后,所有MFCs的输出电压达到330~520 mV. 显然,基于CCT-1000阳极的MFC输出电压为520±10 mV,明显高于CCT-900(430±20 mV),CCT-800(330±30 mV)等阳极. 重复几个周期之后,通过极化曲线来进一步估算MFCs的性能. 如图7所示,基于CCT-1000阳极的MFC的最大功率密度最大,达到了738±20 mW·m–2,这也略大于在同样条件下的LSC阳极(701±44 mW·m–2)[7]. 此外,阴阳极电势的测试结果(图8)表明,各个MFC的阴极电势基本是相同的. 这说明了阳极电势的高低直接影响了MFC的输出电压,从而影响了输出功率密度. MFC长期运行的结果表明,在外阻为1 000 Ω下,经过2个月的长期运行,基于CCT-1000阳极的MFC输出功率仅下降17%,说明了CCT-1000阳极具有良好的稳定性(图9). 而功率输出的小幅下降被认为是阴极生物污染的结果[35-37].
|
图 6 外接1 000 Ω电阻MFC启动过程输出电压随时间关系图 Figure 6 Voltage output versus time during strut-up of the MFCs with various anodes with 1 000 Ω resistance loading |
|
图 7 功率密度曲线 Figure 7 Polarization curves of the MFCs with different anodes |
|
图 8 阴阳极电势 Figure 8 Individual potential of electrodes in the MFCs |
|
图 9 基于CCT-1000电极的MFC在不同时期的功率密度曲线 Figure 9 Power densities of the MFC with CCT-1000 anode during long-term operation at different time |
大量的研究表明,具有较大比表面积的电极可吸附更大量的细菌在其表面生长,因此可以收集更多的胞外电子,从而提高MFC的功率密度[7, 38]. 图10(a)所示的CCT-1000的氮吸附等温线表明等温曲线在P/P0=0.4~0.9时急剧增加,表明电极材料是多孔的[39]. CCT-1000样品的BET比表面积为209.64 m2·g–1,远远大于商业碳毡的比表面积(67 m2·g–1)[7]. 如图10(b)所示,Barrett-Joyner-Halenda (BJH)的孔径分布范围为3~4.5 nm. 结果表明CCT-1000具有较大的BET比表面积用于细菌的粘附和生长,因此大大增加了细菌的负载量.
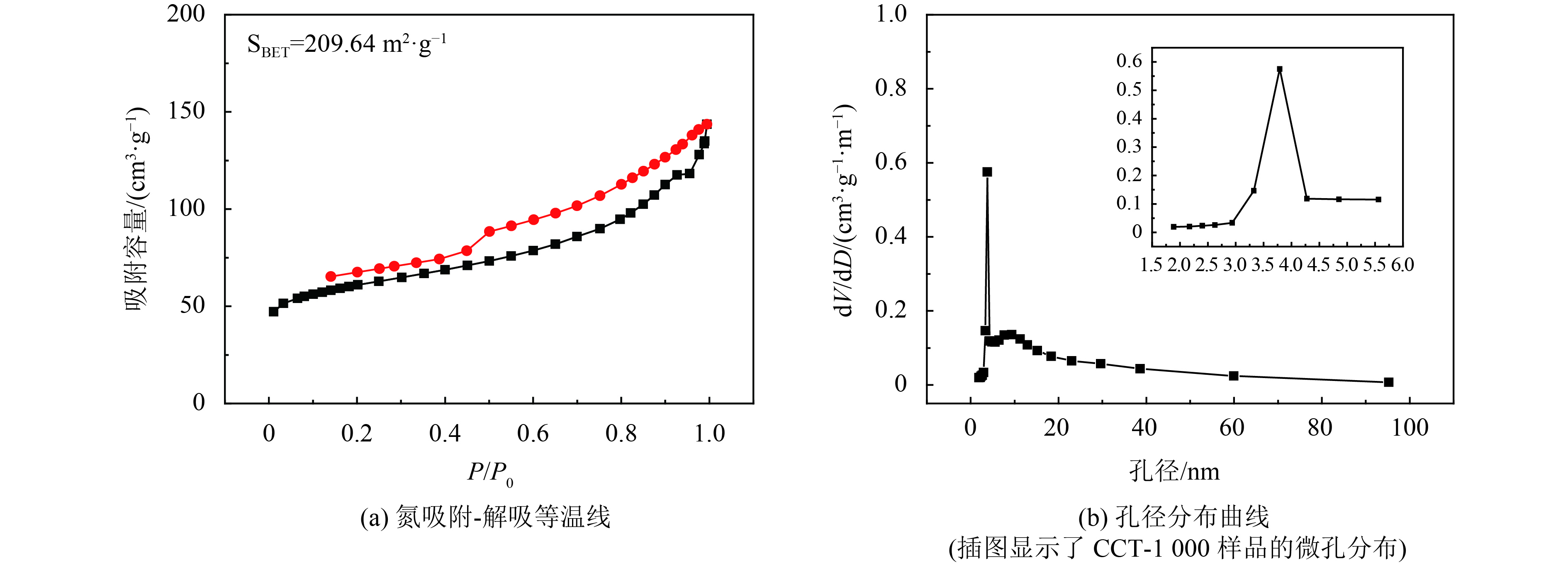
|
图 10 CCT-1000样品的氮吸附-解吸等温线和相应的孔径分布曲线 Figure 10 Nitrogen adsorption-desorption isotherms and the corresponding pore-size distribution curve of the prepared CCT-1000 sample |
在0.2 V电位下,CCT-1000阳极经过5个周期的培养测试后,得到的电流-时间曲线. 电流-时间曲线如图11所示. CCT-1000阳极产生的最大电流密度超过5.0 A·m–2,比碳毡的最大电流密度要大,这表明CCT-1000阳极的电子转移效率比碳毡阳极要高. 这可能是由于它具有较高的电导率和较大的比表面积. CP是为了进一步说明CCT-1000阳极的电化学性能. 已有文献报道电极的电极电位平台越低,电极的电化学性能越好[40]. CCT-1000的电极电位比碳毡的电极电位要低很多,如图12所示,这也可能是因为它具有较高的电导率和较大的BET表面积.
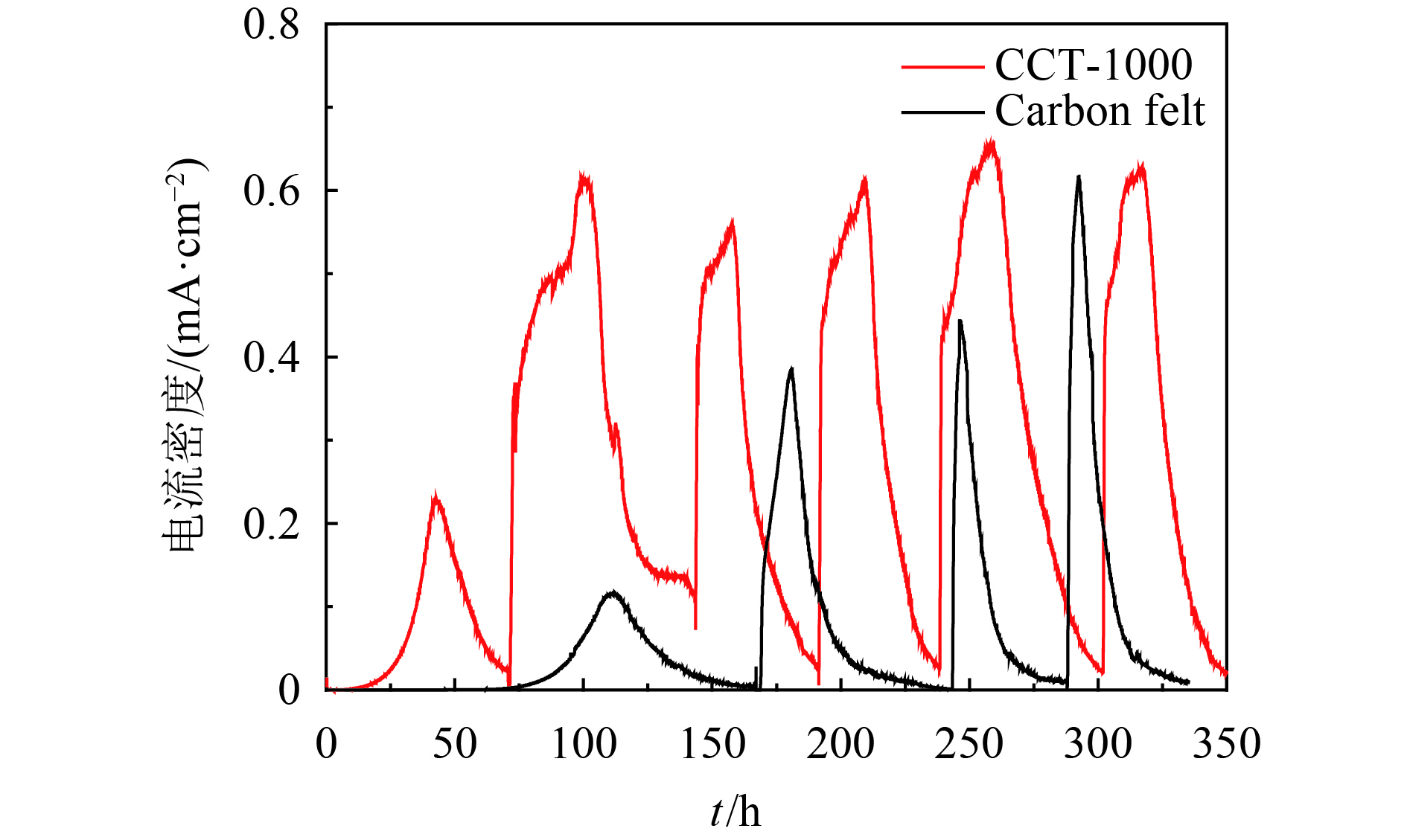
|
图 11 在0.2 V(vs. SCE)下,CCT-1000电极的电流与时间的关系图 Figure 11 Bioelectrocatalytic current generation at the CCT-1000 electrode poised at 0.2 V vs. SCE |
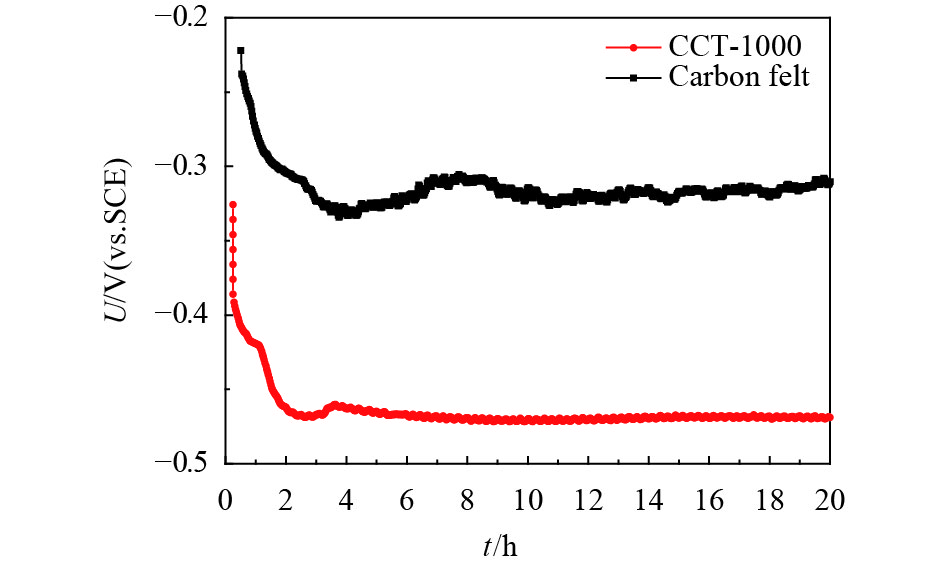
|
图 12 在0.1 μA的恒定电流下电极的电位响应 Figure 12 Potential responses of the electrodes under a constant current of 0.1 μA (B) |
运行两个月后,为了进一步确认阳极性能,采用SEM对CCT-1000上的生物膜的形态进行了观察(图13). 从图13可见. 经过2个月的运行之后,大部分CCT-1000阳极表面被厚厚微生物膜覆盖(图13(a)),纤维的外部和内部的周围都被细菌紧紧地包裹(图13(b)),但并没有引起生物膜堵塞孔隙的现象,杆状细菌通过纳米线相互连接(图13(c)),与阳极表面的紧密连接有助于形成稳定的生物膜[41]. 正是由于稳定的生物膜,基于CCT-1000阳极的MFC才能够长期稳定地操作. 根据以上讨论,图14(a)给出了电极的制备示意图,经过1 000℃的碳化处理,使得CCT-1000电极的表面更加粗糙,产生许多微孔. 粗糙的表面非常有利于细菌的粘附(图14(b)),从而加快了与电极之间电子交换速率(图14(c)),最终提高了MFCs性能.

|
图 13 生物膜在CCT-1000阳极上不同分辨率的SEM图 Figure 13 SEM images of the electroactive biofilm grown on the CCT-1000 anode after 2 months of operation |
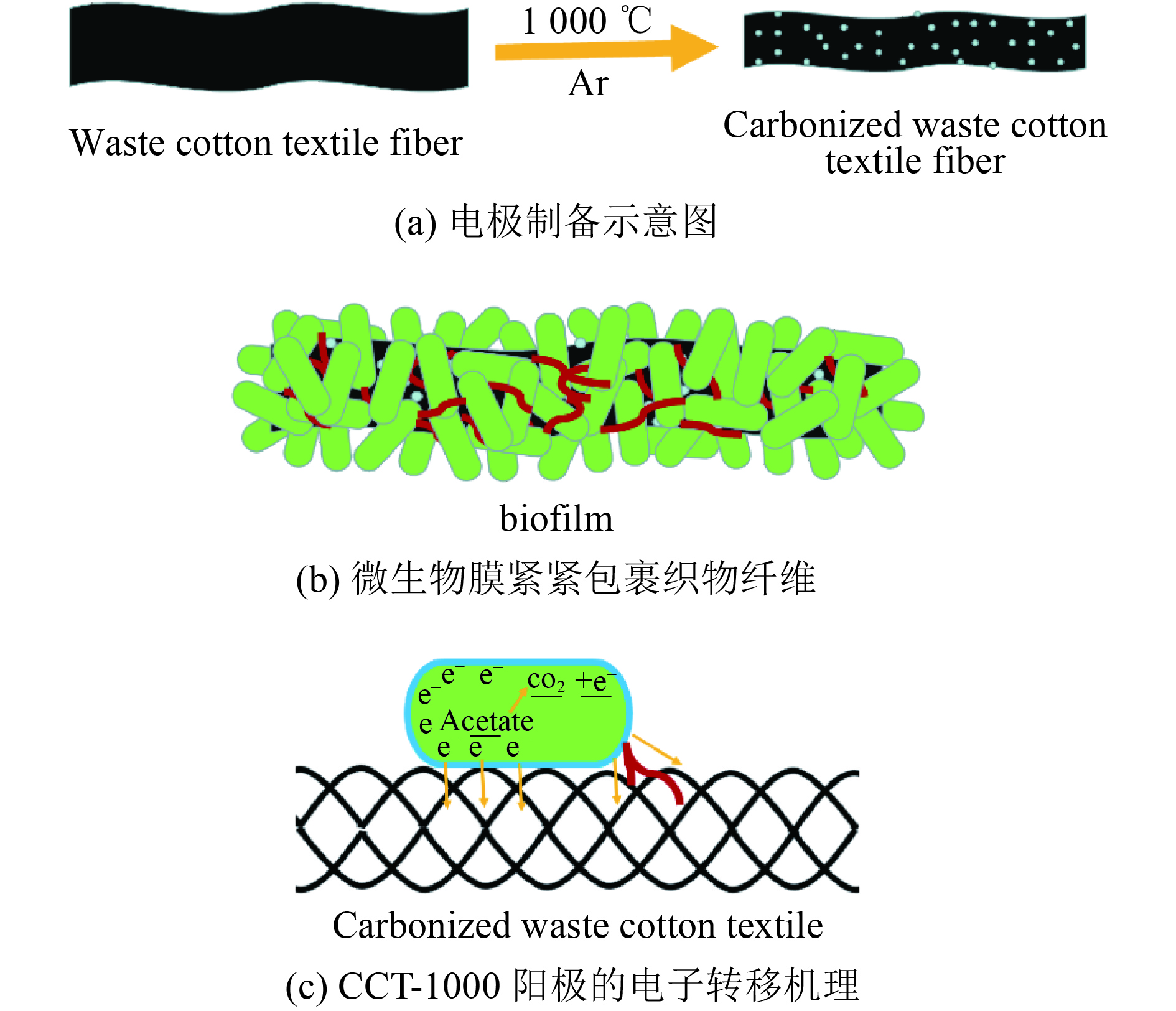
|
图 14 CCT-1000电极制备及电子转移机理示意图 Figure 14 Schematic and electron-transfer mechanism of CCT-1000 electrode |
本文使用废棉纺织物作为原料,通过简单的碳化处理制备了一种生物相容的、多孔的、高导电性和低成本的高性能的MFC阳极——碳化棉织物电极(CCTs). 结果表明,生物相容性的、多孔的CCT-1000电极具有较低的电阻率和较大的用于细菌粘附生长的比表面积,这大大增加了细菌的负载量,并且促进了细菌胞外电子传递速率,从而提高了MFCs的性能. 而且充分利用廉价的电极和无膜装置大大降低了MFCs的成本. 此外,直接碳化废棉纺织物为碳材料的制备提供了一种低成本,可持续的方式. 同时,这些废棉纺织物可以回收利用,既节约了资源,又减少了环境污染问题.
| [1] | ZENG L Z, ZHAO S F, WANG Y Q, et al. Ni/β-Mo2C as noble-metal-free anodic electrocatalyst for microbial fuel cell based on Klebsiella pneumonia [J]. International Journal of Hydrogen Energy, 2012, 37(5): 4590-4596. DOI: 10.1016/j.ijhydene.2011.05.174. |
| [2] | CUI D, WANG Y Q, XING L D, et al. Which determines power generation of microbial fuel cell based on carbon anode, surface morphology or oxygen-containing group[J]. International Journal of Hydrogen Energy, 2014, 39(27): 15081-15087. DOI: 10.1016/j.ijhydene.2014.07.095. |
| [3] | MEHDINIA A, ZIAEI E, JABBARI A. Facile microwave-assisted synthesized reduced frapheneoxide/tin oxidenano composite and using as anode material of microbial fuel cell to improve power generation[J]. International Journal of Hydrogen Energy, 2014, 39(20): 10724-10730. DOI: 10.1016/j.ijhydene.2014.05.008. |
| [4] | XIE X, YU G, LIU N, et al. Graphene-sponges as high-performance low-cost anodes for microbial fuel cells[J]. Energy & Environmental Science, 2012, 5(5): 6862-6866. |
| [5] | YANG Y, LIU T Y, LIAO Q, et al. A three-dimensional nitrogen-doped graphene aerogel-activated carbon composite catalyst that enables low-cost microfluidic microbial fuel cells with superior performance[J]. Journal of Materials Chemistry A, 2016, 4: 15913-15919. DOI: 10.1039/C6TA05002F. |
| [6] | FAN Y, SHARBROUGH E, LIU H. Quantification of the internal resistance distribution of microbial fuel cells[J]. Environmental Science & Technology, 2008, 42(21): 8101-8107. |
| [7] | YUAN Y, ZHOU SG, LIU Y, et al. Nanostructured macroporous bioanode based on polyaniline-modified natural loofah sponge for high-performance microbial fuel cells[J]. Environmental Science & Technology, 2013, 47(24): 14525-14532. |
| [8] | CHAUDHURI S K, LOVLEY D R. Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells[J]. Nature Biotechnology, 2003, 21(10): 1229-1232. DOI: 10.1038/nbt867. |
| [9] | LOGAN B, CHENG S, WATSON V, et al. Graphite fiber brush anodes for increased power production in air-cathode microbial fuel cells[J]. Environmental Science & Technology, 2007, 41(9): 3341-3346. |
| [10] | TENDER L M, REIMERS C E, STECHER H A, et al. Harnessing microbially generated power on the seafloor[J]. Nature Biotechnology, 2002, 20(8): 821-825. DOI: 10.1038/nbt716. |
| [11] | HE Z, MINTEER S D, ANGENENT L T. Electricity generation from artificial wastewater using an upflow microbial fuel cell[J]. Environmental Science & Technology, 2005, 39(14): 5262-5267. |
| [12] | CHENG S, LIU H, LOGAN B E. Increased power generation in a continuousflow MFC with advective flow through the porous anode and reduced electrode spacing[J]. Environmental Science & Technology, 2006, 40(7): 2426-2432. |
| [13] | ADACHI M, YAMAMOTO R, SHIMOMURA T, et al. Microbial fuel cells witha mediator-polymer modified anode[J]. Electrochemistry, 2010, 78(10): 814-816. DOI: 10.5796/electrochemistry.78.814. |
| [14] | FENG C, MA L, LI F, et al. A polypyrrole/anthraquinone-2, 6-disulphonic disodium salt (PPy/AQDS)-modified anode to improve performance of microbial fuel cells[J]. Biosensors and Bioelectronics, 2010, 25(6): 1516-1520. DOI: 10.1016/j.bios.2009.10.009. |
| [15] | LAI B, TANG X, LI H, et al. Power production enhancement with a polyaniline modified anode in microbial fuel cells[J]. Biosensors and Bioelectronics, 2011, 28(1): 373-377. DOI: 10.1016/j.bios.2011.07.050. |
| [16] | TSAI H Y, WU C C, LEE C Y, et al. Microbial fuel cell performance of multiwall carbon nanotubes on carbon cloth as electrodes[J]. Journal of Power Sources, 2009, 194(1): 199-205. DOI: 10.1016/j.jpowsour.2009.05.018. |
| [17] | SUN J J, ZHAO H Z, YANG Q Z, et al. A novel layer-by-layer self-assembled carbon nanotube-based anode: preparation, characterization, and application in microbial fuel cell[J]. Electrochimical Acta, 2010, 55(9): 3041-3047. DOI: 10.1016/j.electacta.2009.12.103. |
| [18] | SUN M, ZHANG F, TONG Z H, et al. A gold-sputtered carbon paper as an anode for improved electricity generation from a microbial fuel cell inoculated with Shewanella oneidensis MR-1[J]. Biosensors and Bioelectronics, 2010, 26(2): 338-343. DOI: 10.1016/j.bios.2010.08.010. |
| [19] | FENG Y, YANG Q, WANG X, et al. Treatment of carbon fiber brush anodes for improving power generation in air-cathode microbial fuel cells[J]. Journal of Power Sources, 2010, 195(7): 1841-1844. DOI: 10.1016/j.jpowsour.2009.10.030. |
| [20] | WANG X, CHENG S, FANGS Y, et al. Use of carbon mesh anodes and the effect of different pretreatment methods on power production in microbial fuel cells[J]. Environmental Science & Technology, 2009, 43(17): 6870-6874. |
| [21] | AVILA A G, HINESTROZA J P. Smart textiles: tough cotton[J]. Nature Biotechnology, 2008, 3(8): 458-459. |
| [22] | BAO L H, LI X D. Towards textile energy storage from cotton T-shirts[J]. Advanced Materials, 2012, 24(24): 3246-3252. DOI: 10.1002/adma.v24.24. |
| [23] | JUAN Y, QIANG Q K. Preparation of activated carbon by chemical activation under vacuum[J]. Environmental Science & Technology, 2009, 43(9): 3385-3390. |
| [24] | BABEL K, JUREWICZ K. KOH activated carbon fabrics as supercapacitor material[J]. Journal of Physics and Chemistry of Solids, 2004, 65(2-3): 275-280. DOI: 10.1016/j.jpcs.2003.08.023. |
| [25] | HU L B, PASTA M, MANTIA L F, et al. Stretchable, porous, and conductive energy textiles[J]. Nano Letters, 2010, 10(2): 708-714. DOI: 10.1021/nl903949m. |
| [26] | ZHANG L X, ZHOU S G, ZHUANG L, et al. Microbial fuel cell based on Klebsiella pneumoniae biofilm [J]. Electrochemistry Communication, 2008, 10(10): 1641-1643. DOI: 10.1016/j.elecom.2008.08.030. |
| [27] | LOGAN B, CHEN S, WATSON V, et al. Graphite fiber brush anodes for increased power production in air-cathode microbial fuel cells[J]. Environmental Science & Technology, 2007, 41(9): 3341-3346. |
| [28] | LING Z, WANG Z, ZHANG M, et al. Sustainable synthesis and assembly of biomass-derived B/N co-doped carbon nanosheets with ultrahigh aspect ratio for high-performance supercapacitors[J]. Advanced Function Materials, 2016, 26(1): 111-119. DOI: 10.1002/adfm.201504004. |
| [29] | BAG S, MONDAL B, DAS A K, et al. Nitrogen and sulfur dual-doped reduced graphene oxide: synergistic effect of dopants towards oxygen reduction reaction[J]. Electrochemical Acta, 2015, 163(2): 16-23. |
| [30] | ZHOU C F, LIU Z W, DU X S, et al. Hollow nitrogen-containing core/shell fibrous carbon nanomaterials as support to platinum nanocatalysts and their TEM tomography study[J]. Nanoscale Research Letters, 2012, 7(1): 1-11. DOI: 10.1186/1556-276X-7-1. |
| [31] | SHISHMAKOV A B, ERANKIN S V, MIKUSHINA Y V, et al. Activated carbon and carbon-oxide composite materials derived from powdered cellulose[J]. Russian Journal of Applied Chemistry, 2010, 83(2): 307-311. DOI: 10.1134/S1070427210020230. |
| [32] | MARCHESSAULT R H. Application of infrared spectroscopy to cellulose and wood polysaccharides[J]. Pure and Applied Chemistry, 1962, 5(1-2): 107-130. |
| [33] | CHEN S L, LIU Q, HE G H, et al. Reticulated carbon foam derived from a sponge-like natural product as a high-performance anode in microbial fuel cells[J]. Journal of Materials Chemistry, 2012, 22(35): 18609-18613. DOI: 10.1039/c2jm33733a. |
| [34] | XIE X, HU L B, PASTA M, et al. Three-dimensional carbon nanotube-textile anode for high-performance microbial fuel cells[J]. Nano Letters, 2011, 11(1): 291-296. DOI: 10.1021/nl103905t. |
| [35] | SAITO T, ROBERTS T H, LONG T E, et al. Neutral hydrophilic cathode catalyst binders for microbial fuel cells[J]. Energy & Environmental Science, 2011, 4(3): 928-934. |
| [36] | ZHANG F, PANT D, LOGAN B E. Long-term performance of activated carbon air cathodes with different diffusion layer porosities in microbial fuel cells[J]. Biosensors and Bioelectronics, 2011, 30(1): 49-55. |
| [37] | TANG J H, YUAN Y, LIU T, et al. High-capacity carbon-coated titanium dioxide core-shell nanoparticles modified three dimensional anodes for improved energy output in microbial fuel cells[J]. Journal of Power Sources, 2015, 274: 170-176. DOI: 10.1016/j.jpowsour.2014.10.035. |
| [38] | YONG YC, DONG XC, CHAN-PARK MB, et al. Macroporous and monolithic anode based on polyaniline hybridized three-dimensional graphene for high-performance microbial fuel cells[J]. ACS Nano, 2012, 6(3): 2394-2400. DOI: 10.1021/nn204656d. |
| [39] | WEN Z, CI S, MAO S, et al. TiO2 nanoparticles-decorated carbon nanotubes for significantly improved bioelectricity generation in microbial fuel cells [J]. Journal of Power Sources, 2013, 234(21): 100-106. |
| [40] | ZENG L Z, ZHANG W G, XIA P, et al. Porous Ni0.1Mn0.9O1.45 microellipsoids as high-performance anode electrocatalyst for microbial fuel cells [J]. Biosensors and Bioelectronics, 2018, 102: 351-356. DOI: 10.1016/j.bios.2017.11.046. |
| [41] | REGUERA G, POLLINA R B, NICOLL J S, et al. Possible nonconductive role of geobacter sulfurreducens pilus nanowires in biofilm formation[J]. Journal of Bacteriology, 2007, 189(5): 2125-2127. DOI: 10.1128/JB.01284-06. |
 2018, Vol. 35
2018, Vol. 35

