在有机合成反应中,烃类选择性氧化生成相关产物是一个非常重要的反应. 甲苯是最简单的芳香烃化合物,是石油化工的重要原料,同时也是常见的VOCs大气污染物,其选择性氧化可以得到许多有机中间体,比如苯甲醇、苯甲醛、苯甲酸以及苯甲酸苄酯[1]. 目前工业上多采用以锰、钴离子为催化剂的均相催化体系来选择性氧化甲苯[2-3],然而均相反应有着明显的缺点,如反应温度过高(一般超过150 ℃),反应压力过大,多含卤原子作为添加剂,以及催化剂难以回收利用,同时反应结束后的废水也对环境有着相当大的危害[4]. 因此,探索无溶剂、高效、催化剂易回收并且环境友好的反应体系一直是一个巨大的挑战.
相对于均相催化体系,多相催化体系可以很好地克服均相反应体系中存在的一些缺点[5-10]. 在近期研究中,Wang等[11]报道了以固体LDHs为催化剂,分子氧为氧化剂,多相选择性氧化甲苯. 为了获得优异的转化率和选择性,反应在高压反应釜中进行,反应压力高达1 MPa,并且反应温度也达到了150 ℃. 探索出新的甲苯的选择性氧化合成路线不仅需要合理的多相催化体系,较为温和的反应条件也至关重要. 然而相比于高压反应条件,常压转化率通常偏低,如Suib等[12]利用γ-MnO2为催化剂,以流动态的氧气流为氧化剂,偶氮二异丁腈(AIBN)为自由基引发剂,利用回流法在110 ℃条件选择性氧化甲苯,但是甲苯转化率只有17.6%,而苯甲酸的选择性仅为58%. 由于甲苯侧链C—H为sp3杂化,键能高,使得选择性氧化反应需要较高的活化能,所以如何活化甲苯侧链C-H键和选择合适的催化剂也是一项挑战[13-16].
锰氧化物由于其比表面积、化学稳定性、离子交换性、分子级的隧道空间以及多价态同时存在等方面具有优异的性能,被广泛应用于有机催化氧化反应、酰胺化反应以及VOCs催化燃烧等[17]. 锰氧化物对氧化反应有着较高的化学活性,并且价格低廉、毒性低,也是为数不多的被证明能在常压下直接选择性氧化甲苯的催化剂之一[18]. 本课题组郑海龙等[19]采用无模板共沉淀法合成介孔Cu-Mn复合氧化物,在102 ℃温度下,以分子氧为氧化剂,甲苯为溶剂,将苯甲醇选择性氧化合成苯甲醛. 在催化剂用量为500 mg时,甲苯的转化率达到100%,苯甲醛选择性达98.1%. 符志伟等[20]利用溶胶凝胶法合成纳米MnO2,并将其应用于甲苯的催化燃烧,得到催化完全燃烧温度T99为210 ℃. Mizuno等[21]则利用无定形MnO2为催化剂,在0.6MPa空气压力,130 ℃条件下将苯甲胺氧化为苯甲酰胺,最后得出结论无定形MnO2在有机物选择性催化氧化中有着优异的性能.
为了探索一条绿色环保的苯甲酸生产方法,本文以醋酸锰、冰乙酸和高锰酸钾为原料,在不同温度条件下合成锰氧化物,并且以合成的锰氧化物作为催化剂,以TBHP为氧化剂,在无溶剂常压的回流体系下选择性催化氧化甲苯,同时比较不同反应温度合成的催化剂的催化性能. 最后对回流时间,催化剂用量等反应参数进行优化,并且提出了相对应的反应机理.
1 实验部分 1.1 催化剂的制备在室温下,将5.00 g Mn(CH3COO)2·4H2O溶于20 ml去离子水中,然后滴入2.5 ml冰乙酸;将3.25g KMnO4溶于75 ml去离子水中,然后缓慢滴入上述溶液,搅拌30 min. 最终得到的混合液体倒入水热反应釜聚四氟乙烯内胆中,将不锈钢水热反应釜在不同温度下(80 ℃,120 ℃,160 ℃,180 ℃)反应24 h,反应结束后过滤,得到的固体用去离子水和乙醇分别润洗3次,在60 ℃烘箱中隔夜烘干,研磨后得到目标催化剂,分别命名为MnOx-80,MnOx-120,MnOx-160,MnOx-180.
1.2 催化剂表征X射线衍射(XRD)采用德国Bruker公司SAXS Nanostart型X射线衍射仪进行测试,扫描范围为10°-80°,扫描速率为2°·min–1,激发光源为CuKa靶(λ=0.154 06 nm),管电压40 kV,管电流30 mA. 程序升温还原(H2-TPR):取50 mg样品置于样品管中,在Ar(流速20 ml·min–1)气氛下,从室温升至100 ℃,稳定2 h后降至40 ℃,切换气路为5% H2-95% Ar混合气(流速40 ml·min–1)吹扫至基线平稳,然后以10 ℃·min–1速率程序升温至700 ℃,利用TCD检测器记录H2浓度变化得还原曲线. BET测试采用Micromeritics公司的ASAP 2020型物理吸附仪测试分析,样品预先在200 ℃真空条件下预处理3 h,然后在液氮温度(–196 ℃)中进行测试,最后各样品的比表面积采用BET公式计算. 样品的表面形貌分析采用日本电子株式会社的JSM-6360LV型扫描电子显微镜测试,加速电压为5 kV.
1.3 甲苯选择性催化氧化的催化性能评价用甲苯选择性催化氧化实验测试催化剂的活性,将油浴锅加热至80 ℃,待温度稳定后,称取催化剂50 mg、甲苯2.5 ml以及10 ml TBHP加入到50 mL三口烧瓶中,将三口烧瓶浸于油浴锅中,同时搅拌. 待反应6 h后,用1.0 ml一次性注射器抽取1.5 ml样品,并用有机滤头过滤,利用带有FID检测器的气相色谱仪(安捷伦7890A)检测溶液中甲苯、苯甲醇、苯甲醛和苯甲酸的相对浓度.
2 结果与分析 2.1 X射线粉末衍射各锰氧化物的XRD谱图如图1所示,当反应温度为80 ℃时,反应产物具有单一的晶相,对比标准卡片可知得到的晶型是α-MnO2的隐钾锰矿(JCPDS 29-1020),但是从衍射峰峰型来看,得到的产物峰型偏宽,这说明虽然是单一晶相,但是结晶性并不理想,造成这种现象的原因可能是在滴加高锰酸钾溶液时,滴加速度过快造成反应速度加快,使得产物生成速度加快而结晶性稍差[22]. 并且反应温度偏低(80 ℃),相对于晶体在高温高压下的缓慢生长,其在结晶性上稍有不足. 当温度提升至120 ℃时,α-MnO2两个特征峰(12.6°,18.0°)明显开始减弱,反应温度至160 ℃和180 ℃时完全消失不见,并且MnOx-120、MnOx-160、MnOx-180在26.1°处出现一个很强的衍射峰,在33.9°,39.6°以及54.9°附近出现新的微弱的衍射峰,并且随着反应温度的升高,衍射峰信号略有增强且峰型更为尖锐. 根据衍射峰匹配可知,MnOx-120中出现了羟基氧化锰的水锰矿晶型(JCPDS 41-1279),这说明随着反应温度的升高,结晶性趋于完整,并且样品开始由α-MnO2向MnOOH转变,并且最后得到一种混合晶相的锰氧化物.
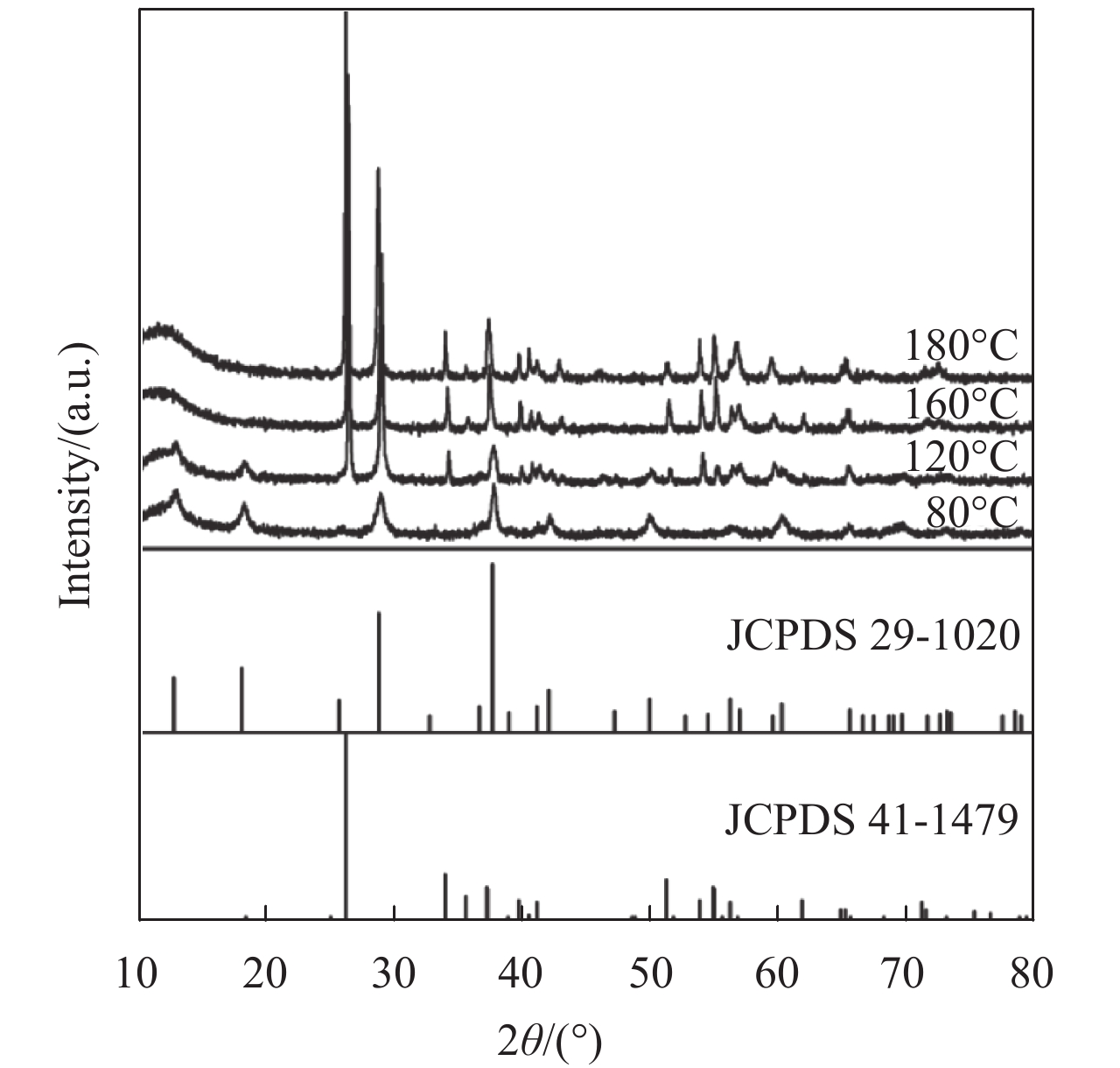
|
图 1 不同反应温度下锰氧化物的XRD图 Figure 1 XRD patterns of manganese oxides at different temperatures |
由表1可得,4种锰氧化物BET大小比较为MnOx-80>MnOx-120>MnOx-160>MnOx-180. 这可能由于随着温度增加,催化剂开始出现团聚,导致催化剂比表面积变小. 比表面积越大说明催化剂表面存在越多的活性位点[23],这些活性位点可以加速TBHP均裂而产生活性氧物质,又可以为甲苯的活化提供反应场所,从而加速甲苯的活化,促进反应的进行.
| 表 1 不同锰氧化物比表面积 Table 1 Surface area of different manganese oxides |
由图2的SEM表征结果可以看出,MnOx-80是一种长度约为300 nm,宽度约为50 nm的纳米棒,而MnOx-120对比与MnOx-80开始出现长短粗细不均匀的情况,其单纳米棒的长宽与MnOx-80类似. 相对前两种锰氧化物,MnOx-160的长宽明显更大,其中纳米棒长度约为800 nm,宽度约为100 nm. 当反应温度升至180 ℃时,从图2(d)可以看出,催化剂出现明显的团聚现象并且生成类似于水晶状的复合材料结构,并且单体的纳米棒大小急剧增大,长达4 μm,宽250 nm. 图2的SEM表征结构与比表面积BET和XRD表征结果一致. 随着反应温度的升高,催化剂产物发生改变,并且由于团聚作用,使得催化剂比表面积变小.

|
图 2 不同反应温度制得锰氧化物的SEM图片(a) 80 ℃,(b) 120 ℃,(c) 160 ℃,(d) 180 ℃ Figure 2 SEM images of different manganese oxides by reaction of different temperatures (a) 80 ℃; (b) 120 ℃; (c) 160 ℃; (d) 180 ℃ |
TPR表征结果如图3所示,4种催化剂氢还原峰都出现在180 ℃~450 ℃范围内,氢还原峰位的不同说明催化剂之间的Mn-O键强度不同,而Mn-O的键强直接说明了Mn自身各价态之间氧化还原能力. 200 ℃至350 ℃之间明显的氢还原峰表示MnO2→Mn3O4的还原过程,而温度升高时的氢还原峰则对应更深层的还原过程Mn3O4→MnO[24]. 从TPR表征结果可以看出,4种锰氧化物的低温还原峰位置递增顺序为:MnOx-80 (283 ℃)<MnOx-160 (284 ℃)<MnOx-180 (290 ℃)<MnOx-120 (308 ℃), 高温还原峰峰位递增顺序为:MnOx-80 (283 ℃)<MnOx-120 (337 ℃)<MnOx-160 (380 ℃)<MnOx-180 (383 ℃),由此可以说明,相对于其他3个温度合成的催化剂,80 ℃下合成的锰氧化物中Mn-O键连接较弱,更容易发生自身各价态之间的氧化还原[25]. 因为TPR峰面积和催化剂耗氢量有着紧密的联系,我们对4种催化剂的TPR峰面积进行比较,从而判断出4种催化剂的耗氢量大小. 根据表2所示,MnOx-80的总耗氢量明显低于其他3种样品,这说明在MnOx-80中存在大量的阴离子空位以及混合价态Mn(Ⅳ)和Mn(Ⅲ)[18]. 而结晶度更高的MnOx-160和MnOx-180的耗氢量更多,更接近理论的n(H2)/n(Mn)=1的理论值. 并且从图3以及表2可以看出,随着反应温度的升高,高温峰有向高温段偏移的现象,并且当反应温度为160 ℃和180 ℃时高温峰明显不再与低温峰重合,且峰面积仅略小于低温峰峰面积,再次说明了随着反应温度的增加,生成了含Mn(Ⅲ)的MnOOH,导致高温峰峰面积激增.
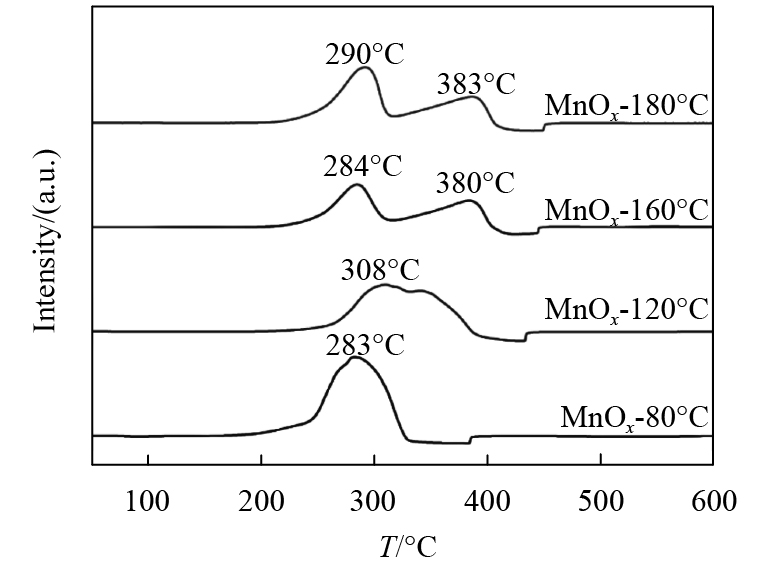
|
图 3 不同反应温度制得锰氧化物的TPR曲线 Figure 3 TPR graph of different manganese oxides by reaction of different temperatures |
| 表 2 不同锰氧化物在不同还原段的耗氢峰面积 Table 2 The area of staged hydrogen consumption of different manganese oxides |
对于甲苯的选择性催化氧化反应,由于甲苯分子较大,不能进入锰氧化物的孔道中(2×2),因此对于甲苯分子来说,更多的可能是存在于催化剂表面的反应[26]. 从而可以推断出,比表面积越大,获得的表面活性位点越多,从而提供反应场所越多,加速反应进行. 再者,根据锰元素自身特有的多价态之间的氧化还原循环,可以提高TBHP的分解速率以及甲苯的活化速率,从而提升甲苯活化效率,促进反应进行.
选用甲苯的选择性氧化来测试锰氧化物催化剂的性能,反应使用甲苯作为底物,TBHP为氧化剂,在油浴80 ℃下反应6 h. 反应结果汇总如表3,在TBHP为氧化剂的条件下,反应目标产物为苯甲酸,反应副产物为苯甲醛、苯甲醇以及其他微量杂质. 从表3可知,甲苯转化率依次为:MnOx-80(19.53%)>MnOx-120(15.45%)>MnOx-160(11.27%)>MnOx-180(9.49%),并且目标产物苯甲酸选择性为MnOx-80(75.02%)>MnOx-120(51.58%)>MnOx-160(18.06%)>MnOx-180(18.59%). 催化测试结果符合以上表征中的催化剂性能分析.
| 表 3 不同二氧化锰上甲苯选择性氧化反应结果比较 Table 3 Oxidation of toluene over different manganese oxides |
当反应延长至48 h,取4个时间节点的数据作图来进行反应的动力学分析. 从图4可知,甲苯转化率和时间呈现线性关系(y=0.005 99x+0.156 44),随着反应时间的提升,甲苯的转化率逐渐增大,并且目标产物苯甲酸的选择性微弱提升. 考虑到反应周期过长的问题,本文选用了6 h为目标反应时间.
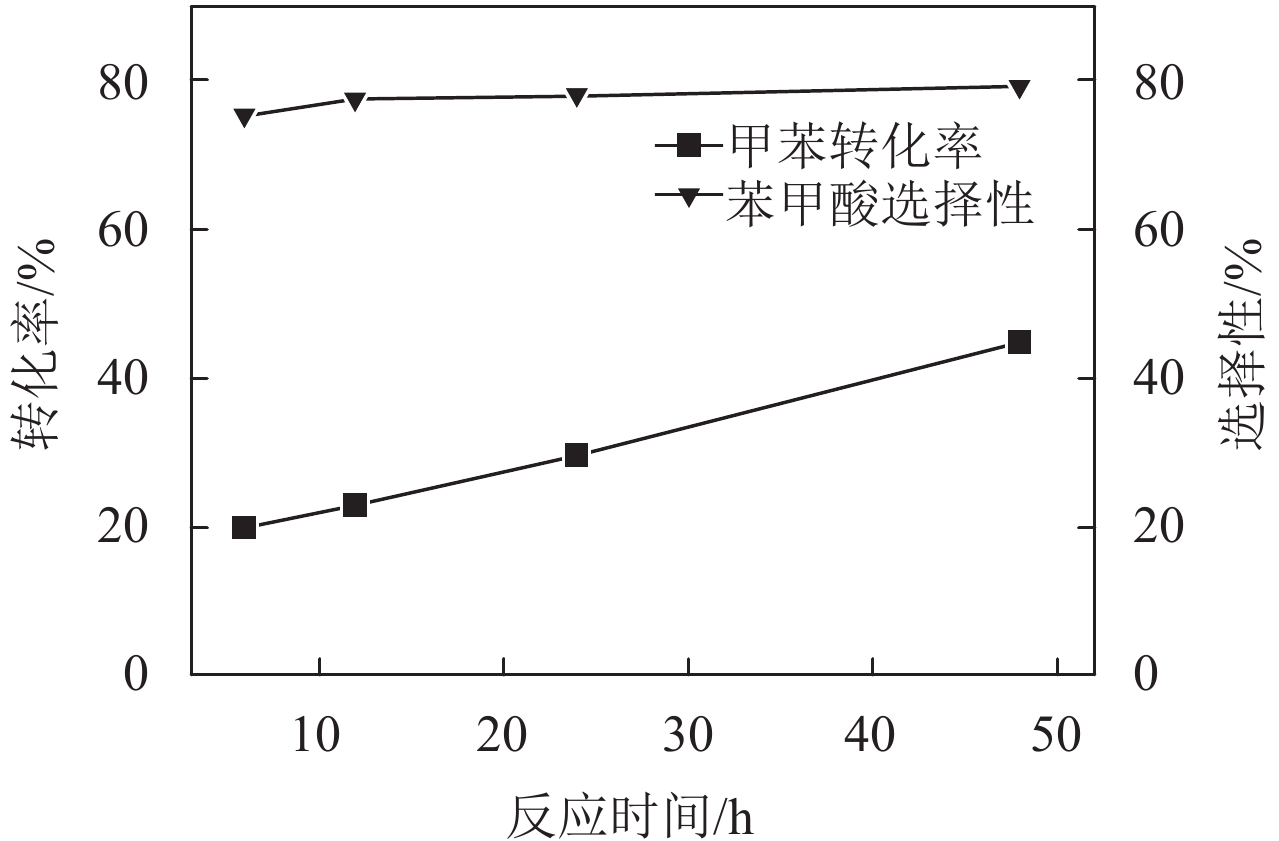
|
图 4 反应时间对甲苯转化率及其产物苯甲酸选择性的影响 Figure 4 Influence of reaction time on the conversion of toluene and selectivity of benzoic acid. Reaction conditions: toluene = 2.5 ml, temperature = 80 ℃, volume of TBHP = 10 ml, weight of catalyst = 50 mg |
图5反映了催化剂质量对反应体系的影响,取催化剂质量0 mg至150 mg,其他反应条件不变. 当无催化剂的条件下,甲苯转化率极低. 当有催化剂存在的情况下,50 mg催化剂时,达到反应的最优效果,甲苯转化率为19.53%,目标产物苯甲酸的选择性达到75.02%,随着催化剂量的增加,甲苯转化率反而降低,目标产物苯甲酸的选择性也逐步下降. 根据Shelton介绍的反应机制[27],当低极性介质中存在过渡金属氧化物时,在催化剂高负载量的情况下,催化剂会更快地使TBHP分解,并且分解生成的自由基将会彼此结合而使自由基反应终止. 因此50 mg催化剂的量是反应体系的最佳选择.
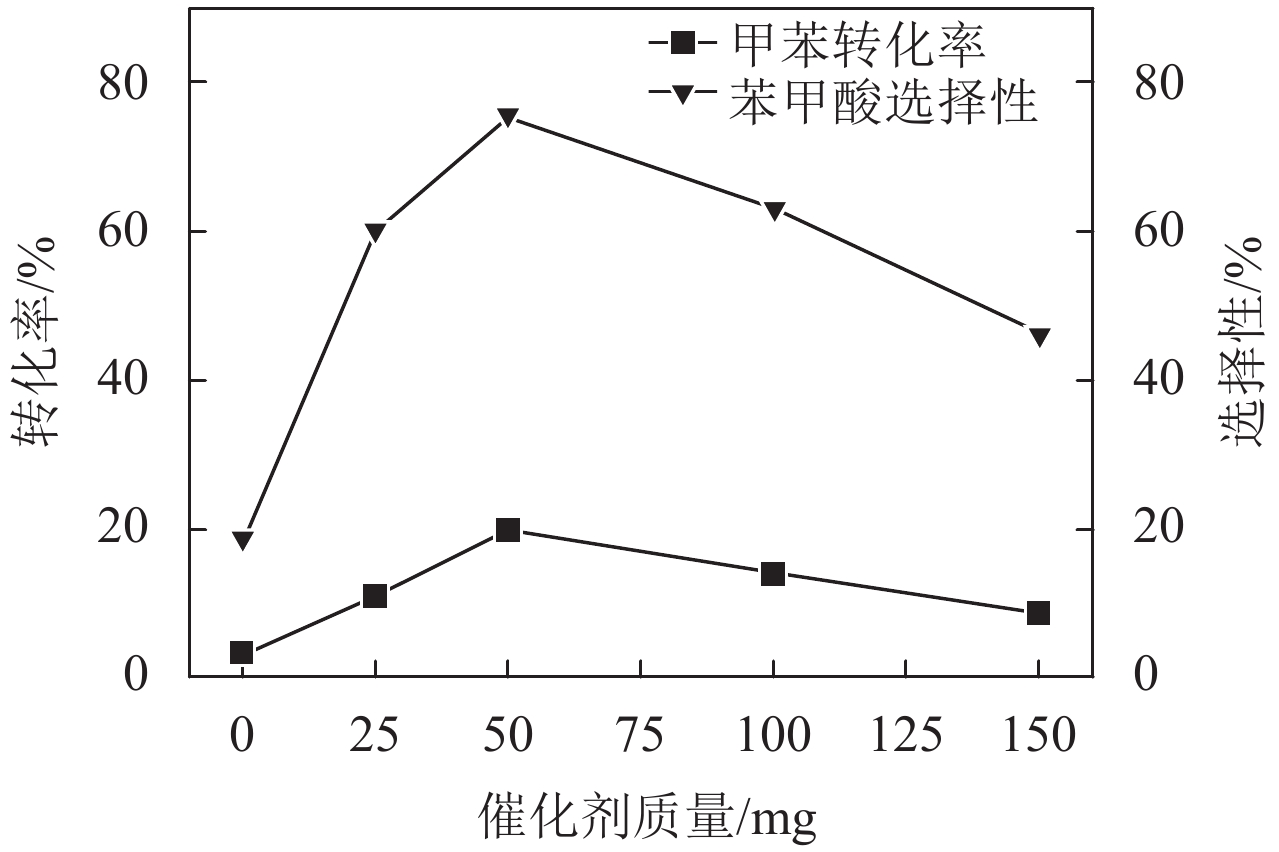
|
图 5 催化剂的量对甲苯转化率及其产物苯甲酸选择性的影响 Figure 5 Influence of weight of catalyst on the conversion of toluene and selectivity of benzoic acid. Reaction conditions: toluene = 2.5 ml, temperature = 80 ℃, volume of TBHP = 10 ml, reaction time = 6 h |
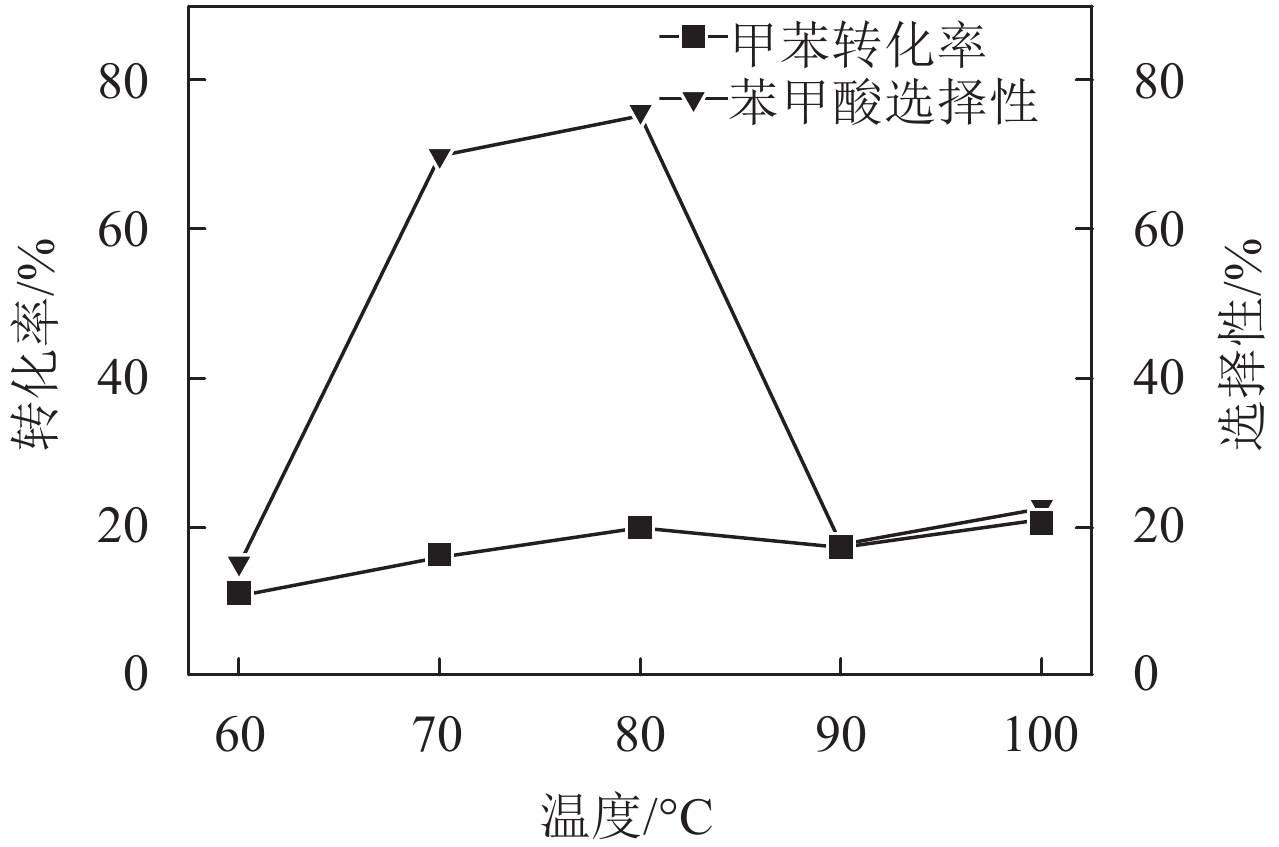
温度对于有机氧化反应来说是重要的因素,由图6可知,随着反应温度的升高,其他反应条件不变,甲苯的转化率呈现先升后降的趋势,当温度达到80 ℃时,甲苯的转化率和苯甲酸的选择性都达到了最优,分别为19.53%和75.02%. 随着温度的升高,虽然甲苯转化率变化不明显,但是苯甲酸的选择性急剧降低. 这是由于当反应温度升高时,TBHP自分解加速,在相同时间内,反应体系中分解生成的自由基浓度将会上升,而自由基会彼此结合而加速自由基反应终止.
|
图 6 反应温度对甲苯转化率及其产物苯甲酸选择性的影响 Figure 6 Influence of reaction temperature on the conversion of toluene and selectivity of benzoic acid. Reaction conditions: toluene = 2.5 ml, volume of TBHP = 10 ml, reaction time = 6 h, weight of catalyst = 50 mg. |
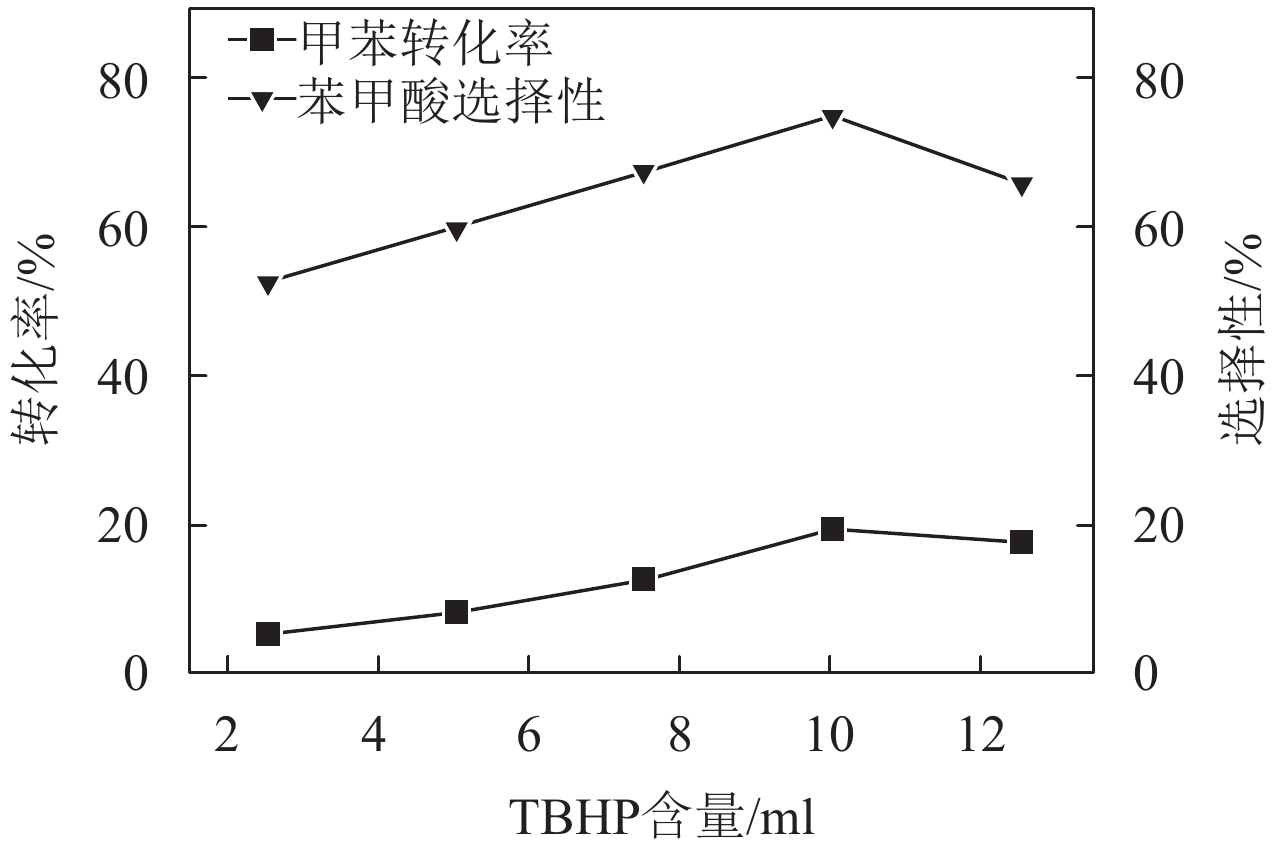
不同氧化剂的含量对反应的影响如图7所示. 当TBHP体积为10 ml(V(甲苯):V(TBHP)=1:4),其他反应条件不变时,反应效果最佳,此时,甲苯的转化率为19.53%,苯甲酸的选择性为75.02%. 随着TBHP含量的继续增加,TBHP在催化剂表面堆积,与甲苯形成竞争吸附,从而导致甲苯的转化率降低,目标产物的选择性下降.
|
图 7 TBHP的量对甲苯转化率及其产物苯甲酸选择性的影响 Figure 7 Influence of volume of TBHP on the conversion of toluene and selectivity of benzoic acid. Reaction conditions: toluene = 2.5 ml, temperature = 80 ℃, reaction time = 6 h, weight of catalyst = 50 mg |
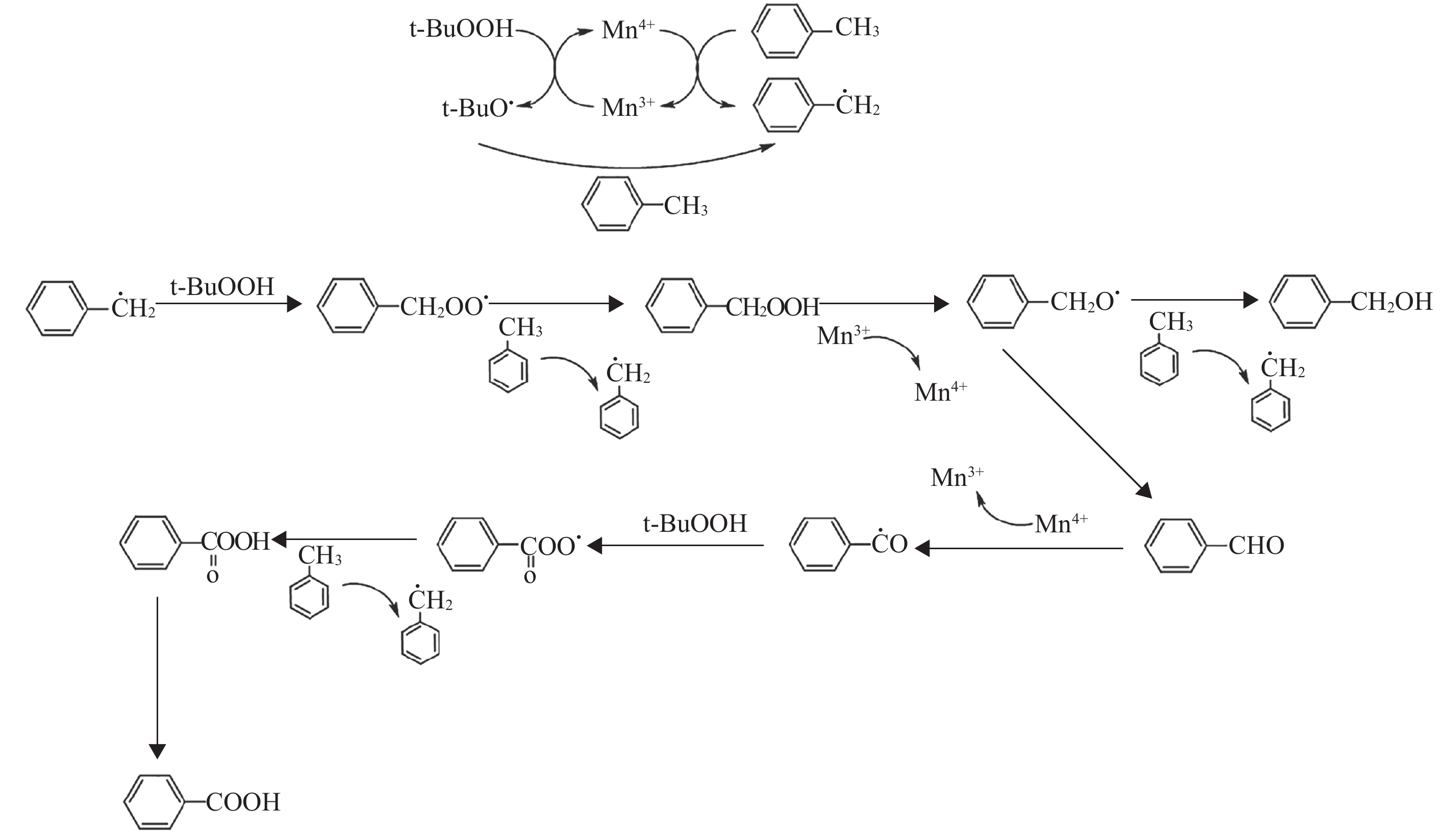
反应机理示意图如图8所示,在甲苯的选择性氧化体系中,TBHP不仅是氧化剂,还是甲苯的自由基引发剂. 但是从表3可以看出,当TBHP和锰氧化物不同时存在的条件下,甲苯的转化率都非常低,只有在TBHP和锰氧化物同时存在的条件下,甲苯的转化率才有巨大的提升. 这说明在两者都存在的条件下,锰氧化物中的Mn(Ⅲ)起到了决定性的作用,由于Mn(Ⅲ)的存在加速了TBHP的均裂,并且为均裂后的活性氧物质提供了较为稳定存在的场所. Hutching等[28]研究发现,活性氧物质在无催化剂的情况下极易容易失活. 而活性氧物质会夺取甲苯侧链的一个H原子而使甲苯转化为苯甲基自由基,而其自身则转化为相应的醇. 当苯甲基自由基大量生成后,由TBHP将苯甲基自由基快速氧化而形成过氧苯甲基自由基,过氧苯甲基自由基同t-BuO·一样,会夺取甲苯侧链的一个H原子,使甲苯被活化,生成苯甲基自由基和过氧苯甲醇,而过氧苯甲醇快速氧化Mn(Ⅲ),生成Mn4+(OH)和苯甲氧基自由基. 当苯甲氧基自由基活化甲苯时生成副产物苯甲醇,而当苯甲氧基自由基发生自我异构化后,生成副产物苯甲醛. 由于Mn4+(OH)的存在,其将会夺取苯甲醛中的H原子,而生成苯甲醛自由基,苯甲醛自由基的氧化过程与上类似,最后生成深度氧化产物苯甲酸.
|
图 8 甲苯的选择性催化氧化反应机理 Figure 8 The mechanism of toluene selectivity oxidation |
利用同一配比的反应物,在不同温度下合成不同的锰氧化物,其中在较低温度的条件下,合成的锰氧化物有较为均一的晶相,随着反应温度的提升,合成的催化剂产生畸变而形成新的晶相.
利用4种不同温度下合成的锰氧化物为催化剂,TBHP为氧化剂,在无溶剂常压条件下选择性催化氧化甲苯展现出优异的甲苯转化率和选择性. 其中MnOx-80拥有较大的比表面积以及大量的阴离子空位和混合价态,这些特征有利于氧化剂TBHP在表面均裂以及活化甲苯,这对甲苯的液相选择性催化氧化非常有利. 在最优反应条件下,反应48 h,甲苯转化率达到44.67%,目标产物苯甲酸的选择性达到79.18%. 反应机理分析可知该反应是一种自由基反应.
| [1] | KESAVAN L, ENACHE D I, TAYLOR S H, et al. Solvent-free oxidation of primary carbon-hydrogen bonds in toluene using Au-Pd alloy nanoparticles[J]. Science, 2011, 331(6014): 195-199. DOI: 10.1126/science.1198458. |
| [2] | ISHII Y, SAKAGUCHI S, IWAHAMA T. Innovation of hydrocarbon oxidation with molecular oxygen and related reactions[J]. Advanced Synthesis & Catalysis, 2001, 343(5): 393-427. |
| [3] | WANG F, XU J, LI X, et al. Liquid phase oxidation of toluene to benzaldehyde with molecular oxygen over copper-based heterogeneous catalysts[J]. Advanced Synthesis & Catalysis, 2005, 347(15): 1987-1992. |
| [4] | BORGAONKAR H V, CHANDALIA S B. Liquid phase oxidation of substituted toluenes by air for the production of pharmaceutical intermediates[J]. Journal of Chemical Technology and Biotechnology, 1984, 34(3): 107-112. |
| [5] | HUANG G, WANG A P, LIU S Y, et al. An efficient oxidation of toluene over Co (II) TPP supported on chitosan using air[J]. Catalysis Letters, 2007, 114(3-4): 174-177. DOI: 10.1007/s10562-007-9061-5. |
| [6] | ILYAS M, SADIQ M. Oxidation of toluene to benzoic acid catalyzed by platinum supported on zirconia in the liquid phase-solvent free conditions[J]. Catalysis Letters, 2009, 128(3-4): 337-342. DOI: 10.1007/s10562-008-9750-8. |
| [7] | LI W B, CHU W B, ZHUANG M, et al. Catalytic oxidation of toluene on Mn–containing mixed oxides prepared in reverse microemulsions[J]. Catalysis Today, 2004, 93: 205-209. |
| [8] | HUANG G, WANG A P, LIU S Y, et al. An efficient oxidation of toluene over Co (II) TPP supported on chitosan using air[J]. Catalysis Letters, 2007, 114(3-4): 174-177. DOI: 10.1007/s10562-007-9061-5. |
| [9] | ACHARYYA S S, GHOSH S, TIWARI R, et al. Preparation of the CuCr2O4 spinel nanoparticles catalyst for selective oxidation of toluene to benzaldehyde [J]. Green Chemistry, 2014, 16(5): 2500-2508. DOI: 10.1039/C3GC42369G. |
| [10] | ILYAS M, SADIQ M. Oxidation of toluene to benzoic acid catalyzed by platinum supported on zirconia in the liquid phase-solvent free conditions[J]. Catalysis Letters, 2009, 128(3-4): 337-342. DOI: 10.1007/s10562-008-9750-8. |
| [11] | WANG X, WU G, LIU H, et al. Solvent-free selective oxidation of toluene with O2 catalyzed by metal cation modified LDHs and mixed oxides [J]. Catalysts, 2016, 6(1): 14. DOI: 10.3390/catal6010014. |
| [12] | JIN L, CHEN C, CRISOSTOMO V M B, et al. γ-MnO2 octahedral molecular sieve: preparation, characterization, and catalytic activity in the atmospheric oxidation of toluene [J]. Applied Catalysis A: General, 2009, 355(1): 169-175. |
| [13] | THOMAS J M, RAJA R, SANKAR G, et al. Molecular-sieve catalysts for the selective oxidation of linear alkanes by molecular oxygen[J]. Nature, 1999, 398(6724): 227-230. DOI: 10.1038/18417. |
| [14] | STAHL S S. Palladium oxidase catalysis: selective oxidation of organic chemicals by direct dioxygen-coupled turnover[J]. Angewandte Chemie International Edition, 2004, 43(26): 3400-3420. DOI: 10.1002/(ISSN)1521-3773. |
| [15] | SADOW A D, TILLEY T D. Catalytic functionalization of hydrocarbons by σ-bond-metathesis chemistry: Dehydrosilylation of methane with a scandium catalyst[J]. Angewandte Chemie International Edition, 2003, 42(7): 803-805. DOI: 10.1002/anie.200390213. |
| [16] | NARAYANAN S, VIJAYA J J, SIVASANKER S, et al. Synthesis of hierarchical ZSM-5 hexagonal cubes and their catalytic activity in the solvent-free selective oxidation of toluene[J]. Journal of Porous Materials, 2015, 22(4): 907-918. DOI: 10.1007/s10934-015-9964-2. |
| [17] | UEMATSU T, MIYAMOTO Y, OGASAWARA Y, et al. Molybdenum-doped α-MnO2 as an efficient reusable heterogeneous catalyst for aerobic sulfide oxygenation [J]. Catalysis Science & Technology, 2016, 6(1): 222-233. |
| [18] |
林健, 蔡钒, 张国玉, 等. γ-MnO2的形貌控制及其甲苯液相氧化性能
[J].
物理化学学报, 2013, 29(3): 597-604.
LIN J, CAI F, ZHANG G Y, et al. Preparation of morphology-tuned γ-MnO2 and catalytic performance for the liquid-phase oxidation of toluene [J]. Acta Physico-Chimica Sinica, 2013, 29(3): 597-604. |
| [19] |
郑海龙, 廖菽欢, 余林. 介孔Cu-Mn复合氧化物催化氧化苯甲醇合成苯甲醛的研究[J].
广东工业大学学报, 2017, 34(2): 28-33.
ZHENG H L, LIAO S H, YU L. A research of mesoporous copper-manganese mixed oxides for selective oxidation of benzyl alcohol to benzaldehyde[J]. Journal of Guangdong University of Technology, 2017, 34(2): 28-33. |
| [20] |
符志伟, 程高, 林婷, 等. 二氧化锰制备及催化燃烧甲苯性能研究[J].
广东工业大学学报, 2016, 33(2): 85-90.
FU Z W, CHENG G, LIN T, et al. The preparation of MnO2 and application in catalytic combustion of toluene [J]. Journal of Guangdong University of Technology, 2016, 33(2): 85-90. |
| [21] | YAMAGUCHI K, WANG Y, MIZUNO N. Manganese oxide-catalyzed additive-and solvent-free aerobic oxidative synthesis of primary amides from primary amines[J]. Chemistry Letters, 2012, 41(6): 633-635. DOI: 10.1246/cl.2012.633. |
| [22] |
张亚辉, 周超, 李妍, 等. 连二亚硫酸钠还原制备纳米银粉[J].
矿冶工程, 2012, 32(4): 113-117.
ZHANG Y H, ZHOU C, LI Y, et al. Preparation of silver nanoparticles using sodium dithionite as reducing agent[J]. Mining and Metallurgical Engineering, 2012, 32(4): 113-117. |
| [23] | ZUO Q, ZHAO P, LUO W, et al. Hierarchically porous Fe–N–C derived from covalent-organic materials as a highly efficient electrocatalyst for oxygen reduction[J]. Nanoscale, 2016, 8(29): 14271-14277. DOI: 10.1039/C6NR03273G. |
| [24] | SUN M, YU L, YE F, et al. Transition metal doped cryptomelane-type manganese oxide for low-temperature catalytic combustion of dimethyl ether[J]. Chemical Engineering Journal, 2013, 220: 320-327. DOI: 10.1016/j.cej.2013.01.061. |
| [25] | HUANG H, MENG Y, LABONTE A, et al. Large-scale synthesis of silver manganese oxide nanofibers and their oxygen reduction properties[J]. The Journal of Physical Chemistry C, 2013, 117(48): 25352-25359. DOI: 10.1021/jp409507h. |
| [26] |
凌飞, 邓丽杰, 陈平, 等. 氧化锰八面体分子筛的合成, 表征以及其催化燃烧性能[J].
浙江大学学报(理学版), 2011, 38(1): 73.
LING F, DENG L J, CHEN P, et al. Synthesis, characterization and catalytic combustion properties of manganese oxide octahedral molecular sieve[J]. Journal of Zhejiang University (Science Edition), 2011, 38(1): 73. |
| [27] | SHELDON R A, KOCHI J K. Metal-catalyzed oxidations of organic compounds in the liquid phase: A mechanistic approach[J]. Advances in Catalysis, 1976, 25: 272-413. |
| [28] | BIN SAIMAN M I, BRETT G L, TIRUVALAM R, et al. Involvement of surface-bound radicals in the oxidation of toluene using supported Au-Pd nanoparticles[J]. Angewandte Chemie International Edition, 2012, 51(24): 5981-5985. DOI: 10.1002/anie.201201059. |
 2017, Vol. 34
2017, Vol. 34

